PROVIDING MEDICAL ORGANIZATIONS WITH QUALIFIED PERSONNEL
Подготовка специалистов для фармацевтической разработки: проблемы и пути решения
1 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
2 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: https://orcid.org/0000-0002-3752-7848
3— Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: http://orсid.org/0000-0001-5579-394X
4 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: https://orcid.org/0000-0002-5795-0803
Обеспечение лекарственной безопасности – одна из приоритетных стратегических задач в условиях санкционного давления, для решения которой необходимо создание развитой системы подготовки будущих фармацевтических специалистов, особенно в области промышленной фармации, поскольку в настоящее время большой проблемой является отсутствие в образовательных программах вузов дисциплин и практик, которые бы сформировали у студентов знания и умения, необходимые специалисту по фармацевтической разработке. В статье представлен сравнительный анализ профессиональных компетенций и структуры (содержания) образовательных программ подготовки специалистов для фармацевтической разработки, по результатам которого были выявлены существенные несоответствия между требованиями фармкомпаний к потенциальному работнику и уровнем подготовки выпускников фармвузов. Предложены возможные пути совершенствования образовательного процесса подготовки специалистов по фармацевтической разработке.
Keywords: фармацевтическая разработка, подготовка кадров, образовательные стандарты, профессиональные стандарты
Фармацевтическая промышленность, базирующаяся на концепции надлежащих фармацевтических практик, является одной из главных составляющих, обязательных для обеспечения благополучия и здоровья населения. В последние годы для отечественных фармацевтических компаний стала характерной тенденция увеличения темпов разработки инновационных продуктов и оптимизации ассортимента воспроизведенных лекарственных препаратов. В этой связи возникла острая необходимость в квалифицированном персонале для оперативного решения задач в условиях меняющейся государственной политики и обновления требований ЕАЭС в сфере обращения лекарственных средств, включая фармацевтическую разработку и вывод лекарственных препаратов на рынок. Правила GMP указывают на важность формирования профессиональной команды: «Надлежащее производство лекарственных средств зависит от персонала. Поэтому на предприятии должно быть достаточное количество квалифицированного персонала для решения всех задач, относящихся к сфере ответственности производителя. Каждый сотрудник должен понимать индивидуальную ответственность, которая должна быть документально оформлена» [1].
На основе данных современных публикаций были выявлены основные проблемы, с которыми сталкиваются работодатели в сфере промышленной фармации при подборе персонала (рисунок 1 и 2) [2].
Ввиду определения важности квалифицированного персонала для сферы фармацевтической разработки, возникает необходимость в четком определении знаний специалиста, его профессиональных умений и уровня образования с приоритетной направленностью в фармацевтической области.
В настоящее время среди государственных приоритетов развития фармацевтической отрасли, затрагивающих подготовку кадров, можно выделить следующие:
- Развитие системы подготовки будущих специалистов фармацевтической области с учетом современных тенденций автоматизации производства, внедрения непрерывных и телемедицинских технологий.
- Создание системы подготовки кадров для обеспечения потребностей фармацевтической отрасли, включая развитую образовательную и научную инфраструктуру.
Мерами, способствующими подготовке научных, технологических и производственных кадров для фармацевтической отрасли в Российской Федерации1, являются:
- дальнейшее совершенствование профессиональных стандартов, предусматривающее разработку гибких образовательных программ, расширение возможности усиления практической подготовки студентов с участием предприятий, формирование профессиональных компетенций с учетом потребностей фармацевтической отрасли и конкретного региона, направленных в том числе на повышение эффективности российских исследовательских организаций в области фармацевтической разработки и сырьевых компонентов, а также средств производства в соответствии со Стратегией научно-технологического развития Российской Федерации2;
- дальнейшее развитие компетенций в области разработки лекарственных препаратов, предназначенных для лечения социально значимых заболеваний, преобладающих в структуре заболеваемости и смертности населения Российской Федерации, и заболеваний, представляющих опасность для окружающих, в том числе в аптечных условиях, с использованием полупромышленного оборудования и производственной фасовки субстанций в малых дозах.
Процесс совершенствования профессиональных стандартов для специалистов сферы промышленной фармации подтверждается активной их разработкой в последние годы, среди которых выделены следующие направления3:
- специалист по промышленной фармации в области обеспечения качества лекарственных средств;
- специалист по промышленной фармации в области исследований лекарственных средств;
- специалист по промышленной фармации в области контроля качества лекарственных средств;
- специалист по промышленной фармации в области производства лекарственных средств и др.
Согласно трудовому кодексу РФ (статья 195.1), профессиональный стандарт – характеристика квалификации, необходимой работнику для осуществления определенного вида профессиональной деятельности, в том числе выполнения определенной трудовой функции4. В соответствии со статьей 195.3 ТК РФ «Применение профессиональных стандартов» определена их значимость для решения следующих задач5:
- формирование кадровой политики и управление персоналом при организации обучения и аттестации работников, разработке должностных инструкций, тарификации работ, формировании системы оплаты труда с учетом особенностей организации производства, труда и управления;
- разработка федеральных государственных образовательных стандартов профессионального образования и программ и др.
Профессиональные стандарты являются ориентиром для формирования кадровой политики в организациях, определяя область необходимых знаний и умений, которыми должен обладать как потенциальный сотрудник, так и сформированная профессиональная команда.
Фармацевтическая разработка – многоступенчатый процесс, предполагающий организацию и проведение разного рода исследований – от выбора стратегии до проведения клинических исследований, а также работу с экспертными организациями для получения разрешительной документации для ввода в обращение лекарственных препаратов. При этом требуются как специфические знания специалистов на каждом этапе, так и общие знания для всех – в целях качественной и эффективной разработки.
Анализируя необходимые компетенции специалистов в сфере фармацевтической разработки на основе обозначенных выше профессиональных стандартов, можно сделать вывод, что специалист по фармацевтической разработке должен знать:
- требования Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза6;
- правила надлежащей производственной практики7;
- нормативные правовые акты и стандарты в области качества лекарственных средств;
- методы и инструменты управления рисками для качества лекарственных средств;
- методы поиска причин несоответствий установленным требованиям при производстве лекарственных средств.
По нашему мнению, к данному списку в базовом понимании необходимо также включить знание Правил государственного регулирования обращения лекарственных средств, регуляторных процедур в отношении лекарственных препаратов для грамотного построения работы и ведения документации, соответствующей требованиям регистрации лекарственных препаратов [3, 4]. В подтверждение этому стоит отметить значимость регуляторных вопросов для поддержания качества лекарственных препаратов на всех этапах жизненного цикла (рисунок 3).
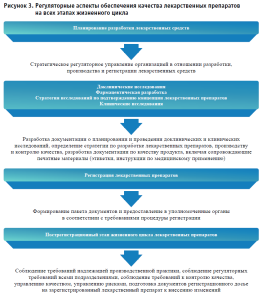
Стоит обратить внимание на обозначенные в профессиональных стандартах группы занятости, способные выполнять трудовые функции по фармацевтической разработке, среди которых: провизоры (2262), химики (2113); биологи, ботаники, зоологи и специалисты родственных занятий (2131); инженеры в промышленности и на производстве (2141); инженеры-химики (2145); руководители подразделений по научным исследованиям и разработкам (1223); специалисты в области техники, не входящие в другие группы (2149).
Хотелось бы отметить отсутствие среди представленных групп занятости сведений о специалистах, имеющих базовую медицинскую подготовку, хотя процесс фармацевтической разработки иногда предопределяет необходимость организации, проведения и мониторинга клинических исследований лекарственных препаратов, что является достаточно специфической сферой и требует определенного набора знаний и навыков.
Возникает вопрос, который отражает проблемы со стороны управления знаниями выпускников высших учебных заведений по обозначенным выше направлениям подготовки – насколько преподаваемый объем знаний в вузах может обеспечить подготовку специалистов для фармацевтической разработки в соответствии с требованиями, предусмотренными Профессиональными стандартами сферы промышленной фармации в части необходимых знаний и умений?».
Предварительный анализ образовательных стандартов по обозначенным выше группам занятости показывает, что, как правило, в образовательном процессе не предусматриваются дисциплины, способные сформировать у студентов полное понимание процессов, необходимых специалистам сферы промышленной фармации.
В качестве примера представим проведенный нами анализ образовательных стандартов различных образовательных организаций высшего образования по направлениям: фармация, биология, химия, медицинская биотехнология, химическая технология, биоинженерия и биоинформатика, биотехнология, медицинская биохимия.
Анализировались общие дисциплины (по количеству академических часов), знание которых необходимо для специалиста по фармацевтической разработке: аналитическая химия, химия биологически активных веществ, биохимия, общая и неорганическая химия, органическая химия, физическая и коллоидная химия, фармакология, фармацевтическая технология.
Как видно из рисунка 4, количество академических часов по дисциплинам варьирует, что предопределяет разный объем знаний у специалистов, и это необходимо учитывать при формировании профессиональной команды, определяя компетентность каждого сотрудника.
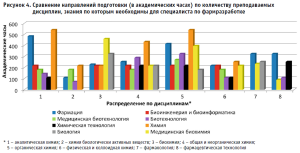
Каждое из рассматриваемых направлений подготовки имеет свою специфику в области знаний и умений, что показывает направленность специалиста только в определенной сфере деятельности в области промышленной фармации. Краткая характеристика по направлениям подготовки и специфичным дисциплинам (знания по которым применимы в области фармразработки) представлена в таблице 1.
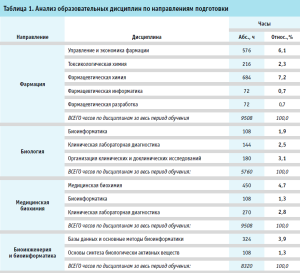
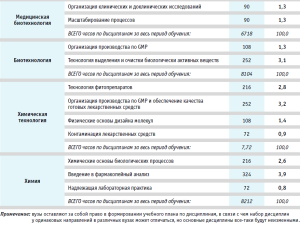
По данным из представленной таблицы можно сделать следующие выводы:
- Каждое направление имеет специфику образовательных дисциплин, что свидетельствует о том, что специалист по определенному направлению обладает только специфичными для данной области знаниями и умениями. Для возможности сопряжения сфер профессиональной деятельности смежной направленности необходимо получение дополнительных знаний.
- Дисциплины каждого направления не затрагивают область общих необходимых знаний специалиста по фармацевтической разработке, указанных в Профессиональном стандарте.
- Невозможно оценить в содержании рассмотренных образовательных программ различных специальностей отражение вопросов, являющихся значимыми в соответствии с профессиональными стандартами: контроль и управление фармацевтической системой качества, регуляторные правила в части фармацевтической разработки и регистрации лекарственных препаратов, прецедент в отношении лекарственных препаратов и др.
Подводя итог вышесказанному, необходимо отметить, что проблемой в настоящее время является отсутствие в образовательных программах образовательных организаций дисциплин и практик, которые бы сформировали у студентов общие необходимые знания и умения специалиста по фармацевтической разработке.
В методических рекомендациях по проектированию образовательных программ в системе подготовки кадров для обеспечения перспективного развития фармацевтической отрасли РФ также определены роли в сфере фармацевтической промышленности специалистов разных направлений (укрепленных групп специальностей и направлений (УГСН))8. Сопряжение основных сфер профессиональной деятельности в фармацевтической отрасли с УГСН подготовки высшего образования показано на рисунке 5.
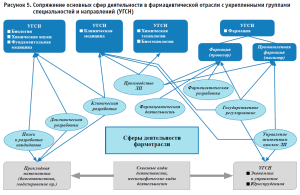
Таким образом, образовательным организациям необходимо проектировать программы дисциплин и практик для групп направлений «Фармация» и «УГСН» с учетом получения следующих знаний8 [3, 4]:
- Фундаментальные и прикладные исследования по поиску и получению фармакологически активных агентов. (Поиск и синтез химическими методами).
- Доклиническая разработка. (Менеджмент проведения доклинических исследований. Проведение исследований с биологическими объектами in vitro, in silico, in vivo. Обеспечение качества ДКИ (GLP)).
- Клиническая разработка. (Планирование и сопровождение КИ. Инструментальные биоаналитические исследования. Обеспечение качества КИ (GCP)).
- Фармацевтическая разработка. (Разработка технологического процесса и его трансфер. Разработка методик контроля, инструментальные фармакопейные исследования и трансфер. Разработка состава лекарственной формы).
- Промышленное производство лекарственных средств. (Контроль качества, инструментальные фармакопейные исследования и трансфер. Обеспечение качества (GMP). Валидация и трансфер).
- Фармацевтическая деятельность. (Обеспечение качества, хранение, транспортирование и отпуск (GSP, GPP, GDP). Изготовление лекарственных препаратов).
- Государственное регулирование. (Сопровождение государственной регистрации, лицензирования. GRP. Мониторинг соотношения эффективность/безопасность лекарственных препаратов (фармаконадзор) GPHP).
- Реклама и продвижение лекарственных препаратов. (Разработка медицинских текстов. Планирование и контроль выполнения рекламных компаний. Подготовка и согласование рекламных материалов).
С учетом обозначенных аспектов и образовательных возможностей высших учебных заведений возможны следующие пути подготовки специалистов для фармацевтической разработки:
- В связи с отличием образовательных стандартов по дисциплинам в вузах по направлениям подготовки, предоставить возможность дополнительной подготовки в рамках магистратуры, аспирантуры и курсов повышения квалификации. Также данная возможность необходима для УГСН, чтобы формировать их направленность на сферу промышленной фармации (рисунок 6).
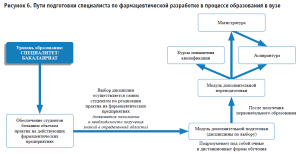
Стоит отметить, что в Российской Федерации на сегодняшний день организованы программы подготовки в области промышленной фармации на уровне магистратуры, однако зачастую они касаются отдельных этапов жизненного цикла лекарственных препаратов (производства, контроля качества, системы обеспечения качества), однако специфика фармацевтической разработки и комплексное рассмотрение всех ее аспектов не находит отражения в предлагаемых программах.
По нашему мнению, необходимо научно-методическое обоснование разработки такой программы, включающей обязательные и вариативные модули дисциплин, исходя из этапов и специфики фармацевтической разработки (регуляторные основы, фармацевтическая система качества, сопровождение доклинических и клинических исследований, основы технологических и аналитических исследований, трансфер, регистрация и ввод в обращение, фармаконадзор), с учетом общих подходов к организации и реализации совместных проектов (управление проектами, командообразование, управление рисками, конфликтология и успешная коммуникация и др.) (рисунок 7).
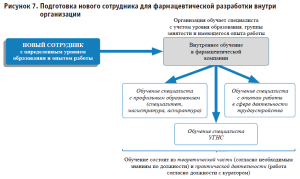
- Формирование компетентности специалистов для фармацевтической разработки путем создания внутренних стандартов в компании-разработчике лекарственных препаратов по обучению нового сотрудника до требуемых стандартов, с учетом специфики и уровня его образования, а также опыта работы.
________________________________________________________________________________
1 Распоряжение Правительства Российской Федерации от 07.06.2023 № 1495-р «О Стратегии развития фармацевтической промышленности Российской Федерации на период до 2030 года». URL: https://www.garant.ru/products/ipo/prime/doc/406959554/
2 Указ Президента Российской Федерации от 28.02.2024 № 145 «О Стратегии научно-технологического развития Российской Федерации». URL: https://www.garant.ru/products/ipo/prime/doc/408518353/?ysclid=m0m93aodl7104603751.
3 Приказы Министерства труда и социальной защиты Российской Федерации от 22.05.2017 №№ 429н – 432н.
4 Трудовой кодекс Российской Федерации от 30.12.2001 № 197-ФЗ (ред. от 30.01.2024) Ст. 195.1. Понятия квалификации работника, профессионального стандарта (с изм. и доп. в ред. от 02.05.2015).
5 Там же, ст. 195.3. Порядок применения профессиональных стандартов.
6 Соглашение о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза (Москва, 23 декабря 2014 г.). URL: https://base.garant.ru/70832636/?ysclid=m0mccvb5ox111917550.
7 Приказ Министерства промышленности и торговли РФ от 14.06.2013 № 916 «Об утверждении правил надлежащей производственной практики» (с изменениями и дополнениями). URL: https://base.garant.ru/70451198/?ysclid=m0mce7pmos593026437.
8 Караваева Е.В. Формирование содержания и методического обеспечения системы многоуровневой опережающей подготовки кадров для перспективного развития фармацевтической отрасли. Презентация. URL: http://www.acur.msu.ru/pharma2020/applications/2_RefresherTraining2017.pdf (дата обращения: 12.12.2023).
- Решение Совета Евразийской экономической комиссии от 03.11.2016 № 77 (ред. от 04.07.2023) «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». Глава 2. Персонал.
- Смирнов В.А., Горячкин В.В., Шестаков В.Н., Абрамович Р.А. Проблемы управления производственным персоналом при внедрении фармацевтической системы качества // Ремедиум. – 2019. – № 4. – С. 51–55. DOI: 10.21518 / 1561–5936–2019–04-51-55.
- Береговых В.В., Пятигорская Н.В., Аладышева Ж.И. Регуляторная наука: современные тенденции в науке и образовании в области лекарственных средств // Вестник Российской академии медицинских наук. – 2012. – № 12. DOI:10.15690/vramn.v67i12.480.
- Аладышева Ж.И., Пятигорская Н.В., Максимкина Е.А., Береговых В.В., Чибиляев Т.Х. Роль и функции подразделения по регулированию лекарственных средств на фармацевтическом предприятии // Ремедиум. – 2013. – С. 52–56.
