LABORATORY CONTROL
Валидация методики определения титра вируса болезни Ауески на культуре клеток Vero B
1 — Ярославский филиал Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 150030, Российская Федерация, г. Ярославль, ул. 1-я Технологическая, д. 4.
2 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
ORCID: https://orcid.org/0000-0001-6048-8974
3 — Ярославский филиал Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 150030, Российская Федерация, г. Ярославль, ул. 1-я Технологическая, д. 4.
4 — Ярославский филиал Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 150030, Российская Федерация, г. Ярославль, ул. 1-я Технологическая, д. 4.
5 — Ярославский филиал Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 150030, Российская Федерация, г. Ярославль, ул. 1-я Технологическая, д. 4.
6 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.; Ярославский филиал Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 150030, Российская Федерация, г. Ярославль, ул. 1-я Технологическая, д. 4.
7 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
ORCID: https://orcid.org/0000-0002-1111-2441
В статье представлена методика определения титра вируса псевдобешенства (болезни Ауески) Suid herpesvirus 1 (SHV-1) на культуре клеток Vero B. Среднее значение титра вируса (±95% ДИ), вычисленного по методу Рида и Менча в четырех повторах, составило 7,08±0,26 lgТЦД50/мл. В результате валидации подтверждена специфичность методики. Прецизионность (повторяемость, сходимость) методики составила не более 3,26 %, устойчивость (внутрилабораторная воспроизводимость) – не более 1,65 %.
Keywords: болезнь Ауески, вирус псевдобешенства, титр вируса, валидация методики, контроль качества
Background.
Вирус псевдобешенства (болезни Ауески) Suid herpesvirus 1 (SuHV-1) относится к виду вирусов рода Varicellovirus подсемейства Alphaherpesvirinae семейства Herpesviridae. Способен вызывать поражение центральной нервной системы и других органов (в т.ч. дыхательных путей) практически у всех млекопитающих, кроме людей и бесхвостых обезьян [1, 2]. Однако среди вирусов группы герпеса имеются представители, патогенные и для человека [3].
Методика, направленная на определение титра вируса на культуре клеток, может применяться для осуществления контроля качества лекарственных средств на различных этапах биотехнологического производства, например, при разработке или производстве вакцин [4]. А также в качестве экспериментальной модели по оценке эффективности новых противовирусных препаратов [5].
Цель исследования
Подтвердить в условиях лаборатории, что методика определения титра вируса псевдобешенства (болезни Ауески) способна обеспечить получение ожидаемых результатов, при этом получаемые результаты воспроизводимы и достоверны.
Материалы и методы
Для проведения исследований были использованы следующие основные материалы:
- вирус болезни Ауески SuHV-1, получен из государственной коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ», паспорт № 423, штамм «ВК», пассаж № 7 в КК ЯДК от 26.10.2020, лиофилизат от 16.11.2020;
- клеточная линия Vero B – эпителий почки африканской зеленой мартышки;
- получена из коллекции лаборатории иммунобиологических препаратов Ярославского филиала ФГБУ «ИМЦЭУАОСМП» Росздравнадзора;
- питательные среды: среда ДМЕМ, содержащая глюкозу 1 г/л; фетальная бычья сыворотка (FBS); антибиотики: пенициллин-стрептомицин (100 МЕ/мл и 0,1 мкг/мл).
При приготовлении ростовой среды для культивирования клеточной культуры в 450 мл среды ДМЕМ добавляли 45 мл FBS и 4,5 мл раствора пенициллин-стрептомицина (100 МЕ/мл и 0,1 мкг/мл). В качестве поддерживающей среды использовали питательную ДМЕМ без FBS и антибиотиков. Культивирование клеточной линии осуществляли в СО2-инкубаторе при температуре (37,0±1,0)°С и содержании углекислого газа (5,0±1,0)%, с влажностью не менее 80%. Клетки пересевали каждые 72–96 часов.
Наработка вирусной суспензии проводилась на клеточной линии Vero B с монослоем 90–100% в поддерживающей среде. Использовали два культуральных флакона: один – для роста вируса (с 0,5 мл вирусной суспензии), второй – в качестве контрольного (с 0,5 мл раствора натрия хлорида 0,9 %) для оценки наличия изменений клеточной линии. После добавления вирусной суспензии на «голый» монослой флаконы инкубировались в СО2-инкубаторе в течение 10 минут при температуре (37,0±1,0)°С без питательной среды с последующей реинкубацией в поддерживающей питательной среде (7 мл) при температуре (37,0±1,0)°С, содержании углекислого газа (5,0±1,0)% и влажностью не менее 80% в течение 72–96 часов до проявления типичной картины цитопатического действия (ЦПД). После отделения всех клеток от флакона, для наилучшего высвобождения вируса из клеток, проводили лизирование клеток с помощью двукратной заморозки и разморозки с последующим центрифугированием при 10000 об/мин в течение 20 минут. Супернатант вирусной суспензии отбирали, фильтровали через стерильный шприцевой фильтр с размером пор 0,45 мкм и использовали для дальнейшей наработки вируса в соответствии с методикой, описанной выше.
Процедура испытания. Для определения титра вируса использовали монослой клеточной культуры Vero B, предварительно выращенный в лунках культурального плоскодонного 96-луночного планшета. Для этого по 100 мкл клеточной суспензии с концентрацией 0,1 106 кл/мл помещали в каждую лунку. Планшет инкубировали в СО2-инкубаторе при температуре (37,0±1,0)°С и содержании углекислого газа (5,0±1,0)%, с влажностью не менее 80% в течение 24–72 часов.
Для определения титра использовали 5-й пассаж вируса. Разведения от 10-1 до 10-10 готовили в поддерживающей среде с использованием глубоколуночного планшета.
Из планшета с монослоем клеток Vero B отбирали среду. На клетки в соответствующие лунки вносили по 100 мкл приготовленных разведений суспензии вируса; использовали по 4 лунки на каждое разведение. В качестве контроля роста клеточной культуры использовали 16 крайних лунок планшета, в которые вносили по 100 мкл поддерживающей среды. Планшет помещали в СО2-инкубатор. По истечении 48 часов инкубации планшеты просматривали в инвертированном микроскопе на наличие ЦПД вируса на клеточную культуру Vero B.
Расчет титра вируса проводили методом Рида и Менча и выражали в lgТЦД50/мл – десятичном логарифме 50% тканевой цитопатогенной дозы в 1 мл суспензии вируса [6].
Процедура валидации методики. С целью валидации методики определение титра вируса выполнялось двумя испытателями в двух повторах, в один день, на одном и том же пассаже вируса, с использованием одной серии поддерживающей питательной среды.
В качестве валидационных характеристик определялись специфичность, прецизионность и устойчивость (робастность) методики [7].
Специфичность методики подтверждается отсутствием характерных цитопатических изменений в лунках с контрольной культурой клеток (без вируса). Дополнительным подтверждением специфичности может служить достаточный уровень прецизионности.
Прецизионность методики – степень разброса отдельных результатов, оценивалась по величине коэффициента вариации результатов (CV,%), полученных в одинаковых регламентированных условиях для каждого исполнителя.
Устойчивость (робастность) методики – степень внутрилабораторной прецизионности или воспроизводимости результатов, оценивалась по коэффициенту вариации результатов (CV,%), полученных от разных исполнителей.
Статистическую обработку данных проводили с использованием MS Excel.
Результаты и их обсуждение
Определение титра вируса. Характер ЦПД вируса SuHV-1 в культуре клеток Vero B спустя 48 часов после инкубирования представлен полной деструкцией монослоя, формированием клеток округлой формы (рис. 1).
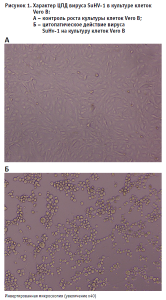
Для расчета ТЦД50 (тканевая цитопатическая доза, вызывающая гибель 50% тест-системы) вируса по методу Рида и Менча применяли расчет процента лунок с проявлением ЦПД для всех разведений вирусной суспензии в каждом повторе (табл. 1).
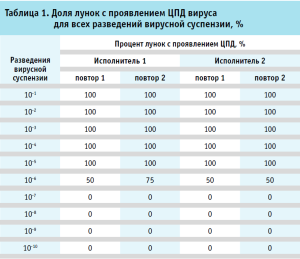
Метод Рида и Менча подразумевает, что клеточная культура, погибшая при воздействии вируса в данном разведении, погибнет и при более низких разведениях вирусной суспензии. Для расчета титра вируса в lgТЦД50/мл использовалась формула (1):
![]() (1)
(1)
где:
Х – титр вируса в lgТЦД50/мл;
А – процент лунок с проявлениями ЦПД при ближайшей к ТЦД50 более высокой дозе (ближайшем меньшем разведении);
В – процент лунок с проявлениями ЦПД при ближайшей к ТЦД50 более низкой дозе (ближайшем большем разведении);
Р – показатель степени наибольшего разведения вируса, которое вызывает 100% ЦПД;
1 – справочная величина поправки для расчета ТЦД50 в 1 мл с учетом количества вируссодержащего материала, содержащегося в 0,1 мл, взятом для заражения одной лунки с культурой клеток [4].
Рассчитанные по методу Рида и Менча значения титра вируса SuHV-1 для всех повторов представлены в таблице 2.
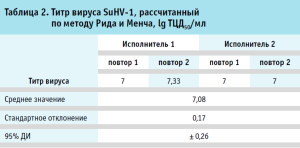
Определение валидационных характеристик методики. В лунках с контрольной культурой клеток Vero B отсутствовали проявления ЦПД, что подтверждает специфичность методики.
Результаты оценки прецизионности (повторяемости, сходимости) и устойчивости (внутрилабораторной воспроизводимости) методики представлены соответственно в таблицах 3 и 4.
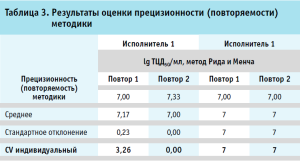
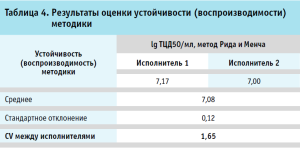
Таким образом, прецизионность (повторяемость, сходимость) валидируемой методики составляет не более 3,26 %, а устойчивость (воспроизводимость) – не более 1,65 %.
Conclusion.
В результате валидации методики определения титра вируса псевдобешенства (болезни Ауески) на культуре клеток Vero B было установлено, что методика специфична, имеет удовлетворительный уровень повторяемости (сходимости) и устойчивости (внутрилабораторной воспроизводимости). Применение методики обеспечивает получение ожидаемых результатов, при этом результаты воспроизводимы и достоверны.
- Бурдинская О.Н. Cпектр патогенности возбудителя болезни Ауески // Российский ветеринарный журнал. – 2013. – № 3. – URL: https://cyberleninka.ru/article/n/cpektrpatogennosti-vozbuditelya-bolezni-aueski (дата обращения: 08.06.2024).
- Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В. Фомина Н.В. Вирусные болезни животных. – Москва: ВНИТИБП. – 928 с.
- Takashima G., Otsuka H. Patogenesis of animal herpesviruses to human. Nippon Rinsho. 2000; 58(4): P. 957–961.
- Иванов А.В., Юсупов Р.Х., Чернов А.Н., Юсупова Г.Р. К вопросу разработки вакцины против болезни Ауески свиней // Ученые записки КГАВМ им. Н.Э. Баумана. – 2015. – № 4. – URL: https://cyberleninka.ru/article/n/k-voprosu-razrabotki-vaktsinyprotiv-bolezni-aueski-sviney (дата обращения: 08.06.2024).
- Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. / А.Н. Миронов [и др.]. – Москва : Гриф и К, 2012. – 944 с.
- МУ 3.3.2.1121-02. 3.3.2. Медицинские иммунобиологические препараты. Организация контроля за соблюдением правил хранения и транспортирования медицинских иммунобиологических препаратов. Методические указания (утв. Главным государственным санитарным врачом РФ 04.04.2002). – URL: https://legalacts.ru/doc/mu-3321121-02-332-meditsinskieimmunobiologicheskie-preparaty-organizatsija/ (дата обращения: 08.06.2024).
- Государственная фармакопея Российской Федерации XIV изд. Общая фармакопейная статья ОФС.1.1.0021.18 «Валидация микробиологических методик» (утверждена и введена в действие приказом Минздрава России от 31.10.2018 № 749 «Об утверждении общих фармакопейных статей и фармакопейных статей и признании утратившими силу некоторых приказов Минздравмедпрома России, Минздравсоцразвития России и Минздрава России»).
