REGULATION OF CIRCULATION OF MEDICAL DEVICES
Accelerated procedure of state registration of medical devices to the market: an overview of regulatory changes
1 — Ministry of Health of the Russian Federation, 3, Rakhmanovsky ln, City Service Post Office-4, Moscow, 127994, Russian Federation.
2 — Ministry of Health of the Russian Federation, 3, Rakhmanovsky lane, City Service Post Office-4, Moscow, 127994, Russian Federation.
The article describes the existing mechanisms for bringing medical devices to the market, including the measures taken by regulators to speed up and simplify these procedures (fast track), as well as the issues of regulating circulation within the framework of the Eurasian Economic Union and some ways of solving the issues of forming a common market.
Keywords: accelerated registration of medical devices, simplification of the purchase of medical products, the general market of medical devices
Background.
Обращение медицинских изделий (далее – МИ) включает множество аспектов, регулирование которых в большей или меньшей степени зависит от изменяющихся условий других сфер деятельности. Как и любой процесс, регулирование обращения МИ требует развития. Особенно стремительных изменений регуляторики потребовали условия, сложившиеся за последние два года.
В соответствии с данными Государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий, на территории Российской Федерации зарегистрировано более 30 тыс. МИ, отнесенные почти к 10 тыс. кодам видов номенклатурной классификации медицинских изделий1.
С 2013 года в Российской Федерации действуют Правила государственной регистрации медицинских изделий2. Блок-схема регистрационных процедур представлена на рисунке 1. Правилами государственной регистрации была предусмотрена двухэтапная экспертиза качества, эффективности и безопасности МИ (за исключением МИ низкого класса потенциального риска применения, МИ для диагностики in vitro, программного обеспечения, являющегося МИ). С учетом всех административных процедур, а также проведения клинических испытаний, реальный срок государственной регистрации МИ мог составлять 6 месяцев и более.
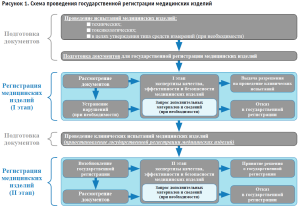
Введение ускоренного порядка государственной регистрации медицинских изделий
В целях организации мер по профилактике и недопущению распространения коронавирусной инфекции в режиме повышенной готовности к угрозе возникновения чрезвычайной ситуации в области общественного здравоохранения в 2020 году постановлением Правительства Российской Федерации от 03.04.2020 № 430 утверждены Особенности обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинского изделия (далее – Особенности, постановление № 430), которыми введена новая процедура государственной регистрации, предусматривающая:
- введение ускоренного порядка государственной регистрации серии (партии) медицинских изделий, которые предназначены для применения в условиях военных действий, чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов;
- проведение испытаний по типовым программам в сокращенном объеме;
- представление сокращенного пакета документов;
- получение регистрационного удостоверения со сроком действия до 01.01.2025.
Так, например, в 2021 году было зарегистрировано 328 серий (партий) медицинских изделий в соответствии с Особенностями (из них 103 серии (партии) медицинских изделий отечественного производства).
Оперативность регистрации медицинских изделий в соответствии с постановлением № 430 позволила своевременно и в полном объеме обеспечить население нашей страны необходимой продукцией.
Особенности обращения МИ в условиях ограничительных мер экономического характера. Одноэтапная процедура государственной регистрации
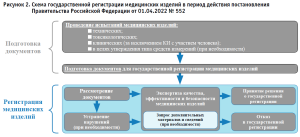
Полученный опыт по ускоренному выводу на рынок медицинских изделий позволил в рамках разработки комплекса мер, направленных на предотвращение дефектуры медицинских изделий, расходных материалов, запасных частей, комплектующих и сырья, подготовить постановление Правительства Российской Федерации от 01.04.2022 № 5523, которым утверждены Особенности обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера. Указанным постановлением в отношении медицинских изделий по Перечню, сформированному межведомственной комиссией, определены несколько процедур государственной регистрации, позволяющие ускоренно выводить на российский рынок медицинские изделия.
Однако следует полагать, что значимую роль для производителей имеет, помимо особенностей регулирования МИ из Перечня, тот факт, что в период действия Особенностей в отношении всех МИ (как включенных, так и не включенных в Перечень) введена одноэтапная процедура государственной регистрации, и в случае наличия полного комплекта необходимых документов и отсутствия замечаний, регистрация таких медицинских изделий не превышает 32 рабочих дня.
Блок-схема регистрационных процедур представлена на рисунке 2.
Необходимо отметить, что Особенностями в отношении всех медицинских изделий (как включенных, так и не включенных в Перечень) допускается возможность использования в «закрытых системах» изделий неоригинальных расходных материалов без согласия правообладателя. В соответствии с пунктом 11 Особенностей возможно применение медицинского изделия, производителем (изготовителем) которого в эксплуатационной документации установлен ограниченный перечень расходных материалов, с расходным материалом иного производителя (изготовителя), зарегистрированным в качестве медицинского изделия, если производитель (изготовитель) подтвердил в процессе его государственной регистрации возможность совместного применения с данным медицинским изделием. При этом совместное применение медицинского изделия с расходным материалом осуществляется с учетом особенностей, установленных в эксплуатационной документации производителя (изготовителя) на расходный материал.
Электронный запрос котировок: закупка медицинских изделий медицинскими организациями по упрощенной схеме
Помимо регистрационных фаст-трэков, важным элементом является доступность МИ для непосредственных пользователей в лице медицинских организаций и конечных потребителей.
Правительством Российской Федерации принято постановление от 06.03.2022 № 297 «Об установлении размера начальной (максимальной) цены контракта и годового объема закупок в целях закупки отдельных наименований медицинских изделий путем проведения электронного запроса котировок», которое позволило упростить процедуры закупок медицинских изделий. Медицинские организации могут закупать медицинские изделия по упрощенной схеме – через электронный запрос котировок, что позволяет значительно сократить сроки закупок.
Заказчик может проводить электронный запрос котировок при закупке медицинского оборудования, расходных материалов к нему и технических средств реабилитации инвалидов. Это возможно при условии, что начальная (максимальная) цена контракта не более 50 млн руб. Годовой объем таких закупок не должен превышать 750 млн руб.
Постановление Правительства Российской Федерации от 06.03.2022 № 297 вступило в силу 8 марта 2022 г. и действовало до 1 августа 2022 г. В рамках данного постановления Минздравом России совместно с Федеральным казначейством и Росздравнадзором был организован мониторинг цен на медицинские изделия.
Особенности обращения медицинских изделий в рамках Евразийского экономического союза: оптимизация процедуры регистрации как одна из «антикризисных» мер
Несколько слов стоит сказать о регуляторике Евразийского экономического союза (далее – Союз). Ранее Соглашением о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза было определено, что с 1 января 2021 года регистрация медицинских изделий, предназначенных для обращения на общем рынке в рамках Союза, осуществляется исключительно в соответствии с Правилами регистрации и экспертизы безопасности, качества и эффективности медицинских изделий, утвержденными решением Совета Евразийской экономической комиссии от 12.02.2016 № 46 (далее – Правила). В настоящее время в качестве одной из «антикризисных» мер предусматривается оптимизация процедуры регистрации медицинских изделий, а также введение на временной основе особенностей обращения медицинских изделий в соответствии с законодательством государства-члена в целях своевременного обеспечения населения государствчленов необходимыми медицинскими изделиями. Так, с 19 июня 2022 года в соответствии с решением Совета Евразийской экономической комиссии от 19 мая 2022 года № 84 вступили в силу изменения в Правила, которые расширяют случаи, когда обращение медицинских изделий регулируется законодательством государств-членов. Одновременно, 10 июня 2022 года Совет Евразийской экономической комиссии утвердил протокол по внесению изменения в Соглашение о единых принципах и правилах обращения медицинских изделий в рамках Евразийского экономического союза, которым предусматривается возможность регистрации медицинских изделий по национальным правилам до 31 декабря 2022 года.
Формирование общего рынка: пути решения проблем
Следует отметить, что возобновление национальных процедур является мерой, направленной на своевременное обеспечение систем здравоохранения государств – членов Союза необходимыми медицинскими изделиями, что приобретает особую значимость в текущих экономических условиях. Продление переходного периода национальной регистрации медицинских изделий учитывает предложения их производителей, в том числе позволяет оперативно принимать на национальном уровне специальные меры поддержки рынка в связи с введением ограничительных мер экономического характера в отношении отдельных стран Союза.
Вместе с тем необходимо подчеркнуть преимущества интеграции в части повышения доступности безопасных, эффективных и качественных медицинских изделий для населения государств-членов Союза, оптимизации условий для бизнеса путем ликвидации и (или) минимизации административных барьеров, обеспечения доступа на объединенный рынок потребления и конкурентоспособности производства медицинских изделий государств-членов Союза на мировом рынке в целом.
Существующие в настоящее время сложности по обеспечению регистрации и экспертизы медицинских изделий согласно требованиям Союза по ряду объективных причин требуют комплексных решений и необходимости разработки дорожной карты по формированию общего рынка МИ.
В частности, вопросы увеличения количества организаций, уполномоченных на проведение технических испытаний, испытаний с целью оценки биологического действия, и как следствие, снижения цены за проводимые исследования и испытания, решаемы не только и не столько силами регуляторов, а посредством увеличения активности и заинтересованности бизнес-сообщества по открытию новых испытательных центров. Также вопросы вовлеченности медицинских специалистов и повышение их компетентности по проведению клинических испытаний медицинских изделий требуют широкого освещения в специализированных средствах массовой информации и врачебных сообществ для публикации позиций лидеров общественного мнения, экспертных комментариев профильных специалистов. Целесообразно привлекать профильные сообщества, профессиональные ассоциации к обмену опытом и обсуждению интересующих вопросов на площадках профильных мероприятий, в т.ч. путем включения соответствующих сессий в программы мероприятий, а также путем сотрудничества с клиническими исследователями и производителями в целях повышения эффективности и безопасности медицинских изделий.
_______________________________________________________________________
1 Приказ Минздрава России от 06.06.2012 № 4н «Об утверждении номенклатурной классификации медицинских изделий». URL: https://base.garant.ru/70199586/?ysclid=l6c4nnwvgj706027616.
2 Постановление Правительства РФ от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий». URL: https://base.garant.ru/70291692/?ysclid=l6c4owrh13216779237.
3 Постановление Правительства Российской Федерации от 01.04.2022 № 552 «Об утверждении особенностей обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера». URL: http://static.government.ru/media/files/OJvx8qYG68Cbj3tLP6BUW5OlIHjquCf1.pdf
