QUALITY, EFFICIENCY AND SAFETY OF MEDICAL ACTIVITY
Accounting for radiation exposure to improve control of treatment effectiveness and risk management of adverse events in the case of neuroblastoma
1 — «E. Meshalkin National Medical Research Center» of the Ministry of Health of the Russian Federation, 15, Rechkunovskaya st., Novosibirsk, 630055, Russian Federation.
ORCID: orcid.org/0000-0003-1530-1327
2 — «E. Meshalkin National Medical Research Center» of the Ministry of Health of the Russian Federation, 15, Rechkunovskaya st., Novosibirsk, 630055, Russian Federation.
3 — «E. Meshalkin National Medical Research Center» of the Ministry of Health of the Russian Federation, 15, Rechkunovskaya st., Novosibirsk, 630055, Russian Federation.
4 — Federal State Budgetary Institution «National Institute of Quality» of Roszdravnadzor, 27, Volgogradsky avenue, Moscow, 109074, Russian Federation.
5 — Federal State Budgetary Institution «National Institute of Quality» of Roszdravnadzor, 27, Volgogradsky avenue, Moscow, 109074, Russian Federation.
6 — Federal State Budgetary Institution «National Institute of Quality» of Roszdravnadzor, 27, Volgogradsky avenue, Moscow, 109074, Russian Federation.
7 — «N.N. Blokhin National Research Institute of Oncology» of the Ministry of Health of Russian Federation, 24, Kashirskoe Shosse, Moscow, 115522, Russian Federation.
8 — «N.N. Blokhin National Research Institute of Oncology» of the Ministry of Health of Russian Federation, 24, Kashirskoe Shosse, Moscow, 115522, Russian Federation.
9 — «N.N. Blokhin National Research Institute of Oncology» of the Ministry of Health of Russian Federation, 24, Kashirskoe Shosse, Moscow, 115522, Russian Federation.
ORCID 0000-0003-1779-003X
10 — Federal State Budgetary Educational Institution of Higher Education “Lomonosov Moscow State University”, 1, Leninskie Gory st., Moscow, 119234, Russian Federation.
ORCID https://orcid.org/0000-0002-5649-2193
The article argues for the need for the active inclusion of radiologists in the management of care.
Different models of the use of radiology techniques, using neuroblastoma as an example, are reviewed, justifying the need for a systemic solution. The urgent need to change established medical practice in the use of radiology methods is shown. The article lists barriers and presents opportunities for overcoming them. Teamwork involving radiology professionals is a purely managerial innovation without the need for additional resources, meaning that it can be implemented quickly. The proposed solutions will make the delivery of medical care using diagnostic radiology techniques controllable and therefore manageable, thereby improving the quality and safety of medical care.
Keywords: organization of medical care, quality management, radiology, sources of ionizing radiation exposure, radiation
Background.
В настоящее время медицинские технологии получают активное развитие, и наиболее быстрыми в технологическом плане являются методы и методики лучевой диагностики.
К методам лучевой диагностики относятся:
- Ультразвуковое исследование (УЗИ) – метод основан на способности ультразвуковой волны по-разному отражаться от объектов с неодинаковой плотностью. [1].
- Рентгенологическое исследование – получение суммарного проекционного изображения анатомических структур организма посредством прохождения через них рентгеновских лучей и регистрации степени ослабления рентгеновского излучения [2]. Сюда относятся рентгенография (получение снимков) и рентгеноскопия (проведение осмотра в режиме реального времени), а также компьютерная томография (КТ). КТ основана на этом же физическом принципе, но изображения получают посредством послойного поперечного сканирования объекта узким пучком рентгеновского излучения. Рентгенологическая диагностика может быть проведена с помощью перорального, ректального и/или внутривенного контрастирования с использованием йодсодержащих контрастных средств [3].
- Магнитно-резонансная томография (МРТ) – способ получения томографических медицинских изображений для исследования внутренних органов и тканей с использованием явления магнитного резонанса. Способ основан на измерении электромагнитного отклика атомных ядер, находящихся в сильном постоянном магнитном поле, в ответ на возбуждение их определенным сочетанием электромагнитных волн [4]. МРТ может быть выполнена с использованием гадолинийсодержащих контрастных средств, методики мультифазного контрастирования, перфузионных методик и пр.
- Радионуклидная диагностика – вид лучевой диагностики, основанный на внешней радиометрии излучения, исходящего из органов и тканей после введения радиофармацефтических препаратов непосредственно в организм пациента (сцинтиграфия, позитронноэмиссионная томография (ПЭТ)) [5].
- Гибридные методы – сочетают в себе анатомические и функциональные методы (ПЭТ-КТ, ПЭТ-МРТ, ОФЭТ-КТ и др.) [6].
По признаку наличия ионизирующего излучения (лучевой нагрузки) все методы лучевой диагностики разделяются на методы без использования источников ионизирующего излучения (ИИИ) и методы с использованием ИИИ. Так, лучевой нагрузки не имеют УЗИ и МРТ. Важно акцентировать внимание на том, что к методам с обязательным использованием ИИИ для получения изображений, относятся не только рентгенологические и радионуклидные методы, но и методы рентгенэндоваскулярных диагностики и лечения, выделенные в отдельную специальность, хотя использующийся в них принцип получения изображений аналогичен рентгенологическим методам (проводится рентгеноскопия при внутрисосудистом введении йодосодержащего контрастного средства) [7].
Количество методов и методик лучевой диагностики увеличивается с каждым днем, а большое количество вариантов неизбежно осложняет выбор. При проведении диагностических исследований в клинической практике, в особенности при использовании методов, основанных на использовании ИИИ, всегда необходимо соблюдать баланс пользы и рисков, поскольку известно, что радиационная нагрузка увеличивает риски развития злокачественных новообразований (ЗНО) [8].
Воздействие радиации может увеличить риск развития ЗНО по двум механизмам:
- Высокая доза радиации подавляет или повреждает иммунную систему, позволяя большому количеству злокачественных клеток уклоняться от иммунных атак организма. При кратковременном действии высоких доз радиации иммунная система может восстановиться через некоторое время.
- Под действием радиации стволовые клетки мутируют. С годами некоторые из них превращаются в раковые клетки, которые могут ускользать от иммунной системы [9].
Чем меньше и реже человек подвергается действию ионизирующего излучения, тем меньше рисков и больше возможностей для восстановления организма. Поэтому при использовании методов лучевой диагностики, лучевая нагрузка, полученная пациентом в предыдущих обследованиях, должна строго учитываться1.
Цель работы
На примере нейробластомы надпочечника с использованием информации из клинических рекомендаций «Нейробластома»2 (КР) построить модели применения методов лучевой диагностики.
Материалы и методы
Нормативные правовые акты, регулирующие отношения в сфере медицинской деятельности и радиационной безопасности населения3, анализ эффективных доз, получаемых пациентами при исследованиях с использованием ИИИ.
Results.
В соответствии с КР для диагностики используют следующие методы:
- УЗИ абдоминальной зоны для оценки распространённости первичной опухоли и эхокардиография (при условии назначения кардиотоксичных препаратов для лечения);
- рентгенография грудной клетки (прямая и боковая проекции) – с целью возможного выявления метастатического поражения, воспалительной инфильтрации лёгких, после катетеризации подключичной вены для исключения пневмоторакса;
- КТ с внутривенным контрастированием шеи, органов грудной клетки, абдоминальной и тазовой зон (нативно и с внутривенным болюсным фазовым контрастированием в артериальную, венозную и паренхиматозную фазы исследования), на этапе первичной диагностики, для оценки ответа опухоли на проводимую терапию, после лечения в процессе динамического наблюдения;
- МРТ головного и спинного мозга, шеи, органов брюшной полости и таза (в зависимости от локализации первичной опухоли) с внутривенным контрастированием с использованием гадолиний-содержащих контрастных препаратов. С целью верификации первичной опухоли и метастатического поражения для более точного определения интраспинального распространения опухолевого процесса, на этапе первичной диагностики, а также для оценки ответа опухоли на проводимую терапию, после лечения в процессе динамического наблюдения;
- сцинтиграфия с 123I-метайодбензилгуанидином (МЙ БГ) в режиме «все тело», включая протоколы ОФЭТ или гибридный метод: ОФЭКТ;
- выполнение ПЭТ/КТ с 18F-ФДГ в режиме «все тело».
В КР отмечена важность использования мультидисциплинарного подхода на всех этапах оказания медицинской помощи с привлечением детского онколога (гематолога), врача-невролога, врача-офтальмолога, врача-детского хирурга, врача-анестезиолога-реаниматолога и иных врачей-специалистов. При этом акцент на необходимости привлечения врача-рентгенолога не сделан, что создает риски несоблюдения основополагающих принципов радиационной безопасности – нормирования, обоснования и оптимизации, и, как следствие, получения пациентом клинически неоправданной лучевой нагрузки.
Лучевая нагрузка
Для получения изображений при проведении УЗИ и МРТ ИИИ не используются. Рентгенологические и радиоизотопные методы имеют лучевую нагрузку.
При определении лучевой нагрузки при использовании ИИИ наиболее часто используются такие единицы измерения, как Грей и Зиверт. Грей применяется для масштабных расчетов, например, при радиационной аварии и использовании лучевой терапии. Для диагностических исследований радиационная (лучевая) нагрузка, полученная пациентом, выражается в миллизивертах (мЗв, единица измерения эквивалентной дозы радиационного излучения4). Эффективная доза служит мерой биологического риска при рентгенологических (в т.ч. КТ) исследованиях. Определение эффективной дозы осуществляется с учётом относительной чувствительности разных тканей, подверженных облучению.
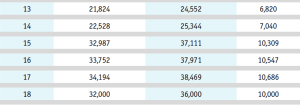
В таблице 1 представлены количественные показатели эффективной полученной дозы при выполнении методов лучевой диагностики (усредненные действительные показатели).

Расчеты полученной эффективной дозы при проведении КТ производятся на основании DLP (Dose Length Product) – произведение дозы на длину сканирования области. Данный показатель позволяет определить дозу облучения в зависимости от роста и площади поверхности тела. Расчеты по DLP производятся по формуле:

Согласно проведенному анализу наибольшую лучевую (радиационную) нагрузку при проведении динамических исследований несет в себе применение КТ. Лучевая нагрузка зависит от времени сканирования (то есть от количества спиралей аппарата, чем больше спиралей – тем быстрее проходит сканирование и тем меньше лучевая нагрузка), от установок перед сканированием (чем больше лучевая нагрузка – тем детальнее изображения), количества фаз, площади поверхности тела пациента.
По данным анализа базы данных ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России и ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в сопоставлении с данными мировой литературы представлены расчеты радиационной (лучевой) нагрузки, в зависимости от зоны сканирования и возраста пациента (табл. 2).

На основании СанПиН 2.6.1.1192-035 при получении лицами из населения эффективной дозы облучения за год более 200 мЗв или накопленной дозы более 500 мЗв от одного из основных источников облучения или 1000 мЗв от всех источников облучения необходимо специальное медицинское обследование, организуемое органами управления здравоохранения.
Данные мировой литературы подтверждают факт того, что при получении лучевой нагрузки в количестве в 200 мЗв в короткий период времени у человека в дальнейшем может развиться онкологическое заболевание [10].
В КР указано, что по прошествии 3 месяцев после лечения рекомендуется УЗИ, рентгенография органов грудной клетки, МРТ или КТ с контрастированием в первый год 1 раз в 6 месяцев, далее исследования должны выполняться при наличии изменений на УЗИ.
В КР в критериях оценки качества медицинской помощи значится проведение:
- УЗИ органов брюшной полости и забрюшинного пространства и зоны первичного опухолевого очага;
- КТ с внутривенным контрастированием и/или магнитно-резонансной томографии зоны первичного опухолевого очага;
- КТ органов грудной клетки.
Проверка соответствия предоставленной пациенту медицинской помощи критериям оценки качества медицинской помощи проводится в рамках экспертизы качества медицинской помощи, в том числе в рамках государственного и ведомственного контроля качества и безопасности медицинской деятельности3,6, что создает предпосылки для повсеместного назначения вышеприведенных методов исследования.
При этом во избежание установления фактов превышения эффективной дозы облучения за год или накопленной дозы облучения над предельными значениями, установленными СанПиН 2.6.1.1192-03, медицинскими работниками может осуществляться искусственное занижение доз облучения, полученных пациентом, в том числе путем указания недостоверных данных в медицинской документации, поскольку в чек-листах Росздравнадзора на сегодняшний день контроль над лучевой нагрузкой отсутствует7. Для минимизации рисков причинения вреда здоровью пациента вследствие искусственного занижения полученных им доз облучения целесообразно осуществлять сплошную проверку дозовых нагрузок на всех этапах контроля качества и безопасности медицинской деятельности, начиная с внутреннего.
В рамках настоящего проекта были построены прогнозные модели пациентов по эффективной накопленной дозе с использованием информации из КР: пессимистичная, оптимистичная и реалистичная с определением возраста, в котором доза лучевой нагрузки будет считаться опасной для здоровья и являться предпосылками вероятного развития онкологического заболевания в дальнейшем.
Пессимистичная прогнозная модель
Из КР следует, что после окончания лечения томографические методы визуализации используются при изменениях на УЗИ. Однако, с учетом того, что при нейробластоме надпочечника будет применено хирургическое и противоопухолевое лекарственное лечение, то УЗИ каждый раз будет демонстрировать тканный компонент, требующий дообследования. Второй важный факт, который может негативно повлиять на суммарную лучевую нагрузку, это то, что КР предполагают использование МРТ или КТ на выбор направляющего врача или мультидисциплинарной команды, в которую, по сложившейся практике, врач-рентгенолог не входит. При пессимистичной модели использован метод с лучевой нагрузкой, поскольку КТ привычнее для клинических специалистов за счет меньшей технологической вариабельности по сравнению с МРТ (рис. 1).

Просчитана прогнозная модель с ежегодным использованием методов диагностики с лучевой нагрузкой (табл. 3).
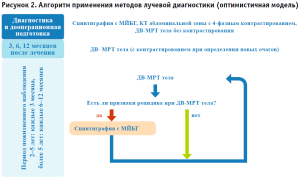
Оптимистичная прогнозная модель
В КР КТ и МРТ указаны как методы выбора при наблюдении в динамике.
При оптимистичной прогнозной модели имеется возможность выполнения МРТ, а именно, диффузионно-взвешенных изображений всего тела по ранее разработанной методике [11]. Необходимо указать, что данные диффузионно-взвешенной магнитно-резонансной томографии (ДВ-МРТ) всего тела позволяют дифференцировать как рецидив в зоне операции и дифференцировать эти изменения от рубцовых изменений, так и метастатическое поражение, результаты сопоставимы с ПЭТ-КТ [12] (рис. 2).
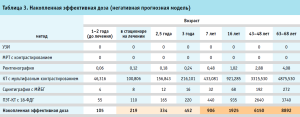
Просчитана лучевая нагрузка (табл. 4)

При таком подходе будет выполняться ДВ-МРТ тела с необходимой периодичностью. Эффективность вложений будет высока, поскольку с высокой долей вероятности не потребуется выполнение других методов диагностики.
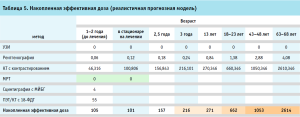
Реалистичная прогнозная модель
По сложившейся практике и информации из КР, используется алгоритм, представленный на рисунке 3.
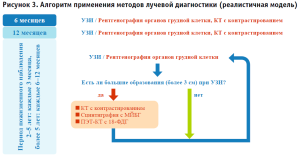
Создана модель лучевой нагрузки (табл. 5)
Discussion.
Для оказания качественной медицинской помощи требуется постоянная работа по совершенствованию управления качеством медицинской помощи, формирование у населения культуры профилактики заболеваний и здорового образа жизни, улучшение эффективности системы здравоохранения с учетом всех ресурсов[13]. Этого можно достичь лишь с использованием междисциплинарного взаимодействия при оказании медицинской помощи на всех этапах. Междисциплинарное сотрудничество повышает результативность, развивает необходимые компетенции, влечет высокую индивидуальную ответственность при достижении целей, вынуждает участников команды учитывать все составляющие, использовать целостный подход и рассматривать проблему комплексно, используя инновационные решения [14].
При оказании медицинской помощи радиационная нагрузка находится в зоне недостаточного внимания специалистов, оказывающих медицинскую помощь, что, судя по неблагоприятной модели, может негативно сказаться на здоровье граждан.
Анализируя причины неэффективности, можно выделить две обширные категории неэффективности:
- неэффективность распределения ресурсов;
- техническая неэффективность [15].
Первая категория (неэффективность распределения ресурсов) обозначает неоптимальное сочетание имеющихся ресурсов. Так, на территории России медицинские организации (МО) хорошо оснащены дорогостоящим диагностическим оборудованием, медицинские сообщества врачей диагностических специальностей много ресурсов вкладывают в обучение специалистов, имеются сформированные эко-системы для обмена опытом между специалистами и образовательными учреждениями разного уровня. Однако все диагностические исследования осуществляются по направлению, составленному по Номенклатуре медицинских услуг8, в которой указаны не только методы, но и отдельные методики лучевой диагностики, что, при отсутствии компетенций у направляющих врачей-специалистов, порождает необходимость повторных исследований или избыточной траты ресурсов (при проведении исследования у врача-специалиста, выполняющего исследование, нет возможности изменить тип предоставляемой услуги, есть полномочия только отказать при необоснованном назначении исследования). Примеры, приведенные в данной работе, не только иллюстрируют проблему неэффективного использования имеющихся ресурсов, но и могут быть причинами недостаточно эффективного лечения. Решением данной проблемы может стать документальное закрепление участников междисциплинарных команд при принятии ключевых клинических решений по профилю. В особенности это имеет большое значение по профилю «онкология» и «сердечно-сосудистая хирургия», где для решения тактики при первично установленном диагнозе и при наблюдении после лечения роль методов лучевой диагностики очень велика, а заболевания являются первыми причинами смертности. Обращаясь к лучшим практикам, можно увидеть сформированные специализированные команды в европейском здравоохранении: так называемые «Heart Team» и «tumorboard » с включением специалистов лучевой диагностики. До этапа сформированных междисциплинарных команд отрасли необходимо пройти путь мультидисциплинарного подхода с четким определением состава участников консилиума, врачебной комиссии и т.д. при принятии ключевых клинических решений на уровне клинических рекомендаций, что обозначит не только команду на уровне МО, но и обозначит сообщества разработчиков клинических рекомендаций при различных заболеваниях. При четком определении состава участников ожидается снижение избыточной нагрузки на здравоохранение, а усиление междисциплинарных связей неизбежно благоприятно повлияет на качество и безопасность медицинской деятельности. Кроме этого, введение четких алгоритмов диагностики на всех этапах оказания медицинской помощи позволит точно запланировать ресурсозатраты при оказании медицинской помощи, распределяя нагрузку между МО различного уровня.
Вторая категория (техническая неэффективность) обычно возникает на уровне медицинских работников или МО и может быть следствием ненадлежащих стимулов, некомпетентного руководства МО и отсутствия полноценной информации [15]. В данном случае требуется, в первую очередь, просветительская работа, которая на сегодняшний день проводится Мин здравом России, Росздравнадзором и медицинскими профессиональными сообществами. При настоящем положении вещей роль руководителя МО невероятно значима, поскольку в его компетенции организовать работу МО надлежащим образом, стимулируя, непрерывно обучая и информируя сотрудников. Так, на текущий момент нет преград для организации мультидисциплинарных команд и документального закрепления процесса локальными нормативными актами МО.
На сегодняшний день в здравоохранении имеется излишняя детализация ресурсов, групп расходов и объектов учета расходов. С другой стороны, методов, основанных на учете по объемам, как например, количество проведенных исследований, подсчет лучевой нагрузки во время исследования без учета суммарной лучевой нагрузки, недостаточно для того, чтобы информация о расходах точно отражала использование ресурсов и играла более значимую роль в управлении здравоохранением. В целом структурное несоответствие анализа расходов и принятия решений может привести к подрыву эффективности при реорганизации услуг или МО. В подобной ситуации существует высокий риск того, что, несмотря на любую экономию или вдумчивое использование диагностических методов, что обеспечивается за счет реорганизации услуг, в конечном итоге никаких изменений в ресурсозатратах не произойдет, а ресурсы, которые будут потрачены на контроль качества оказания медицинской помощи, не будут эффективными, поскольку пациент в текущих условиях потенциально имеет возможность приобрести новые заболевания из-за избыточной лучевой нагрузки, полученной при проведении диагностических исследований во время диагностики и лечения. Таким образом, недостаточное внимание к использованию лучевых методов исследования, в особенности с использованием ИИИ, отсутствие учета эффективности и отсутствие работы над устранением причин неэффективности могут повлечь за собой чрезвычайно негативные последствия для пациентов, будь то неэффективный расход ресурсов, оказание ненадлежащей медицинской помощи или провоцирование возникновения новых заболеваний из-за избыточной лучевой нагрузки.
Выводы
- Нормативно-правовая база Российской Федерации учитывает и обозначает риски при проведении лучевых методов исследования, однако требуется проект по масштабному внедрению принципов обоснования применения лучевых методов исследования с радиационной нагрузкой в клиническую практику с последующим контролем со стороны Федеральной службы по надзору в сфере здравоохранения.
- На примере нейробластомы по информации из действующих клинических рекомендаций выполнены три модели с точки зрения полученной лучевой (радиационной) нагрузки, что обосновывает необходимость организации прозрачной системы учета и контроля, усиления контроля за проведением лучевых методов исследования с источниками ионизирующего излучения.
- В целях сохранения здоровья граждан России видится необходимым с использованием процессного подхода в рамках проектной деятельности совместно с ведущими научными учреждениями Минздрава России и ФГБУ «Национальный институт качества» Росздравнадзора разработать практические рекомендации с дальнейшим рассмотрением внесения изменений в приказ Росздравнадзора от 10.01.2022 № 1 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий».
______________________________________________________________________
1 Постановление Главного государственного санитарного врача РФ от 07.07.2009 № 47 «Об утверждении СанПиН 2.6.1.2523-09» (вместе с НРБ-99/2009. СанПиН 2.6.1.2523-09. Нормы радиационной безопасности. Санитарные правила и нормативы). (Зарегистрировано в Минюсте РФ 14.08.2009 № 14534).
2 Клинические рекомендации «Нейробластома» (утв. Минздравом России).
3 Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 28.12.2022) «Об основах охраны здоровья граждан в Российской Федерации» (с изм. и доп., вступ. в силу с 01.03.2023).
4 Постановление Главного государственного санитарного врача РФ от 07.07.2009 № 47 «Об утверждении СанПиН 2.6.1.2523-09» (вместе с НРБ-99/2009. СанПиН 2.6.1.2523-09. Нормы радиационной безопасности. Санитарные правила и норматив»). (Зарегистрировано в Минюсте РФ 14.08.2009 № 14534).
5 Постановление Главного государственного санитарного врача РФ от 18.02.2003 № 8 «О введении в действие СанПиН 2.6.1.1192-03» (вместе с СанПиН 2.6.1.1192-03. 2.6.1. Ионизирующее излучение, радиационная безопасность. Гигиенические требования к устройству и эксплуатации рентгеновских кабинетов, аппаратов и проведению рентгенологических исследований. Санитарные правила и нормативы, утв. Главным государственным санитарным врачом РФ 14.02.2003). Зарегистрировано в Минюсте РФ 19.03.2003 № 4282).
6 Приказ Минздрава России от 16.05.2017 № 226н «Об утверждении Порядка осуществления экспертизы качества медицинской помощи, за исключением медицинской помощи, оказываемой в соответствии с законодательством Российской Федерации об обязательном медицинском страховании». (Зарегистрирован в Минюсте России 31.05.2017 № 46910).
7 Приказ Росздравнадзора от 10.01.2022 № 1 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий» (Зарегистрирован в Минюсте России 22.02.2022 № 67423).
8 Приказ Минздрава России от 13.10.2017 № 804н (ред. от 24.09.2020) «Об утверждении номенклатуры медицинских услуг». (Зарегистрировано в Минюсте России 07.11.2017 № 48808).
- Baryshnikova I.Yu. Vaneeva A.M. Clinical application of the Speckle tracking echocardiographic technique for assessing left ventricular function in patients with congenital heart defects. Grudnaya i serdechno-sosudistaya khirurgiya. 2022; 4(64): 370-377. DOI: 10.24022/0236-2791-2022-64-4-370-377.
- Semenov S.Yu. , Proschenko Ya.N., Baindurashvili A.G. [et al.] Evaluation of radiometric parameters of forearm bones in traumatic instability of the distal radiocarpal joint in children. Travmatologiya i ortopediya Rossii. 2022; 28(2): 67–78. DOI: 10.17816/2311-2905-1753.
- Malakhova M.V. , Galyan T.N., Khovrina A.V., Charchyan E.R., Khovrin V.V. Options for reducing radiation and iodine load during MSCT aortography before surgery on the aorta and aortic valve. Medicinskaya vizualizaciya. 2022; 26 (2): 81–90. DOI: 10.24835/1607-0763-1149.
- Titova A.M. , Fokin V.A., Trufanov G.E. [et al.] MRI for quantitative determination of iron in the liver and heart in patients with primary and secondary hemochromatoses in association with serum ferritin: a one-stage observational study. Vestnik Rossijskoj akademii medicinskih nauk. 2023; Vol. 78 (1): 11–18. DOI: 10.15690/vramn2328.
- Ryzhkov A.D., Krylov A.S., Bludov A.B., Kuzin A.V., Kaspshik S.M., Dolgushin M. B. Evaluation of the SPECT/ CT Method in the Diagnosis of Ochronosis. Clinical Case. Medical Radiology and radiation safety. 2020; 2: 82–86. DOI: 10.12737/1024-6177-2020-65-2-82-86.
- Usachev D.Yu. Konovalov A.N., Potapov A.A. [et al.] Modern neurosurgery: interdisciplinary integration of competencies and technologies. Vestnik Rossijskoj akademii medicinskih nauk. 2022; Vol. 77 (4): 267–275. DOI: 10.15690/vramn2178.
- Peregudov N.A. , Sergeeva O.N., Virshke E.R., Lapteva M.G., Markovich A.A., Dolgushin B.I. X-ray endovascular technologies in identifying and eliminating the unexpected cause of ascites developed in a patient with disseminated neuroendocrine tumor of the small intestine with metastases in the liver, mesentery lymph nodes and bones. Clinical observation. Onkologicheskij zhurnal: luchevaya diagnostika, luchevaya terapiya. 2022; 5(3): 112–120. DOI: 10.37174/2587-7593-2022-5-3-112-120.
- Busby C. Ionizing radiation and cancer: The failure of the risk model. Cancer Treat Res Commun. 2022; 31: 100565. DOI: 10.1016/j.ctarc.2022.100565.
- Pearce M.S., Salotti J.A., Little M.P., McHugh K., Lee C., Kim K.P., Howe N.L., Ronckers C.M., Rajaraman P., Sir Craft A.W., Parker L., Berrington de Gonz lez A. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study. Lancet. 2012 Aug 4; 380(9840): 499–505. DOI: 10.1016/S0140-6736(12)60815-0.
- Schultz C.H., Fairley R., Murphy L.S., Doss M. The Risk of Cancer from CT Scans and Other Sources of Low-Dose Radiation: A Critical Appraisal of Methodologic Quality. Prehospital Disaster Medicine. 2020; 35(1): 3–16. DOI: 10.1017/S1049023X1900520X.
- Trofimenko I.A. , Pavlov D.G., Bergen T.A. Methodology of diffusion-weighted images of the whole body. Medicinskaya vizualizaciya. 2013; 6: 124–132.
- Rashidi A., Baratto L., Theruvath A.J., Greene E.B., Hawk K.E., Lu R., Link M.P., Spunt S.L., Daldrup-Link H.E. Diagnostic Accuracy of 2-[18F]FDG-PET and whole-body DW-MRI for the detection of bone marrow metastases in children and young adults. Eur Radiol. 2022 Jul; 32(7): 4967–4979. DOI: 10.1007/s00330-021-08529-x.
- Starshinin A.V., Bezymyannyj A.S., Kostenko E.V., Tyazhelnikov A.A., Ksenzova M.A., Yumukyan A.V. Implementation of the paradigm of preventive medicine based on the process approach. Vestnik Roszdravnadzora. 2022; 5: 31–44.
- Bergen T.A. , Puhalsky A.N. Multidisciplinarity and interdisciplinarity as opportunities for the development of the system of medical care in the Russian Federation. Vestnik Roszdravnadzora. 2023; 1: 28–34.
- Cylus J., Papanicolas I., Smith P.C., editors. Health system efficiency: How to make measurement matter for policy and management [Internet]. Copenhagen (Denmark): European Observatory on Health Systems and Policies; 2016.
