INFORMATION TECHNOLOGY AND DIGITALIZATION OF HEALTHCARE
Strategies for digitalization of pharmacovigilance in the Eurasian Economic Union in 2020–2030: automation of monitoring, collection, and analysis of drug safety information
1 — Scientific Medical Agency “Litobzor”, 3 Profsoyuznaya str., Moscow, 117036, Russian Federation.
2 — State Budgetary Healthcare Institution of the Moscow Region “Moscow Regional Scientific Research Clinical Institute named after M.F. Vladimirsky”, 61/2, Shchepkina str., Moscow, 129110, Russian Federation.
3 — Federal State Budgetary Institution “Information and Methodological Center for the Examination, Accounting and Analysis of the circulation of medical Products” of the Federal Service for Healthcare Supervision, 4, blg 1, Slavyanskaya Square, 109074, Russian Federation.
4 — Scientific Medical Agency “Litobzor”, 3 Profsoyuznaya str., Moscow, 117036, Russian Federation.
5 — Federal State Autonomous Educational Institution of Higher Education Patrice Lumumba Peoples' Friendship University of Russia, 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation.
The Russian Federation has adopted a comprehensive digital transformation program, which is being implemented within the framework of strategic initiatives enshrined in key decrees of the President of the Russian Federation, V.V. Putin: No. 203 "On the Strategy for the Development of the Information Society in the Russian Federation for 2017–2030" and No. 309 “On the National Goals and Strategic Objectives for the Development of the Russian Federation through 2024.” These regulations form the conceptual basis for a systematic approach to the digitalization of various spheres of public life, which is an important element of state policy in the field of innovative development and increasing the country's competitiveness. State programs are aimed at implementing information and communication technologies across all forms of ownership, developing electronic document management, ensuring cybersecurity, managing big data, applying artificial intelligence, and creating platforms for effective data collection and transparent interaction between citizens and industry participants.
The article examines the main strategies for digitalization of pharmacovigilance in the EAEU: digitalization and business processes in pharmacovigilance, computerized systems for critical pharmacovigilance processes, etc. The challenges associated with the implementation of information technology in business processes are analyzed, and it is emphasized that, despite the obstacles, investments in computerized systems contribute to a significant improvement in the quality of pharmacovigilance in the enterprise.
Keywords: pharmacovigilance, digitalization of pharmacovigilance processes, computerized systems for critical pharmacovigilance processes, automated pharmacovigilance systems
Background.
Цифровизация или цифровая трансформация является закономерным этапом развития деятельности общественных институтов. Цифровизацию стоит определять как процесс внедрения и использования современных информационных и вычислительных технологий с целью оптимизации бизнес-процессов, улучшения предоставляемых услуг, увеличения производительности и конкурентоспособности организаций и общества в целом.
Принятие и реализация цифровых стратегий развития являются глобальным трендом как на уровне международных организаций (таких, как ООН), так и на уровне отдельных государств. Так, на уровне ООН на данный момент сформулирована и реализуется цифровая стратегия развития 2022-2025, которая служит одной из инфраструктурных составляющих реализации целей устойчивого развития. На уровне Российской Федерации также реализуется концепция цифровой трансформации во исполнение указов Президента Российской Федерации В.В. Путина от 09.05.2017 № 203 «О Стратегии развития информационного общества в Российской Федерации на 2017–2030 годы» и от 07.05.2018 № 309 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года». В Казахстане существует аналогичная программа с горизонтом планирования на 2023–2029 годы. Аналогичные программы реализуются на территории всех стран-участниц ЕАЭС.
Основными направлениями в рамках подобных программ является реализация на государственном уровне задач по внедрению информационно-коммуникационных технологий в учреждениях различных форм собственности, развитие электронного обмена между учреждениями, кибербезопасность, управление большими данными, внедрение искусственного интеллекта и создание государством платформ для обеспечения эффективного сбора данных и прозрачного взаимодействия граждан и отраслевых участников между собой.
Стоит отметить, что, как орган контрольно-надзорной деятельности, Росздравнадзор является ролевой моделью для многих аналогичных учреждений в других отраслях, так как существенно усовершенствована система лабораторного анализа лекарственных препаратов, создана и успешно функционирует система для сбора, анализа и обмена информацией в E2BR3 формате между участниками рынка и уполномоченным органом, а последний с использованием этого формата обменивается данными с Центром мониторинга Уппсалы (база данных VigiBase)[5]. Таким образом, на уровне государства последовательно реализуется политика по внедрению цифровых средств для обмена информацией между участниками рынка и уполномоченным органом.
Однако на уровне самих учреждений-держателей регистрационных удостоверений внедрение цифровых решений для реализации рутинных процедур фармаконадзора зачастую сталкивается не только с проблемами организационного характера, но и кадровой укомплектованности, низкой осведомленности специалистов фармаконадзора о порядке внедрения программных решений и осуществления жизненного цикла данных по безопасности лекарственных препаратов.
Цифровизация и бизнес-процессы в фармаконадзоре
Усилия международного научного сообщества в области безопасности и эффективности лекарственных препаратов превратили мониторинг в последовательный, воспроизводимый и результативный процесс.
Вред, который приносят потенциально опасные лекарственные препараты, был угрозой общественному здоровью на протяжении долгих лет, однако с учетом развития законодательства в сфере фармаконадзора, особенно с 2010 года (Directive 2010/84/EU; Regulation (EU) No 1235/2010), удалось создать ключевой документ – GVP (надлежащая практика фармаконадзора). С 2014 года документ стал обязательным для стран-участниц ЕАЭС, в 2022 году документ претерпел вторую редакцию в Союзе.
Надлежащая практика фармаконадзора пронизана процессным подходом, с рекомендациями по составу процедур, ответственными ролями и ожидаемыми результатами. Таким образом, процедуры в рамках надлежащей практики фармаконадзора стали логичным компонентом систем менеджмента качества в традициях ГОСТ 9001 и пр. Как таковую систему можно успешно реализовать даже без использования каких-либо электронных сервисов, однако такой подход не является масштабируемым и при выведении новых продуктов в организации или изначально большом количестве лекарственных препаратов ведет к накоплению ошибок и потере данных [10].
Практически весь процесс фармаконадзора, от выявления спонтанных сообщений до различного рода отчетности и идентификации сигналов по безопасности, возможно автоматизировать [11].
При этом стоит учитывать, что основными источниками информации о профиле безопасности лекарственных препаратов являются сами потребители медицинских продуктов, медицинские и фармацевтические работники, клинические исследования различных фаз, рутинная клиническая практика, уполномоченные органы и литературные источники [2]. С развитием цифровизации большое значение приобретают различного рода электронные базы данных (Real-World Data, RWD) [2].
Компьютеризированные системы для критических процессов фармаконадзора
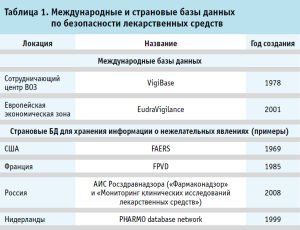
Для понимания трендов внедрения компьютеризированных систем (КС) в фармаконадзоре стоит выделить общие исторические этапы развития контроля качества лекарственных препаратов. Потребность в КС появилась относительно недавно в общей исторической перспективе. Таким этапом развития стала гармонизация надлежащих практик GxP между крупными наднациональными и национальными центрами, взаимное сближение стандартов ICH, элементов стандартов ISO и практик надлежащей деятельности [4, 17]. Помимо национальных центров мониторинга нежелательных явлений под эгидой Всемирной организации здравоохранения был создан отдельный сотрудничающий центр (англ. – collaborative centre) Центр мониторинга Уппсалы (англ. – Uppsala Monitoring Center, UMC) (Швеция), ответственный с 1978 года за ведение базы данных нежелательных явлений. На данный момент UMC – самая крупная международная профильная инициатива, объединяющая 110 государств-членов, в том числе и Российскую Федерацию. С 1991 года информационная система UMC стала доступна для онлайн-доступа, с 2004 года стартовал VigiBase online project (теперь – VigiFlow).
Примеры страновых и международных инициатив представлены в таблице 1.
Внедрение надлежащих практик фармаконадзора, а также необходимость удобного формата обмена с регуляторными органами способствовали развитию внутренних баз нежелательных явлений ДРУ, сочетающих в себе такой функционал, как: заведение случая, поиск сигналов, версионирование, контроль изменений, защита записей и прочее [1].
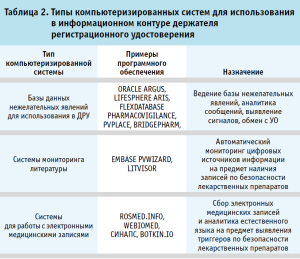
Также существуют специально разработанные системы автоматизированного мониторинга научной медицинской информации. Системы позволяют в промышленных масштабах выявлять, оценивать и фиксировать спонтанные сообщения из источников медицинской литературы (библиографические базы данных, научные журналы) и других интернет-ресурсов (сайты регуляторных агентств, социальные сети, медицинские форумы и др.), обнаруживать информацию для поиска сигналов по безопасности и эффективности лекарственных препаратов.
Также современные системы позволяют собирать и анализировать данные в виде естественного языка из различного рода электронных медицинских записей, обнаруживая потенциально рисковые паттерны с точки зрения общественного и индивидуального здоровья [15].
Обобщенный перечень с примерами подобных систем представлен в таблице 2.
Эффективной практикой является также привлечение к сбору информации самих пациентов не только в рамках активного репортирования (напрямую ДРУ и в регуляторные органы), но и за счет сбора данных из социальных сетей (vk.ru), форумов и блогов, например, irecommend, otzovik, PatientsLikeMe, MedMD, AskAPatient [3].
Наличие эффективного электронного обмена дает возможность использования мобильных медицинских приложений и устройств беспроводного мониторинга состояния пациента, которые могут иметь полезные функции, включая информацию о заболеваниях, дневники симптомов, журналы приема лекарств и напоминания, дневники питания и пр. [9].
Носимые устройства и мобильные приложения для здоровья измеряют физическое состояние и физиологические параметры и могут помочь в планировании приема лекарств. Некоторые из популярных медицинских устройств, которые используют пациенты, включают потребительские товары для мониторинга здоровья (например, Fitbit и Apple Watch), носимые внешние медицинские устройства (например, портативные инсулиновые помпы) и встроенные медицинские устройства (например, кардиостимуляторы). Носимые устройства могут генерировать динамические данные в реальном времени, которые поставщики могут оценивать с помощью программных приложений на компьютерах, планшетах или смартфонах [13]. Результаты быстро доступны и позволяют поставщикам услуг более эффективно вносить соответствующие коррективы, не дожидаясь результатов лабораторных исследований.
Однако исследования с использованием электронных инструментов здравоохранения на базе Интернета и смартфонов для мониторинга приема лекарств больше фокусируются на соблюдении режима приема лекарств, мониторинге и лечении хронических заболеваний, при этом примеров использования этих инструментов для выявления или профилактики НР меньше [18].
Этапы технологического развития держателя регистрационного удостоверения в контексте фармаконадзора
Автоматизированные системы могут выступать сильным акселератором развития системы фармаконадзора предприятия, однако такого рода улучшения стоит проводить на определенных этапах развития ДРУ. На большинстве предприятий ДРУ в ЕАЭС остро и первоочередно на данный момент стоит вопрос кадровой укомплектованности отделов фармаконадзора, исходя из реальной оцененной нагрузки на отдел. Только в случае наличия обученного коллектива можно планировать различные внедрения компьютеризированных систем и быть уверенным, что они приживутся, а именно баз для хранения данных по безопасности лекарственных препаратов и развития автоматических систем мониторинга. Таким образом, в верхнеуровневом контексте в рамках ДРУ в пострегистрационном фармаконадзоре у ДРУ можно наблюдать ряд закономерных этапов развития (табл. 3).
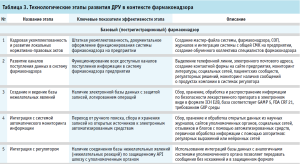
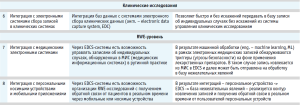
На начальном этапе основной задачей является кадровая укомплектованность и разработка локальных нормативных актов, что включает создание мастерфайла системы фармаконадзора, стандартных операционных процедур (СОП), журналов и интеграцию системы фармаконадзора с общей системой менеджмента качества на предприятии. Это обеспечивает правильное документальное оформление функционирования системы и формирует основу для эффективной работы специалистов внутри отдела фармаконадзора [1].
Второй шаг – развитие каналов поступления данных. Этап предполагает организацию разнообразных каналов для сбора информации о безопасности продукции, таких как выделенные телефонные линии, электронные адреса, контактные формы на сайте предприятия, а также мониторинг научной литературы, социальных сетей и пациентских сообществ.
Третий этап затрагивает создание и ведение базы данных нежелательных явлений (НЯ), что включает сбор, хранение, обработку и распространение информации по безопасности препаратов в электронном виде, что требует соответствия международным стандартам и нормам безопасности данных.
Четвертый этап включает интеграцию системы с автоматическими мониторинговыми системами для сбора и обработки данных из открытых источников (при достаточном объеме молекул в портфеле ДРУ), что позволяет перейти от ручного сбора информации к более эффективным автоматизированным методам, обеспечить воспроизводимость и масштабируемость процесса.
Логичным также оказывается этап интеграции с регуляторными органами через защищенные API-шлюзы, что обеспечивает надежную и безопасную передачу данных о нежелательных явлениях. Метод удовлетворяет требованиям по защите записи, логированию и прослеживаемости. При наличии клинических исследований должна быть предусмотрена возможность электронного обмена баз данных НЯ с системами электронного сбора клинических данных (EDC), что позволяет эффективно управлять данными об индивидуальных случаях без искажений [14].
Также актуальным представляется сбор и анализ данных из реальной клинической практики (RWE), возможная интеграция с медицинскими электронными системами и персональными носимыми устройствами для расширения возможностей сбора и анализа данных о безопасности лекарственных препаратов в реальном времени [8]. Таким образом, развитие фармаконадзора на предприятии требует комплексного подхода, начиная от формирования нормативной базы и кадровой политики до внедрения современных технологий для сбора, обработки и анализа данных, что позволяет не только соответствовать требованиям регуляторных органов, но и способствует повышению безопасности и эффективности лекарственных средств.
В рамках отраслевого исследования 2022 года было проведено исследование рынка, объектами которого являлись крупные российские производители и локальные представительства международных компаний [3]. С октября 2021 по октябрь 2022 года было проанализировано 57 компаний-производителей ЛС с различным количеством препаратов в портфеле (Me = 46 [31; 87]). В портфеле компаний количество оригинальных продуктов ограничивалось 5%, количество брендированных (уникальных наименований) – 15,2% (95% ДИ: 9,0; 21,4). В исследование вошли только те компании, которые не пользуются услугами аутсорсинга фармаконадзора.
По результатам исследования кадровой обеспеченности фармацевтических компаний было обнаружено только 30% (N = 17) компаний, которые имеют в штате двух и более специалистов по фармаконадзору, включая УЛФ (уполномоченное лицо по фармаконадзору); 47% (N = 27) имеют только одного специалиста по фармаконадзору и УЛФ; в единственном лице представлен УЛФ у 23% компаний (N = 13). При этом 25% УЛФ среди опрошенных компаний (N = 14) совмещают деятельность с другим функционалом в компании. Самым популярным способом получения сведений о препаратах являлась электронная почта (92%), на втором месте – выделенная телефонная линия (у 74%); замыкает тройку лидеров заполнение контактной формы на сайте компании-производителя, которая есть лишь у 65% ДРУ. Предпочтение для хранения информации многие ДРУ отдают программе MS Excel (N = 68%); в специализированном программном обеспечении информация хранится только у четверти опрошенных респондентов (N = 14 или 24,56%).
Таким образом, технологическое развитие отделов фармаконадзора в фармацевтических компаниях проходит через закономерные этапы, начиная с кадрового обеспечения и заканчивая внедрением автоматизированных систем мониторинга. Несмотря на законодательные требования к назначению уполномоченных лиц и формированию соответствующего штата специалистов, компании имеют ограниченный штат профильных специалистов, что подчеркивает проблему недостаточной кадровой обеспеченности в отрасли. Вопросы построения эффективной базы данных для хранения и анализа информации о препаратах остаются актуальными, учитывая, что большинство компаний использует простые табличные редакторы вместо специализированного ПО. Такая ситуация может сказываться на качестве фармаконадзора, так как сбор и анализ данных являются критически важными для управления рисками и обеспечения безопасности лекарственных средств.
Автоматизация процессов с помощью компьютеризированных систем является следующим шагом и может быть реализована только после полного удовлетворения кадровых и технологических потребностей на предыдущих этапах становления системы фармаконадзора предприятия.
Ограничения внедрения программного обеспечения в информационный контур держателя регистрационного удостоверения
Внедрение новых программных продуктов в информационный контур фармацевтического предприятия сопровождается рядом существенных ограничений и рисков, связанных с обеспечением соответствия высоким стандартам качества и безопасности отрасли.
Компании-производители на этапе внедрения цифровых технологий на предприятии сталкиваются с требованиями GXP-комплаенса, который состоит из пяти главных составляющих, объединяющих нормативные требования, как национальные, так и отраслевые, а также надлежащие практики [16]:
- Соответствие организации требованиям GMP, GSP, GVP, GCP, которые содержат указания к жизненному циклу компьютеризированных систем на предприятии. Такая ситуация предполагает строгий контроль за исполнением процессов эксплуатации ПО, что, в свою очередь, требует от предприятий значительных ресурсов на поддержание и актуализацию системы управления качеством.
- Вторым важным элементом выступает валидация процессов по GAMP5 (англ. – Good Automated Manufacturing Practice, версия 5), сокращение от «Надлежащая практика автоматизированного производства версии 5», является жизненно важной основой в фармацевтической и биофармацевтической промышленности. GAMP 5 подчеркивает важность риск-ориентированного подхода при разработке, валидации и использовании автоматизированных систем. Несоответствие этим требованиям может привести к серьезным последствиям, вплоть до отзыва продукции [6].
- Третьей важной составляющей внедрения процессов, использующих компьютеризированные системы на предприятии, является целостность и безопасность данных по стандарту 21 CFR 11. Этот стандарт определяет критерии достоверности электронных записей и их взаимозаменяемости с бумажными документами, а также критерии валидности электронных подписей. Нарушение данных принципов может подвергнуть компанию юридическим и финансовым рискам [7].
- Для обеспечения прозрачности и понятности документации на предприятии должны существовать СОПы. Данная документация (СОП, англ. SOP, Standard Operating Procedure) представляет собой набор пошаговых инструкций для однотипного выполнения последовательности каких-либо действий. Отсутствие четко оформленных СОПов может привести к ошибкам в процессах, а также к затруднениям при проведении аудитов и инспекций.
- У многих сотрудников возникает непонимание в работе с многочисленными требованиями и стандартами. В связи с этим неотъемлемой составляющей является развитие компетенций и обучение персонала компании-производителя ЛС. Недостаточный уровень обучения и компетенций персонала может стать серьезным барьером для успешного внедрения и последующей эксплуатации новых программных продуктов [12].
В совокупности, эти ограничения и риски требуют от фармацевтических компаний тщательного планирования, адаптации процессов и постоянного мониторинга для обеспечения соответствия нормативным требованиям и поддержания высокого уровня качества продукции, что подразумевает внедрение комплексного подхода к управлению качеством, безопасностью данных и обучению персонала. Такой подход в конечном итоге способствует повышению эффективности и конкурентоспособности ЛС на рынке.
Выводы
На уровне международных и государственных институтов внедрение компьютеризированных систем стало закономерным этапом накопления большого массива цифровых данных, стремления к удобному межсекторальному обмену этими данными и развитию технологических мощностей. Компьютеризированные системы повышают качество данных, уменьшая вероятность человеческой ошибки. Они способствуют получению более точных результатов обработки данных, экономя ресурсы людей и организации, а также формируют цифровой след, предоставляя возможность продемонстрировать регулирующим органам, что сбор данных производился и осуществлялся на предприятии регулярно. При накоплении большого количества данных о препарате цифровизация помогает налаживать взаимодействие между разными системами хранения информации.
Однако работа с разнородным потоком данных в фармаконадзоре прежде всего требует достаточной укомплектованности отделов фармаконадзора ДРУ, высокой квалификации специалистов таких отделов, умения анализировать и сопоставлять данные. Использование многочисленных электронных систем при проведении скрининга информации о лекарственных препаратах позволяет обеспечить полноту, целостность и воспроизводимость данных о НР ЛП. Однако переход на бизнес-процессы с использованием информационных технологий сопровождается и целым рядом трудностей, с которыми приходится сталкиваться ДРУ на этапе внедрения автоматизированных систем. Само по себе последнее не является критичным препятствием, а инвестиции в развертывание компьютеризированных систем существенно повышают качество фармаконадзора на предприятии.
- Velts N.Yu. et al. Submission of Documents on the Pharmacovigilance System as Part of the Registration Dossier within the Framework of the EAEU Procedures: Analysis of Requirements and Typical Errors // Bezopasnost` i risk farmakoterapii (Safety and Risk of Pharmacotherapy). 2024. No. 3 (12). P. 331–340. (In Russian).
- Krasheninnikov A.E., Matveev A.V., Egorova E.A. Development of adverse reactions databases, their introduction into pharmacovigilance systems and significance for the drug safety improve // Vestnik Volgogradskogo gosudarstvennogo medicinskogo universiteta (Journal of Volgograd State Medical University). 2018. No. 3 (67). P. 8–12. (In Russian).
- Nezhurina E.K., Milchakov K.S., Abramova A.A. Social Media as a Source of Information for the Detection of Adverse Drug Reactions in Post-Marketing Surveillance: A Review // Bezopasnost` i risk farmakoterapii (Safety and Risk of Pharmacotherapy). 2024; 12(4): 432-443. (In Russian).
- Chukreeva N. V. Historical stages in the evolution of drug quality assurance and quality control // Remedium. Zhurnal o rossijskom ry`nke lekarstv i medicinskoj texnike (Remedium). 2016. No. 6. P. 44–50. (In Russian).
- Shubnikova E.V. Postmarketing surveillance: review of open sources of drug safety data // Bezopasnost` i risk farmakoterapii (Safety and Risk of Pharmacotherapy) 2024. № 3 (12). C. 309–330. (In Russian).
- Alosert H. et al. Data integrity within the biopharmaceutical sector in the era of Industry 4.0 // Biotechnology Journal. 2022. № 6 (17). C. e2100609.
- Bansal A. et al. A 21 CFR Part 11 compliant graphically based electronic system for clinical research documentation // Journal of Medical Systems. 2012. № 3 (36). C. 1661–1672.
- Chen W.-W. et al. Using real-world evidence for pharmacovigilance and drug safety-related decision making by a resource-limited health authority: 10 years of experience in Taiwan // Pharmacoepidemiology and Drug Safety. 2020. № 11 (29). C. 1402–1413.
- Edrees H. et al. Intelligent Telehealth in Pharmacovigilance: A Future Perspective // Drug Safety. 2022. № 5 (45). C. 449–458.
- Ghosh R. et al. Automation Opportunities in Pharmacovigilance: An Industry Survey // Pharmaceutical Medicine. 2020. № 1 (34). C. 7–18.
- Kassekert R. et al. Industry Perspective on Artificial Intelligence/Machine Learning in Pharmacovigilance // Drug Safety. 2022. № 5 (45). C. 439–448.
- Kumar R. et al. Training and education in pharmacovigilance: The experience from the Pharmacovigilance Programme of India // Indian Journal of Pharmacology. 2024. № 5 (56). C. 348–357.
- Lancaster K. et al. The Use and Effects of Electronic Health Tools for Patient Self-Monitoring and Reporting of Outcomes Following Medication Use: Systematic Review // Journal of Medical Internet Research. 2018. № 12 (20). C. e294.
- Lu Z. Technical challenges in designing post-marketing eCRFs to address clinical safety and pharmacovigilance needs // Contemporary Clinical Trials. 2010. № 1 (31). C. 108–118.
- Luo Y. et al. Natural Language Processing for EHR-Based Pharmacovigilance: A Structured Review // Drug Safety. 2017. № 11 (40). C. 1075–1089.
- Ronninger S. et al. Considerations on Auditing and GxP Requirements along the Product Lifecycle // PDA journal of pharmaceutical science and technology. 2012. № 5 (66). C. 396–402.
- Sauer F. [Major milestones for European pharmaceutical policy] // Revue D’histoire De La Pharmacie. 2014. № 381 (62). C. 61–74.
- Wilson L.S., Maeder A.J. Recent Directions in Telemedicine: Review of Trends in Research and Practice // Healthcare Informatics Research. 2015. № 4 (21). C. 213–222.
