QUALITY AND SAFETY CONTROL OF MEDICINES
Modern approach to the organization of quality control of medical oxygen
1 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0002-9667-1014
2 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0003-4588-675X
3 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
The article presents a modern approach to the organization of quality control of the medicinal product “Medical oxygen, compressed gas”, which is in circulation on the Russian Federation. The problems associated with the testing of the medical gases and methods of solution are described. The results of the implementation of the first control and supervisory measures are presented.
Keywords: medicines, medical oxygen, medical gases, quality control, State Pharmacopoeia
Background.
Кислород медицинский является одним из важнейших лекарственных препаратов не только в России, но и во всех странах мира. Он используется практически во всех медицинских учреждениях, в том числе для жизнеобеспечения пациентов, находящихся в тяжелом состоянии. Потребление данного лекарственного препарата по информации, полученной от производителей, увеличилось за последние годы более чем в 5 раз. Это привело к необходимости наращивания объемов производства. Соответственно, увеличились и риски появления на рынке некачественной продукции, что требует особого контроля за качеством кислорода медицинского со стороны государства.
Ситуация в области производства, контроля качества медицинского кислорода, снабжения им лечебных учреждений различного уровня и формы собственности на фоне высокого спроса в период пандемии новой коронавирусной инфекции COVID-19 находится под пристальным вниманием со стороны контролирующих органов. Только за 2019–2020 годы в ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (далее – ФГБУ «ИМЦЭУАОСМП» Росздравнадзора) в несколько раз увеличилось количество запросов на проведение испытаний кислорода медицинского как от самих производителей, так и от Федеральной службы по надзору в сфере здравоохранения и органов Министерства внутренних дел.
На сегодняшний день на территории РФ зарегистрировано более ста производителей кислорода медицинского газообразного, каждый из которых обязан контролировать качество готовой лекарственной продукции. Большинство из них для контроля качества кислорода использует химические реакции ввиду необходимости соответствия производства газов требованиям стандарта ГОСТ 5583-78 «Кислород газообразный технический и медицинский. Технические условия». До 2018 года данный ГОСТ фактически являлся единственным нормативным документом, регламентирующим качество выпускаемого на рынок как технического, так и медицинского кислорода, получаемых из атмосферного воздуха способом низкотемпературной ректификации, а также электролизом воды. В 2018 году в Государственную фармакопею Российской Федерации (далее – ГФ РФ) была включена фармакопейная статья ФС.2.2.0026.18 «Кислород медицинский, газ сжатый», основой для создания которой также стал устаревший ГОСТ 5583-78, основанный на использовании химических методов анализа с применением специализированной стеклянной посуды. С утверждением фармакопейной статьи документом, регламентирующим для производителей перечень показателей качества, нормы содержания примесей и основного действующего вещества, а также методы проведения испытаний лекарственного препарата «кислород медицинский», стала ГФ РФ. Вместе с тем, неопределенность результата, полученного с использованием указанных в ГФ РФ качественных реакций, например, для определения примесей, сильно зависит от опыта оператора, качества посуды, реактивов и приготовления рабочих растворов. К тому же приведенные методы не позволяют оценить наличие посторонних незадекларированных примесей, связанных, например, с использованием некачественной и неочищенной оборотной тары (баллонов), некоторыми особенностями производства и т.д. Потоковые анализы с использованием таких методов представляются затруднительными ввиду существенны временны’ х затрат, а проведение испытаний непосредственно в медицинских учреждениях, являющихся основными потребителями медицинских газов, вообще невозможно без изъятия баллонов у больницы и их транспортировки до специализированных испытательных лабораторий, что в период пандемии является крайне нежелательным.
Учитывая сложности, связанные с транспортировкой баллонов лекарственного средства «кислород, газ медицинский сжатый», и невозможность проведения испытаний кислорода непосредственно в медицинских организациях в случае экстренной необходимости, Федеральной службой по надзору в сфере здравоохранения было принято решение о разработке новых способов проведения анализа кислорода с применением современных инструментальных методов с возможностью их использования на базе передвижных лабораторий ФГБУ «ИМЦЭУАОСМП» Росздравнадзора.
Сравнительный анализ требований к качеству кислорода медицинского, установленных в Российской Федерации и за рубежом
Согласно ГФ РФ ФС.2.2.0026.18, основными показателями качества кислорода медицинского газообразного являются описание, подлинность, содержание углерода монооксида, углерода диоксида, водяных паров, количественное содержание кислорода, а также газообразные кислоты и основания, озон и другие газы-окислители, упаковка и маркировка. Проводя сравнительный анализ требований к качеству кислорода медицинского, установленных в России и за рубежом (табл. 1), можно заметить не только разницу в нормах содержания основного действующего вещества и примесей, приведенных в ГФ РФ, Европейской фармакопее и Фармакопее США, но и отсутствие контроля за содержанием некоторых примесей в зарубежных монографиях, а именно газообразных кислот и оснований, озона и других газов-окислителей. Это связанно как с использующимися технологиями производства кислорода локальными производителями, так и с разницей в организации государственного регулирования в сфере обращения лекарственных средств. Тем не менее такие показатели, как подлинность и количественное содержание кислорода, а также содержание углерода монооксида и диоксида присутствуют во всех нормативных документах и являются наиболее важными при осуществлении контроля с позиции безопасности и эффективности лекарственного препарата.
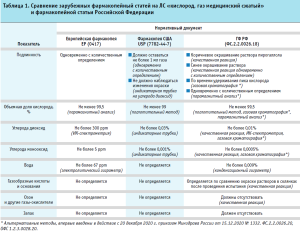
Выбор технологии контроля качества кислорода медицинского с применением современных инструментальных методов
Опираясь на сравнительные данные нормативных документов различных стран, а также на данные, полученные от ведущих российских производителей, входящих в Ассоциацию Производителей Промышленных и Медицинских Газов, при решении задачи осуществления контроля качества кислорода медицинского инструментальными методами, с возможностью их применения на базе передвижных лабораторий, основной акцент был сделан на такие показатели как:
- подлинность;
- наличие углерода монооксида и диоксида;
- количественное содержание кислорода.
Поскольку наиболее распространенный способ получения кислорода из воздуха с помощью низкотемпературной ректификации на современном криогенном оборудовании предполагает полное отсутствие в готовом продукте таких примесей как газообразные кислоты и основания, а также газы-окислители, их определение на базе передвижных лабораторий в рамках скрининга качества непосредственно в медицинских учреждениях было признано нецелесообразным.
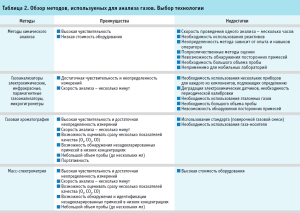
В ходе подбора и изучения технологий анализа для выбранных показателей качества кислорода медицинского было выявлено, что в настоящее время существует большое количество современных аналитических систем портативного, стационарного и промышленного исполнения, позволяющих контролировать качество промышленных и медицинских газов. К ним относятся различного рода газоанализаторы, которые позволяют проводить онлайн-мониторинг качества производимого газа в автоматическом режиме, газовые хроматографы, масс-спектрометры и т.д. Однако при сравнении всех достоинств и недостатков представленных технологий наиболее оптимальным, универсальным, доступным и быстрым методом анализа газовых смесей при сохранении высокой точности была признана газоадсорбционная хроматография (табл. 2). Этот способ повсеместно применяется для анализа газов в сфере энергетики, химической и добывающей промышленности и многих других. Газовая хроматография является фармакопейным методом, широко используется для контроля качества лекарственных препаратов, а также для контроля качества медицинских газов в том числе и за рубежом, например, в Европейской фармакопее в монографиях для таких медицинских газов как аргон (2407), азот (1247), различные оксиды азота (0416, 1550) и оксиды углерода (0375, 2408), метан (2413). Более того, уровень развития современного приборостроения позволил добиться миниатюризации газохроматографических систем, что дает возможности для переноса классической газовой хроматографии в портативное исполнение.
В 2019 году специалистами ФГБУ «ИМЦЭУАОСМП» Росздравнадзора совместно с учеными Самарского национального исследовательского университета им. академика С.П. Королева для анализа медицинского кислорода был разработан портативный газохроматографический комплекс на основе портативного газового хроматографа «ПИА», производства ООО «НПФ» МЭМС» (рис. 1). Хроматограф имеет малые массогабаритные характеристики, не требует обязательного подключения к электрической сети благодаря возможности питания от портативной аккумуляторной батареи, автономен и может быть использован в полевых условиях. Масса самого хроматографа составляет 2 кг, а масса всего комплекса в противоударном кейсе не превышает 10 кг. Хроматограф оснащен детектором по теплопроводности (ДТП), термохимическим детектором (ДТХ) и набором из трех микронасадочных планарных колонок с сорбентами Carboxen 1000, Porapak N, цеолитами CaA. Питание хроматографа осуществляется при использовании малолитражных баллонов с гелием марки А и сжатым воздухом класса 0 по ГОСТ 17433. Хроматографирование пробы осуществляется по трем каналам одновременно, что позволяет существенно сократить время проведения испытаний кислорода медицинского. На один анализ требуется не более 15 минут.

С применением портативного газохроматографического комплекса «ПИА» ФГБУ «ИМЦЭУАОСМП» Росздравнадзора была разработана методика измерений объемной доли кислорода, монооксида и диоксида углерода, азота, метана методом газовой хроматографии в кислороде медицинском газообразном. В июле 2019 года методика прошла метрологическую аттестацию в сфере государственного применения во ФГУП «Уральский научно-исследовательский институт метрологии», а позже, после проведения ее валидации и апробации на образцах кислорода медицинского нескольких производителей, вошла в новую редакцию действующей фармакопейной статьи ФС.2.2.0026.20 «Кислород, газ медицинский сжатый. Кислород. Oxygenium», введенную взамен ФС.2.2.0026.18, и в новую общую фармакопейную статью ОФС 1.2.3.0028.20 «Количественное определение кислорода в лекарственных средствах на основе кислорода медицинского», утвержденные и введенные в действие приказом Министерства здравоохранения РФ с 20 декабря 2020 года.
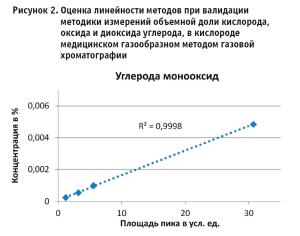
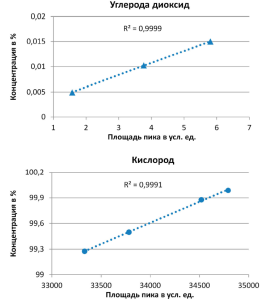
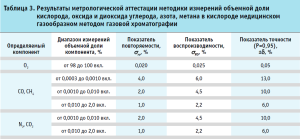
На рисунке 2 представлены графики зависимости площади пика от концентрации моноксида углерода, диоксида углерода и кислорода, полученные при валидации методики. Значение квадрата коэффициента корреляции для всех определяемых компонентов составило 0,999, что свидетельствует о линейной зависимости площади пика от концентрации. Приведенные в таблице 3 метрологические характеристики демонстрируют возможности метода в отношении анализа вышеуказанных компонентов. Полученные показатели повторяемости, воспроизводимости и точности полностью удовлетворяют необходимым требованиям.
Проведение испытаний в передвижных лабораториях
Использование портативного газохроматографического комплекса «ПИА», а также внесение изменений в фармакопейную статью с добавлением альтернативных методик с применением газовой хроматографии для таких показателей качества, как подлинность и количественное определение, а также для содержания примесей угарного и углекислого газа позволили с успехом решить поставленную Росздравнадзором задачу проведения испытаний кислорода медицинского в передвижных лабораториях. Так, в 2019 году начала работу в области контроля качества кислорода медицинского передвижная лаборатория Казанского филиала, а с 2020 года оснащены еще 11 передвижных лабораторий филиалов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, базирующихся в различных регионах Российской Федерации. Использование передвижной лаборатории для контроля качества кислорода медицинского позволяет значительно расширить количество проверяемых образцов на большей территории. Схема проведения испытаний в передвижной лаборатории выглядит следующим образом:
1) прибытие передвижной лаборатории в медицинское учреждение либо на склад поставщика или производителя;
2) отбор баллонов кислорода для проведения испытаний Территориальным органом Росздравнадзора;
3) проведение специалистом ФГБУ «ИМЦЭУАОСМП» Росздравнадзора испытаний по физико-химическим показателям с использованием портативного газохроматографического комплекса «ПИА», проверка соответствия таких показателей, как описание, упаковка, маркировка, срок годности;
4) выдача протокола испытаний.
В случае положительных результатов образец возвращается в медицинское учреждение для дальнейшего использования, а в случае отрицательных – направляется в лабораторию на полный анализ в соответствии с утвержденной нормативной документацией производителя. При обнаружении испытательной лабораторией несоответствия, информация о лекарственном средстве доводится до Росздравнадзора и производителя. По решению Федеральной службы по надзору в сфере здравоохранения данная серия лекарственного препарата изымается из обращения, что позволяет предотвратить применение некачественного лекарственного средства.
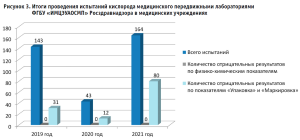
За 2019 и 2020 годы специалистами передвижных лабораторий было проанализировано более 180 образцов кислорода в основном в рамках выборочного контроля по Приволжскому федеральному округу. В 2021 году кислород медицинский вошел в план выборочного контроля качества лекарственных средств уже по всей России, и к концу 3-го квартала по заданию Росздравнадзора проведены испытания 164 образцов кислорода медицинского в 21 регионе нашей страны (рис. 3).
За все время применения газовой хроматографии для анализа медицинского кислорода качество проанализированных лекарственных средств соответствовало требованиям по физико-химическим показателям, однако неоднократно в рамках проверок были выявлены нарушения по упаковке, маркировке и сроку годности. Оценка упаковки и маркировки в соответствии с утвержденной нормативной документацией включает в себя следующие основные параметры:
- наличие голубой окраски баллона;
- наличие надписи по окружности черного цвета «Кислород медицинский»;
- наличие контроля первого вскрытия;
- наличие инструкции по применению;
- наличие информационных этикеток на баллоне, включающих данные о предприятии-изготовителе, название лекарственного средства, его лекарственную форму, номер серии/партии, информацию о дате наполнения и сроке годности, номер регистрационного удостоверения, предупреждающие надписи и т.д.
Однако ряд баллонов, отобранных Росздравнадзором для проведения испытаний, не имели этикетку, данных о производителе и номере регистрационного удостоверения. Отсутствовали данные о серии лекарственного средства, в некоторых случаях невозможно было идентифицировать надпись на баллоне «Кислород медицинский», отсутствовала инструкция по применению и контроль первого вскрытия. Также на части баллонов не приводилась информация о дате наполнения, что не давало возможности контролировать срок годности лекарственного препарата. Несоблюдение требований по упаковке и маркировке лекарственных средств, помимо несоответствия требованиям по физико-химическим показателям, также являются признаками недоброкачественного лекарственного средства и могут служить основанием для изъятия из обращения данных препаратов.
Помимо проведения выездных проверок, нововведением в осуществлении контроля за обращением лекарственных средств, в том числе и кислорода медицинского, стало принятие Федерального закона от 27.12.2019 № 449-ФЗ «О внесении изменений в Федеральный закон “О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд”». В соответствии с данным законом перед вводом в гражданский оборот каждой серии или каждой партии произведенного в Российской Федерации кислорода медицинского, производитель обязан предоставлять в Росздравнадзор документ производителя лекарственного средства, подтверждающий его качество, и подтверждение уполномоченного лица производителя о соответствии лекарственного препарата требованиям, установленным при его государственной регистрации. Все вышеуказанные данные вводятся в автоматизированную информационную систему (АИС) Росздравнадзора. Также ежегодно производители лекарственных средств представляют в Росздравнадзор протокол испытаний поступившего в течение года в гражданский оборот лекарственного препарата (на одну серию каждого торгового наименования с учетом лекарственной формы и дозировки), проводимых аккредитованными лабораториями. В случае выявления в гражданском обороте лекарственного препарата, сведения о качестве которого отсутствуют, Росздравнадзор может принять решение о прекращении обращения серии (партии) данного лекарственного средства до предоставления сведений. С вступлением в силу закона проверить наличие сведений о выпуске конкретной серии медицинского кислорода может не только федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере здравоохранения, но и любой потребитель в открытой системе Росздравнадзора в разделе «Ввод в гражданский оборот лекарственных препаратов», а значит и снизить риск применения недоброкачественного или контрафактного лекарственного средства. Так, во время проведения испытаний кислорода специалистами передвижных лабораторий ФГБУ «ИМЦЭУАОСМП» Росздравнадзора было зафиксировано несколько случаев отсутствия сведений в АИС Росздравнадзора о сериях лекарственного препарата «кислород медицинский», находящихся в обращении и поставляемых в медицинские учреждения.
Conclusion.
Системная работа Федеральной службы по надзору в сфере здравоохранения и ФГБУ «ИМЦЭУАОСМП» Росздравнадзора в новых реалиях законодательной базы в области обращения лекарственных средств за последние годы позволила усилить контроль за качеством жизненно важного лекарственного препарата – кислорода медицинского, что особенно важно в период его острой необходимости. Введение новых альтернативных методик анализа кислорода медицинского в Государственную фармакопею РФ позволило проводить контроль качества лекарственного препарата в короткие сроки, как при проведении проверок со стороны Росздравнадзора, так и непосредственно на производстве. По итогам первых трех лет проведения испытаний кислорода медицинского ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, рабочих встреч Росздравнадзора с участниками рынка наблюдается тенденция к снижению нарушений со стороны производителей кислорода медицинского при производстве и выпуске препаратов в гражданский оборот. Так, например, заметно снижение нарушений по упаковке и маркировке почти на 10% в тех регионах, где проверки качества кислорода медицинского стали осуществляться в плановом режиме и на регулярной основе. Также наблюдается тенденция к переходу производителей кислорода к современным инструментальным методам анализа, что также положительно сказывается на качестве выпускаемой продукции.
