INNOVATIVE MEDICAL PRODUCTS
Modern methodological approaches to the transfer of innovative medical devices
1 — Federal State Budgetary Institution “Scientific Center for Examination of Medical Devices” of the Ministry of Health of the Russian Federation, 8, p. 2, Petrovsky b-r, Moscow, 127051, Russian Federation.
2 — Federal State Budgetary Institution “Scientific Center for Examination of Medical Devices” of the Ministry of Health of the Russian Federation, 8, p. 2, Petrovsky b-r, Moscow, 127051, Russian Federation.
3 — Federal State Budgetary Institution “Scientific Center for Examination of Medical Devices” of the Ministry of Health of the Russian Federation, 8, p. 2, Petrovsky b-r, Moscow, 127051, Russian Federation.
4 — Federal State Budgetary Institution “Scientific Center for Examination of Medical Devices” of the Ministry of Health of the Russian Federation, 8, p. 2, Petrovsky b-r, Moscow, 127051, Russian Federation.
In modern conditions of external restrictions, all areas of innovation are considered taking into account strategic planning to achieve technological sovereignty and national security of the country, especially in the field of healthcare and the development of the medical industry. Medical products are high-tech products that have both scientific and national social significance. At the same time, despite the significantly increased number of new innovative projects that claim to be aimed at improving the quality and accessibility of medical care, the number that reach the stage of successful implementation, according to literature sources, does not exceed 10%. To introduce innovative medical products into practical use, scientific, technical, legal, marketing and economic support is required.
This work analyzes the main directions for the development of commercialization of high-tech innovative medical products and, based on the experience of transferring medical devices, a basic track is created for the project of transferring an innovative medical product from idea to patient. The use of the track will allow for a comprehensive step-by-step implementation of the process plan by identifying the necessary tasks and regulating the functionality of the project subjects.
The organization of work on the promotion and implementation of medical technologies in accordance with the proposed track model is designed to help meet the need for quality medical care, the establishment of private and public partnerships, and reduce the risks of investing in the healthcare sector.
Keywords: medical device, innovative product, track, scientific program, information and analytical program, database, medical technology, medical innovation, patient-centred, transfer of medical technologies, promotion strategy
Background.
В современных условиях внешних ограничений высокотехнологичное производство играет большую роль в развитии экономики государства. Одним из важных направлений инновационной деятельности страны является медицинская промышленность, где четко прослеживается очевидность потребителя этой инновационной продукции. При этом, несмотря на значительно выросшее число новых инновационных проектов, заявляющих своей целью повышение качества и доступности медицинской помощи, число доходящих до стадии успешного внедрения, по данным литературных источников, не превышает 10%1. Повышение качества и доступности медицинской помощи, обеспечение устойчивости системы здравоохранения, в том числе за счет создания резервов и расширения производства медицинских изделий, как и развитие перспективных высоких технологий в медицине, являются одними из важнейших задач обеспечения национальной безопасности и технологического суверенитета России2.
Для поддержания импортозамещающих стратегий в здравоохранении Министерство промышленности и торговли при поддержке Министерства финансов и Министерства здравоохранения Российской Федерации проводит изменения налоговых режимов и правил проведения государственных закупок для увеличения конкурентоспособности отечественной медицинской техники3.
Развиваются национальные медицинские исследовательские центры Минздрава России, что способствует достижению технологического суверенитета страны, а проработка проблемных направлений поможет нарастить долю отечественных препаратов до 75% к 2030 году4.
Для выполнения целей импортозамещения в текущих условиях необходимо централизованное управление и распределение имеющихся ресурсов, повышение эффективности деятельности медицинской промышленности за счет создания и развития отечественных производств, грамотное использование механизмов финансовой поддержки для восстановления приоритетного звена здравоохранения.
Производство полного цикла инновационных медицинских изделий, как и медицинских изделий, ранее импортируемых и не производимых в России, особенно по позициям, вошедшим в перечень дефектурных кодов вида медицинских изделий5, будет способствовать повышению уровня здравоохранения, конкурентоспособности российской экономики, гибкости производственных цепочек и в дальнейшем укреплению экспортного потенциала и переходу на импортоопережающие стратегии.
В сегодняшних условиях формируется весьма большое количество инновационных разработок, которые могут увеличить как эффективность ухода за пациентами, так и их лечение. На данный момент медицинская промышленность представляет собой одну из самых высокотехнологичных сфер, которая характеризуется повышенным уровнем научно-инновационной деятельности. Прогресс в данной сфере будет происходить исключительно при условии корректного взаимодействия между медициной, инновациями и бизнесом.
В рамках реализации стратегических инициатив социально-экономического развития Российской Федерации до 2030 года, в частности, федерального проекта «Медицинская наука для человека», стартовавшего в 2022 году6, планируется повысить эффективность и практический выход от медицинских исследований и разработок, результаты которых должны воплощаться в конкретных лекарственных препаратах, медицинских изделиях, методах и способах профилактики, диагностики, лечения и реабилитации для практического здравоохранения.
В соответствии с приказом Минздрава России от 28.01.2022 № 40 «О центре трансфера медицинских технологий» на базе федерального государственного бюджетного учреждения «Научный центр экспертизы средств медицинского применения» Минздрава России создан центр трансфера медицинских технологий (далее – Центр, ЦТМТ).
Основными функциями Центра являются:
- Содействие лицам, осуществляющим научную (научно-исследовательскую) и (или) научно-техническую деятельность, а также федеральным органам исполнительной власти, обеспечивающим разработку и реализацию программ научных исследований в сфере охраны здоровья, их координацию в выявлении и предоставлении правовой охраны результатам интеллектуальной деятельности, полученным при проведении прикладных научных исследований в интересах медицины и здравоохранения.
- Формирование рекомендаций, касающихся доклинических исследований и клинических исследований лекарственных препаратов, технических испытаний и клинических испытаний медицинских изделий, исследований, направленных на обеспечение достаточного уровня доказательности методов и способов профилактики, диагностики, лечения и реабилитации, по проектам тематик прикладных научных исследований и тематикам прикладных научных исследований по представлению координационного центра исследований и разработок в области медицинской науки.
- Консультирование по вопросам способов внедрения разработанных лекарственных препаратов, медицинских изделий, методов и способов профилактики, диагностики, лечения и реабилитации, материалов, предназначенных для изготовления медицинских изделий по индивидуальным заказам пациентов, и расширения их применения с учетом действующего нормативного правового регулирования.
- Содействие в коммерциализации результатов разработок, включая создание и ведение перечней перспективных разработок и их результатов, производителей медицинской и фармацевтической продукции, оценке ожидаемых сравнительной клинической эффективности и безопасности результатов разработок и экономических последствий их применения, поиске индустриальных партнеров для коммерциализации результатов разработок, консультирование, в том числе правовое, по вопросам разработки и реализации стратегии коммерциализации результатов разработок, организация аукциона интеллектуальной собственности.
- Подготовка предложений по механизмам финансового обеспечения проведения ранних фаз клинических исследований лекарственных препаратов, права на которые принадлежат бюджетным или автономным государственным учреждениям, на принципах венчурных инвестиций.
Под коммерциализацией подразумевается процесс экономической реализации в практической медицинской деятельности результатов научно-исследовательских и опытно-конструкторских работ.
К медицинским изделиям стоит отнести обширную номенклатуру оборудования, инструментов, приборов, предметов ухода за больными и перечень иных медицинских изделий для осуществления лечения, диагностики, профилактики и реабилитации населения. Инновационным медицинским изделием принято считать изделие, полученное в ходе научно-технической разработки и наделенное новыми свойствами, качествами, функционалом и методом медицинского применения.
Формализация задач в сфере разработки инновационных медицинских изделий весьма трудоемка. Связано это прежде всего с тем, что проектирование должно быть проведено в соответствие с нормативно-правовыми требованиями здравоохранения и обращения медицинских изделий, стандартами технологического и промышленного производства и должно предоставлять функциональные возможности, удовлетворяющие потребности конечных пользователей – пациентов. Следовательно, необходимо осуществлять целостный подход к разработке медицинского изделия и трансферу медицинской технологии – от идеи продукта и соответствия требованиям, создания опытных образцов, испытаний, регистрации до коммерциализации продукта и доведения до пациентов.
Цель работы
На основании имеющегося опыта ЦТМТ по сопровождению проектов медицинских технологий разработать базовый трек трансфера и модель процесса продвижения инновационного медицинского изделия от разработчика к пациенту.
Задачи
- Детально изучить нормативно-правовую базу для разработки, осуществления программ научных исследований и предоставления правовой охраны результатам интеллектуальной деятельности в сфере разработки продвижения инновационных медицинских изделий.
- Сформулировать четкие алгоритмы действия, касающиеся научных, технических, токсикологических, клинических, постмаркетинговых исследований медицинских изделий, направленных на обеспечение достаточного уровня доказательности качества, эффективности и безопасности.
- Предложить оптимальные пути масштабирования результатов разработок, поиска индустриальных партнеров, введения в оборот и реализации стратегии коммерциализации медицинского изделия.
- Пошагово детализировать в базовом треке процесс трансфера и предложить пациент-ориентированную модель продвижения медицинского изделия.
Материалы и методы исследований
В работе использован метод подбора актуальной информации по доступным научным базам в соответствии с задачами исследования: РИНЦ, Scopus®, Microsoft Academic, MedLine, PubMed.
В процессе работы были изучены и обобщены материалы из доступных литературных источников по вопросам осуществления программ научных исследований, управления проектами, предоставления правовой охраны результатам интеллектуальной деятельности, методологических подходов к вопросам оценки эффективности и безопасности, производственных процессов и технологий производства медицинских изделий, сертификационных и регистрационных испытаний медицинских изделий, дизайна и стратегии клинических исследований медицинских изделий, трансфера технологий, продвижения и масштабирования результатов инновационных разработок, поиска индустриальных партнеров, путей введения в оборот и реализации стратегии коммерциализации медицинского изделия.
Для анализа и обобщения информации применялись современные информационно-аналитические программы для поиска и обработки больших баз неопределенно структурированных данных по ключевым словосочетаниям: инновационное медицинское изделие, регистрационные исследования, правовая охрана результатов интеллектуальной деятельности, инновационная медицинская технология, высокотехнологичное медицинское изделие, управление проектами, трансфер медицинских технологий, стратегия коммерциализации инновационного продукта, импортозамещение в медицинской промышленности, масштабирование результатов инновационных разработок, введение в оборот медицинского изделия.
Трансфер инновационных медицинских изделий: методологические подходы
Инновационная медицинская продукция в большинстве своем основана на результатах прикладных научно-исследовательских работ и опытно-конструкторских работ (НИР, ОКР, НИОКР), ведущихся в медицинских и образовательных научных учреждениях.
Процессы проведения НИР регламентируются правилами и стандартами отрасли, например, ГОСТ Р 15.101-2021 «Система разработки и постановки продукции на производство. Порядок выполнения научно-исследовательских работ». При подготовке и проведении исследования выделяют несколько этапов, которые отличаются друг от друга характером и содержанием, формами и процедурами исследовательской деятельности. Эти этапы взаимосвязаны и объединены логикой единого исследовательского замысла и в большинстве своем заканчиваются на этапе создания функционального экспериментального (опытного) образца или написания технического задания на проведение ОКР, в зависимости от типа исследования или государственного задания (рис. 1).
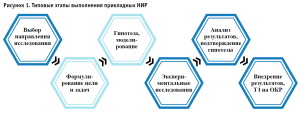
При этом промышленная сфера производства медицинских изделий имеет собственные правила и этапы разработки и вывода продукции на рынок.
Как и в других отраслях, инновации в области медицинских технологий начинаются с анализа и определения рынка, потребности которого не используются или не удовлетворяются, или существует более эффективный способ удовлетворения этих конкретных потребностей. Этими потребностями может быть все, что обеспечивает решение, такое как: новый или лучший способ мониторинга здоровья, улучшенные решения для оказания медицинской помощи, устройства или технологии для обеспечения более эффективного управления или все, что поддерживает здоровье и жизнь человека.
Технологическое проектирование медицинского изделия и контроль за качеством процессов производства представляет собой комплексный и целостный подход с обязательным наличием обратной связи между этапами разработки инновационного продукта.
В настоящее время для производителей стерильных медицинских изделий класса риска 2а7 и всех медицинских изделий класса риска 2б и 3 является обязательным внедрение системы менеджмента качества (СМК) в процессы производства, включающее в себя разработку политики в области качества, постановку контроля за технологическими процессами, стандартизацию операционных процедур сотрудников, поддержание уровня результата производства. Регламентирующим документом в этой сфере является постановление Правительства РФ от 09.02.2022 №135, вводящее требование о необходимости разработки и внедрения СМК в соответствии с требованиями межгосударственного стандарта ГОСТ ISO 13485-2017 «Изделия медицинские. Системы менеджмента качества. Требования для целей регулирования».
По требованиям правил обращения медицинских изделий, каждое изделие должно соответствовать требованиям качества, эффективности и безопасности – именно на соответствие данных параметров медицинское изделие проверяется в процессе технических, токсикологических и клинических (клинико-лабораторных) испытаний8. При этом, с точки зрения потребителя, медицинское изделие также должно соответствовать наибольшей функциональности, удобству использования, включая интуитивно понятную инструкцию, и надежности. Для соответствия всем необходимым параметрам становятся обязательными повторяющиеся испытания с проверкой и валидацией медицинских изделий в процессе их разработки (рис. 2). Верификация и валидация медицинских изделий в процессе проектирования должны гарантировать, что изделие соответствует потребностям здравоохранения, определенным на первом этапе проекта, и обеспечивает предполагаемое решение медицинской задачи.
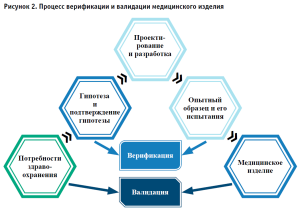
Верификация является внутренним процессом, который оценивает соответствие выходных данных проекта указанным медико-техническим требованиям, спецификациям или нормам, определенным во входных данных проекта. Валидация является процессом, подтверждающим соответствие разработанного продукта заложенному в него практическому применению.
Политика управления рисками в соответствии с ГОСТ ISO 14971-2021 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям» должна быть включена на всех этапах проектирования и разработки медицинских устройств.
Процессы разработки медицинского изделия не с научной, но производственной точки зрения также регламентируются своими стандартами, например, ГОСТ 2.103-2013 «ЕСКД. Стадии разработки» (рис. 3). В стандарте указаны этапы, в основе своей схожие с этапами проведения НИОКР/ОКР, но имеющие отраслевые особенности.
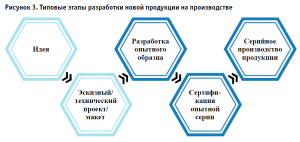
По результатам проведенного анализа был разработан базовый трек (англ. track – «след, дорожка, колея, курс, трасса, путь») проекта по трансферу инновационного медицинского изделия и представлена пациент-ориентированная модель внедрения нового медицинского изделия (таблица).



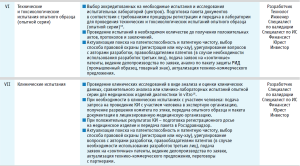
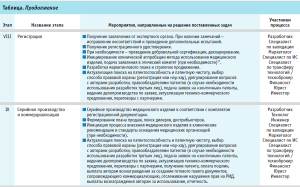

На каждом этапе реализации проекта по трансферу инновационного медицинского изделия в треке регламентируется выполнение ряда мероприятий, необходимых для успешного продвижения.
Это достигается путем участия целого ряда высококвалифицированных специалистов: химиков, биологов, врачей, инженеров, юристов, экономистов, маркетологов, патентоведов, специалистов в области трансфера технологий, инвесторов, руководителей проекта и др. При этом его участники, непосредственно осуществляющие процесс трансфера, должны иметь определенный набор компетенций, определяемых особенностями вида медицинского изделия. По мере реализации проекта доля ответственности, профессиональный состав и роль участников процесса в принятии решения по дальнейшему продвижению проекта могут динамически меняться.
Discussion.
Представленные в статье материалы посвящены трансформации современного здравоохранения в новую, инновационно- и пациент- ориентированную экосистему, позволяющую сделать здоровье населения страны ведущим фактором, определяющим социально-экономическую стабильность. Создание подобной системы невозможно без существенной модернизации здравоохранения на основе реализации инновационных и импортозамещающих проектов.
Авторами разработана базовая модель трека внедрения инновационного медицинского изделия, являющегося примером трансфера технологий в здравоохранении и медицинской науке. Комплексный и последовательный подход к выполнению этапов разработки медицинского изделия позволит достигнуть качественных и более быстрых результатов для выхода в реальный рынок.
Ярким примером консолидации усилий науки, промышленности и медицины для разработки и скорейшего внедрения необходимой продукции в практическое здравоохранение является массовое производство медицинских изделий, предназначенных для применения в период пандемии COVID-19.
Трек содержит 10 базовых стадий трансфера нового и (или) инновационного медицинского изделия. В основу представленной концепции трансфера лег принцип последовательных шагов и взаимодействие всех субъектов инновационного процесса. Представленный трек является цепью этапов и событий, часто параллельных, при выполнении которых результатом послужит медицинская инновация, удовлетворяющая потребностям пациентов, трансфер от идеи и создания продукта интеллектуальной деятельности до конечного прикладного продукта – медицинского изделия.
Использование предлагаемой авторами маршрутизации продвижения медицинского изделия предусматривает возможность частичного государственного субсидирования и основано на осуществлении целенаправленной, взаимосвязанной деятельности субъектов, которая согласована и распределена по этапам и срокам осуществления, что существенно снижает риски инвестиций и способствует достижению эффективной реализации проекта.
Важным моментом представленной модели трансфера является тот момент, что начальным и конечным объектом деятельности по внедрению в практическое здравоохранение медицинского изделия является пациент.
Conclusion.
Авторами разработан базовый трек трансфера инновационного медицинского изделия, в котором поэтапно детализирован путь разработки от идеи до внедрения в клиническую практику.
Процесс продвижения нового и (или) инновационного медицинского изделия рассматривается в рамках пациент-ориентированного подхода в здравоохранении и направлен на оптимизацию взаимодействия участников отрасли при соблюдении последовательной реализации взаимосвязанных стадий трансфера с учетом сложившейся регуляторной практики, правовых, технологических и экономических особенностей.
В рамках представленной модели трансфера степень удовлетворенности персонализированной потребности пациента в лечении определяет диагностическую и терапевтическую ценность медицинского изделия, успешность его продвижения.
Методологические подходы к трансферу инновационных медицинских изделий, предложенные авторами стати, призваны способствовать ускорению реализации медицинских инноваций, становлению частного и государственного партнерства, снижению рисков инвестирования в сфере здравоохранения.
_______________________________________________________________________
1 Павленко, О. В. Российские инновации в медицинской технике /О. В. Павленко // Аналитический вестник Совета Федерации ФС РФ, Российские инновации в медицинской технике. — 2018. — № 4(390). — С.64–73.
2 Указ Президента РФ от 02.07.2021 № 400 «О Стратегии национальной безопасности Российской Федерации».
3 Развитие медицинской и фармацевтической промышленности (госпрограмма) [Электронный ресурс] // zdrav.expert Медтех-портал. 2023. Дата обращения: 20.06.2023. URL: https://zdrav.expert/index.php/Статья:Развитие_медицинской_и_фармацевтической_промышленности (госпрограмма).
4 Новые перспективы Национального проекта «Здравоохранение» [Электронный ресурс] // minzdrav.gov.ru Министерство здравоохранения Российской Федерации. 2023. Дата обращения: 23.07.2018. URL: https://minzdrav.gov.ru/news/2018/07/18/8578-novye-perspektivy-natsionalnogo-proekta-zdravoohranenie.
5 Интернет-ресурс Росздравнадзора: https://roszdravnadzor.gov.ru/documents/81664.
6 Проект «Медицинская наука для человека» РГ03-ОС01-Р03. Научно технологическое развитие Российской Федерации PDF.
7 Приказ Минздрава России от 06.06.2012 № 4н «Об утверждении номенклатурной классификации медицинских изделий».
8 Приказ Минздрава России от 30.08.2021 № 885н «Об утверждении Порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
9 ГОСТ 15.101-2021 «Система разработки и постановки продукции на производство. Порядок выполнения научно-исследовательских работ».
10 ГОСТ Р 15.011-2022 «Система разработки и постановки продукции на производство. Патентные исследования. Содержание и порядок проведения».
11 ГОСТ 15.016-2016 «Система разработки и постановки продукции на производство. Техническое задание. Требования к содержанию и оформлению».
12 ГОСТ 2.103-2013 «ЕСКД. Стадии разработки». ГОСТ Р 15.013-2016 «Система разработки и постановки продукции на производство. Медицинские изделия».
13 ГОСТ 16504-81 «Система государственных испытаний продукции. Испытания и контроль качества продукции. Основные термины и определения».
14 Приказ Роспатента от 11.12.2020 № 163 «Об утверждении Административного регламента предоставления Федеральной службой по интеллектуальной собственности государственной услуги по государственной регистрации изобретения и выдаче патента на изобретение, его дубликата».
15 ГОСТ Р 56431-2015 «Система менеджмента качества. Изделия медицинские. Руководство по валидации процессов».
16 Решение Совета Евразийской экономической комиссии от 24.12.2021 № 144 «О внесении изменений в Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий». Решение Коллегии Евразийской экономической комиссии от 22.12.2015 № 173 «Об утверждении Правил классификации медицинских изделий в зависимости от потенциального риска применения». Решение Совета Евразийской экономической комиссии от 12.02.2016 № 27 «Об утверждении Общих требований безопасности и эффективности медицинских изделий, требований к их маркировке и эксплуатационной документации на них». Постановление Правительства РФ от 27.12.2012 № 1416 «Об утверждении правил государственной регистрации медицинских изделий». Приказ Минздрава от 19.01.2017 № 11н «Об утверждении требований к содержанию технической и эксплуатационной документации производителя». Приказ Минздрава России от 30.08.2021 № 885н «Об утверждении Порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий». Решение Совета Евразийской экономической комиссии от 12.02.2016 № 28 «Об утверждении Правил проведения технических испытаний медицинских изделий». Решение Совета Евразийской экономической комиссии от 16.05.2016 № 38 «Об утверждении Правил проведения исследований (испытаний) с целью оценки биологического действия медицинских изделий». Решение Совета Евразийской экономической комиссии от 12.02.2016 № 29 «О Правилах проведения клинических и клинико-лабораторных испытаний (исследований) медицинских изделий». Решение Совета Евразийской экономической комиссии от 24.12.2021 № 146 «О внесении изменений в Решение Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 29».
17 Приказ Минздрава России от 19.05.2023 № 245н «Об утверждении Положения об организации клинической апробации методов профилактики, диагностики, лечения и реабилитации и оказания медицинской помощи в рамках клинической апробации методов профилактики, диагностики, лечения и реабилитации (в том числе порядка направления пациентов для оказания такой медицинской помощи), типовой формы протокола клинической апробации методов профилактики, диагностики, лечения и реабилитации».
