QUALITY CONTROL OF MEDICINES
Development and validation of a method for authenticating desloratadine tablets by NIR spectrometry
1 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0002-2829-8801
2 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.; Federal State Budgetary Institution of Science “N.N. Semenov Federal Research Center for Chemical Physics Russian Academy of Sciences”, 4, Kosygina St., Moscow, 119991, Russian Federation.
ORCID: https://orcid.org/0000-0002-0146-8284
3 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
4 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.; Federal State Autonomous Educational Institution of Higher Education “I.M. Sechenov First Moscow State Medical University (Sechenov University)” of the Ministry of Health of the Russian Federation, 8, bld. 2, Trubetskaya St., Moscow, 119991, Russian Federation.
ORCID: https://orcid.org/0000-0002-0636-3254
The authentication of medicines is a new independent direction in the quality control system of medicines. Infrared spectroscopy in the near region (NIR spectrometry) in combination with chemometric analysis (NIR-analysis) is one of the priority methods for the authentication of tableted medicines, since it allows for quick measurement through primary packaging and does not require sample preparation. Desloratadine tablets, 5 mg, in a blister packaging from polyvinyl chloride and aluminum foil has been chosen as the object of the study. The goal of the work is demonstration the approach for authentication of tableted medicines using non-destructive NIR measurements and chemometrics modeling. Step-by-step model development and validation are described. The method of one-class classification has been used for modeling. As a result of the study, a model for authentication of desloratadine tablets by NIR-analysis was developed and validated.
Keywords: medicines, Desloratadine tablets, medicines authentication, NIR spectroscopy, spectra preprocessing, method of one-class classification, validation of the medicines mathematic model
Background.
Аутентификация лекарственных средств является новым самостоятельным направлением в системе контроля качества лекарственных средств [1–4]. Предпосылкой ее возникновения стала борьба с проникновением на рынок фальсифицированных и некачественных или субстандартных лекарственных средств. В отличие от общепринятой оценки качества лекарственных средств на соответствие требованиям нормативной документации или фармакопейной статьи2, аутентификация лекарственных средств проводится для подтверждения того, что исследуемый образец является подлинным или аутентичным, т.е. произведен конкретным производителем по регламентируемой технологии.
Для аутентификации лекарственных средств используются разные подходы и методы анализа, выбор которых зависит от критического показателя качества лекарственного средства (маркировка, профиль примесей, поиск нежелательного компонента или идентификатора и др.) [5–7]. Для таблетированных и капсулированных лекарственных средств аутентификацию часто проводят методом спектрометрии в ближней инфракрасной (БИК) области (далее – БИК-спектрометрия) в сочетании с хемометрическими методами анализа (далее – БИК-анализ) [8–11]. Ее спецификой является построение математической модели, адекватной составу препарата и его технологическому процессу производства, и последующее сравнение с ней БИК спектров образцов препарата, выпущенных в гражданский оборот.
Несомненным преимуществом БИК-спектрометрии является возможность выполнения испытания препарата через полимерную часть блистера без разрушения упаковки и самого препарата. Экспрессность выполняемого измерения исключает тепловое деструктивное воздействие на образец, поэтому после завершения испытания при положительном результате аутентификации его возвращают в гражданский оборот. Для реализации аутентификации лекарственных препаратов на территории Российской Федерации создается база БИК-спектральных моделей для выездного и стационарного контроля.
Необходимо отметить, что указанный подход моделирования одновременно позволяет контролировать однородность и стабильность состава лекарственного препарата [12], по этому его применяют на фармацевтических предприятиях для верификации выпускаемой продукции перед упаковкой [13–14].
Цель работы
Цель настоящей работы – показать способ построения математической модели для аутентификации таблетированных лекарственных препаратов неразрушающим экспресс-методом БИК-спектрометрии для своевременного выявления некачественных и фальсифицированных образцов лекарственных средств.
Объекты и методы исследования
ИК спектры в ближней области (БИК спектры) были получены на ИК Фурье спектрометре MPA фирмы «Брукер» (Германия) с помощью оптоволоконного датчика методом диффузного отражения. Разрешение – 8 см-1, количество сканов – 16, область измерения – от 12 500 см-1 до 4000 см-1, фазовое разрешение – 32, интерполяция – 2, базовая линия – по эталону из тефлона.
Построение и валидация модели осуществлялась с помощью подпрограммы «Ident» из программного обеспечения «Opus 7.2» фирмы «Брукер» (Германия). В качестве объекта исследования был выбран препарат, содержащий в качестве действующего вещества дезлоратадин, широко используемый для купирования аллергических реакций. Построение модели осуществляли на образцах препарата с дозировкой дезлоратадина 5 мг в форме таблеток, покрытых пленочной оболочкой, упакованных в контурную ячейковую упаковку из поливинилхлорида и алюминиевой фольги (первичная упаковка) и картонную пачку (вторичная упаковка). Образцы были предоставлены производителем (П1) в количестве 5 серий по 20 таблеток каждая без нарушения первичной упаковки.
Из предоставленных образцов рандомизированным способом были выбраны 12 таблеток: 10 – для построения модели и внутренней валидации, 2 – для ее внешней валидации. Для каждой таблетки были получены по 3 БИК спектра с плотным прижатием датчика к таблетке через прозрачную часть первичной упаковки и с отрывом датчика от поверхности таблетки между измерениями. Таким образом, для построения модели было использовано 150 спектров, для внешней валидации – 30 спектров.
Для валидации модели были использованы БИК спектры образцов препаратовдженериков, также содержащих в качестве действующего вещества дезлоратадин в той же дозировке и в такой же упаковке, но других производителей:
- Пк (4 серии, 120 спектров);
- Пв (5 серий, 150 спектров);
- Пт (5 серий, 150 спектров);
- Пн (3 серии, 90 серий);
- По (5 серий, 150 серий).
Все образцы были предоставлены производителями.
Спектры полимерной части блистерной упаковки – поливинихлорида (ПВХ) – были получены в трех повторах для каждой серии препарата: датчик плотно прижимали между ячейками к полимерной части, соприкасающейся с алюминиевой фольгой, и отрывали его от поверхности между измерениями.
В работе были использованы субстанции дезлоратадина разных производителей3. Для получения спектра субстанций датчик опускали непосредственно во флакон с субстанцией и получали спектры в трех повторах для каждого образца. Часто в БИК спектрах образцов лекарственных средств проявляется присутствующая в них вода. Для получения спектра воды каплю помещали на предметное стекло на металлической фольге, датчик опускали в каплю и плотно прижимали к поверхности стекла, чтобы уменьшить толщину слоя. В этом случае для получения базовой линии датчик прижимали к тому же предметному стеклу на алюминиевой фольге, но без воды.
Результаты и обсуждение
Математическое моделирование лекарственного препарата по БИК спектрам осуществлялось в три этапа:
1) получение и предобработка спектров;
2) построение модели;
3) проверка работоспособности модели с помощью валидации.
Ключевой позицией в моделировании является построение и валидация математической модели, максимально адекватной составу образцов лекарственного препарата, учитывающей особенности технологии производства и отличающей «чужие образцы». Для построения модели с целью доказательства того, что образец является подлинным или аутентичным, как правило, используются классификационные методы математического моделирования, в которых требуется установить принадлежность образца к классу. По способу построения классификационные методы делятся на одноклассовые и дискриминантные [15].
Основной задачей методов одноклассовой классификации является формирование группы объектов в соответствии с их свойствами, т.е. целевого класса, при этом каждый целевой класс формируется или моделируется независимо от остальных. Дискриминантные методы используются для анализа нескольких групп объектов с построением границ, разделяющих заданные группы/классы. С учетом поставленной цели и используемого оборудования в данном исследовании аутентификационная модель препарата была построена методом одноклассовой классификации с вычислением среднего спектра и порогового значения (DT), которое представляет собой сумму расстояния максимально удаленной точки спектров образцов целевого класса от среднего значения спектра (Dmax) и произведения коэффициента (х) на стандартное отклонение (S0):
DT = Dmax + хS0
По умолчанию коэффициент х имеет значение 0,25, но может быть изменен в любую сторону от 0 до 1. Путем варьирования его значения можно расширить или сузить границы модели с целью ее оптимизации.
Стандартный набор предобработок спектров включает совмещение, определение рабочего спектрального диапазона и векторную нормализацию. С целью оптимизации модели могут быть использованы первая и вторая производные.
Совмещение спектров используется для устранения смещения спектра по волновой шкале, связанного с погрешностью используемых приборов одной линейки. В этом случае все полученные спектры совмещаются с выбранным условно стандартным спектром, полученным на одном из приборов, что в дальнейшем позволяет использовать построенную модель на других приборах той же линейки.
Векторная нормализация необходима для компенсации погрешности измерения, в результате которой полученные спектры одного и того же образца могут иметь, например, разную высоту полос (за счет изменения оптического пути, угла наклона из-за специфической формы испытуемого объекта и т.д.) и вносить в модель ненужную информацию. На результат векторной нормализации в значительной степени оказывает влияние рабочий спектральный диапазон.
Определение рабочего спектрального диапазона проводили визуально путем анализа и выявления тех областей спектра, в которых проявляются пики действующего и вспомогательных веществ. Основная цель – определение спектрального диапазона или набора спектральных диапазонов для построения модели.
Визуальный анализ среднего БИК спектра образца показал, что полосы действующего вещества дезлоратадина проявляются в спектре исследуемых таблеток четырьмя малоинтенсивными полосами при волновых числах 9517, 9450, 6496 и 6451 см-1. Кроме этого, незначительные полосы дезлоратадина можно видеть при волновых числах 4748 и 4621 см-1. Три полосы ПВХ блистера видны в спектре образца при волновых числах 5824, 4337 и 4210 см-1, причем наиболее интенсивными являются две последние полосы. Вода имеет две широкие полосы в областях 7241-6387 см-1 и 5300 до 4950 см-1 с максимумами при волновых числах 6862 см-1 и 5148 см-1. Все результаты представлены на рисунке 1.
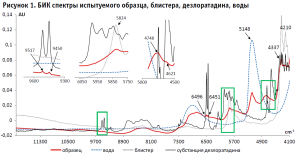
Из вспомогательных веществ, входящих в состав исследуемого препарата, были изучены те, которые присутствуют в наибольшем количестве: гипромеллоза (основной компонент оболочки), целлюлоза микрокристаллическая (МКЦ) и кальция гидрофосфат (основные компоненты ядра). На рисунке 2 можно видеть, что в длинноволновой области спектра от 12 000 см-1 до 9000 см-1 они не имеют характеристических полос.
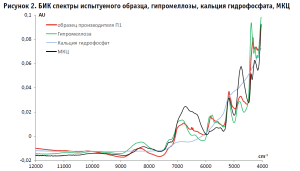
Таким образом, для построения моделей были выбраны три варианта рабочего спектрального дипазона:
1) 9600-4400 см-1;
2) 9600-5300 см-1 и 4950-4400 см-1;
3) 9600-6000 см-1.
В рабочих диапазонах всех моделей удалена малоинформативная область от 12 000 см-1 до 9600 см-1. В диапазонах первой и второй модели удалена область от 4400 см-1 до 4000 см-1, где наблюдаются нестабильные результаты и присутствуют два интенсивных пика блистера, во второй модели дополнительно исключена область основного пика воды от 5300 см-1 до 4950 см-1. В диапазоне третьей модели удалены области нестабильных результатов, основной полосы воды и полос ПВХ блистера (6000-4000 см-1).
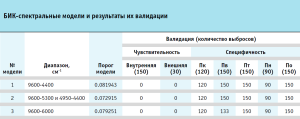
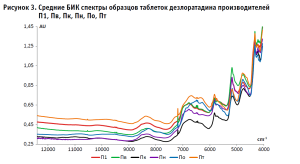
В соответствии с требованиями ОФС.1.2.1.1.0001.15 «Спектрометрия в ближней инфракрасной области»4, модель, построенная методом одноклассовой классификации, валидировалась на чувствительность (степень принятия образцов целевого класса) и специфичность (степень отклонения «чужих образцов», т.е. не принадлежащих к целевому классу). На основании результатов валидации проводится оптимизация границ области одноклассовой модели. Валидацию на чувствительность модели проводили на спектрах десяти таблеток, которые были использованы для построения модели (внутренняя валидация) и спектрах двух таблеток, которые не вошли в модель (внешняя валидация). Для оценки модели на специфичность были использованы спектры образцов препаратов-дженериков производства Пк (4 серии или 120 спектров), Пв (5 серий или 150 спектров), Пт (5 серий или 150 спектров), Пн (3 серии или 90 спектров) и По (5 серий или 150 спектров) в такой же упаковке. Средние БИК спектры образцов представлены на рисунке 3.
В основе сравнения испытуемого образца и модели лежит стандартный метод вычисления спектрального расстояния (D) между полученным спектром (a) со средним спектром модели (b) путем вычисления Евклидового расстояния по всем точкам спектрального диапазона модели (k): В случае аутентичности исследуемого образца его спектральное расстояние (D) не должно превышать порогового значения модели (DT).
Результаты валидации полученных моделей представлены в таблице. Полученные результаты показывают, что наименьшее пороговое значение имеет вторая модель, что свидетельствует о ее компактности. По чувствительности все три модели принимают образцы внутреннего и внешнего набора как «свои». По специфичности первая и вторая модели отвергают спектры образцов пяти других производителей, а третья модель из 150 спектров образцов препарата производителя Пв отвергает 133 и принимает за свои 17 спектров (11,3 %). Очевидно, что область от 6000 см-1 до 5300 см-1, удаленная из третьей модели, содержит важную информацию о препарате и необходима для построения модели.
Conclusion.
На примере таблеток дезлоратадина показана процедура построения и валидации модели для аутентификации лекарственных препаратов в таблетированной форме. В результате проведенного исследования построена одноклассовая модель для неразрушающего метода аутентификации таблеток дезлоратадина дозировкой 5 мг в ячейковой контурной упаковке из ПВХ и алюминиевой фольги. Установлено, что оптимальным спектральным диапазоном для данной модели являются области от 9600 см-1 до 5300 см-1 и от 4950 см-1 до 4400 см-1. Для построения модели в качестве предобработки спектров были использованы совмещение и векторная нормализация.
______________________________________________________________________
1 ОФС.1.2.1.1.0001.15 Спектрометрия в ближней инфракрасной области. Государственная фармакопея Российской Федерации, XIV издание. Утверждена приказом Минздрава России от 31.10.2018 № 749 «Об утверждении общих фармакопейных статей и фармакопейных статей и признании утратившими силу некоторых приказов Минздравмедпрома России, Минздравсоцразвития России и Минздрава России», действует с 01.12.2018. URL: http://pharmacopeia.ru/
2 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». URL:https://base.garant.ru/12174909/ (дата обращения 08.07.2022).
3 Для ознакомления со списком производителей необходимо обратиться в редакцию.
4 ОФС.1.2.1.1.0001.15 Спектрометрия в ближней инфракрасной области. Государственная фармакопея Российской Федерации, XIV издание. Утверждена приказом Минздрава России от 31.10.2018 № 749 «Об утверждении общих фармакопейных статей и фармакопейных статей и признании утратившими силу некоторых приказов Минздравмедпрома России, Минздравсоцразвития России и Минздрава России», действует с 01.12.2018. URL: http://pharmacopeia.ru/
- Titova A.V. Authentication of medicines using NIR-spectroscopy exemplified by "enterodez" analysis / A.V. Titova, O.E. Rodionova, K.S. Balyklova, E.G. Skudareva, N.P. Sadchikova // Vestnik Roszdravnadzora. – 2017; 5: 46–54 (in Russian).
- Kester Q.-A. Pharmaceutical Verification and Information System for Authentication of Registered Drugs [Electronic Resource] / Q.-A. Kester, P.A. Owusu, D. Caulcrick-Odebo, S. Hatsu // International Journal of Emerging Research in Management and Technology. – 2015; 4(3): 6–14. – Access mode: https://www.researchgate.net/publication/275771827_Pharmaceutical_Verification_and_Information_System_for_Authentication_of_Registered_drugs (date of request: 08.07.2022).
- Naughton B. Effectiveness of medicines authentication technology to detect counterfeit, recalled and expired medicines: a two-stage quantitative secondary care study [Electronic Resource] / B. Naughton, L. Roberts, S. Dopson, S. Chapman, D. Brindley // BMJ Open. – 2016; 6(12): e013837. DOI: 10.1136/bmjopen-2016-013837. – Access mode: https://pubmed.ncbi.nlm.nih.gov/27940634/ (date of request: 08.07.2022).
- Assi S. Authentication of Antibiotics Using Portable Near-Infrared Spectroscopy and Multivariate Data Analysis [Electronic Resource] / S. Assi, B. Arafat, Kathryn Lawson-Wood, I. Robertson // Applied Spectroscopy. – 2021; 75(4): 434–444. DOI: 10.1177/0003702820958081. – Access mode: https://www.researchgate.net/publication/343845424_EXPRESS_Authentication_of_Antibiotics_Using_Portable_Near-Infrared_Spectroscopy_and_Multivariate_Data_Analysis (date of request: 08.07.2022).
- De` gardin K. Near Infrared spectroscopy for counterfeit detection using a large database of pharmaceutical tablets [Electronic Resource] / K. De` gardin, A. Guillemain, N.V. Guerreiro, Y. Roggo // Journal of Pharmaceutical and Biomedical Analysis. – 2016; 128: 89–97. DOI: 10.1016/j.jpba.2016.05.004. – Access mode: https://www.researchgate.net/publication/302058412_Near_Infrared_spectroscopy_for_counterfeit_detection_using_a_large_database_of_pharmaceutical_tablets (date of request: 08.07.2022).
- Krakowska B. Chemometrics and the identification of counterfeit medicines – A review [Electronic Resource] / B. Krakowska, D. Custers, E. Deconinck, M. Daszykowski // Journal of Pharmaceutical and Biomedical Analysis. – 2016; 127: 112–122. DOI: 10.1016/j.jpba.2016.04.016. – Access mode: https://pubmed.ncbi.nlm.nih.gov/27133184/ (date of request: 08.07.2022).
- Holma R. Analytical advances in pharmaceutical impurity profiling [Electronic Resource] / R. Holma, D.P. Elderb // European Journal of Pharmaceutical Sciences. – 2016; 87: 118–135. DOI: 10.1016/j.ejps.2015.12.007. – Access mode: https://pubmed.ncbi.nlm.nih.gov/26690047/ (date of request: 08.07.2022).
- Rodionova O.Ye. Detection of counterfeit and substandard tablets using non-invasive nir and chemometrics – a conceptual framework for a big screening system [Electronic Resource] / O.Ye. Rodionova, A.V. Titova, K.S. Balyklova, A.L. Pomerantsev // Talanta. – 2019; 205: 120150. DOI: 10.1016/j.talanta.2019.120150. – Access mode: https://pubmed.ncbi.nlm.nih.gov/31450403/ (date of request: 08.07.2022).
- Rodionova O.Ye. Qualitative and quantitative analysis of counterfeit fluconazole capsules: A non-invasive approach using NIR spectroscopy and chemometrics [Electronic Resource] / O.Y. Rodionova, A.V. Titova, N.A. Demkin, K.S. Balyklova, A.L. Pomerantsev // Talanta. – 2019; 195: 662–667. DOI: 10.1016/j.talanta.2018.11.088. – Access mode: https://pubmed.ncbi.nlm.nih.gov/30625598/ (date of request: 08.07.2022).
- Chen H. Express detection of expired drugs based on near-infrared spectroscopy and chemometrics: A feasibility study [Electronic Resource] / H. Chen, C. Tan, Z. Lin // Spectrochimica acta. Part A: Molecular and biomolecular spectroscopy. – 2019; 220: 117153. DOI:10.1016/j.saa.2019.117153. – Access mode: https://pubmed.ncbi.nlm.nih.gov/31141774/ (date of request: 08.07.2022).
- Hattori Y. Rapid identification of oral solid dosage forms of counterfeit pharmaceuticals by discrimination using nearinfrared spectroscopy [Electronic Resource] / Y. Hattori, Y. Seko, J. Peerapattana, K. Otsuka, T. Sakamoto, M. Otsuka // Bio-Medical Materials and Engineering. – 2018; 29(1): 1–14. DOI: 10.3233/BME-171708. – Access mode: https://pubmed.ncbi.nlm.nih.gov/29254069/ (date of request: 08.07.2022).
- Titova A.V. Control of the medicines composition uniformity in the pharmaceutical market / A.V. Titova, O.E. Rodionova, K.S. Balyklova // Vestnik Roszdravnadzora. – 2018; 4: 59–65 (in Russian).
- Kim E.J. Process analytical technology tools for monitoring pharmaceutical unit operations: a control strategy for continuous process verification [Electronic Resource] / Eun Ji Kim, Ji Hyeon Kim, Min-Soo Kim, S. Jeong, D. Choi // Pharmaceutics. – 2021; 13(6): 919. DOI: 10.3390/pharmaceutics13060919. – Access mode: https://www.mdpi.com/1999-4923/13/6/919 (date of request: 08.07.2022).
- Gosselin R. NIR inspection of each tablet that exits a tablet press verification [Electronic Resource] / R. Gosselin, A. Cournoyer, J.-M. Guay, A. Langlet, H. Dalvi // European Pharmaceutical Review. – 2018. – Access mode: https://www.europeanpharmaceuticalreview.com/article/80745/nir-tablets/ (date of request: 08.07.2022).
- Rodionova O.Ye. Discriminant analysis is an inappropriate method of authentication [Electronic Resource] / O.Ye. Rodionova, A.V. Titova, A.L. Pomerantsev // Trends in Analytical Chemistry. – 2016; 78: 17–22. DOI: 10.1016/j.trac.2016.01.010. – Access mode: https://www.researchgate.net/publication/292342854_Discriminant_analysis_is_an_inappropriate_method_of_authentication (date of request: 08.07.2022).
