DRUG PROVISION
Conducting an internal audit of the turnover of narcotic drugs and psychotropic substances in medical organizations as an important component of ensuring the quality of medical care
1 — Federal State Budgetary Educational Institution of Higher Education “Krasnoyarsk State Medical University named after Professor V.F. Voino-Yasenetsky” of the Ministry of Health of the Russian Federation, building 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation.
ORCID: https: //orcid.org/0000-0002-9126-7610
2 — Federal State Budgetary Educational Institution of Higher Education «Perm State Pharmaceutical Academy» of the Ministry of Health of the Russian Federation, 2, Polevaya str., Perm, 614990, Russian Federation.
ORCID: https: //orcid.org/0000-0002-2745-7698
3 — Тerritorial office of the Federal Service for Healthcare Supervision in the Krasnoyarsk Territory, 132, Mira Ave., Krasnoyarsk, 660021, Russian Federation.
4 — Тerritorial office of the Federal Service for Healthcare Supervision in the Krasnoyarsk Territory, 132, Mira Ave., Krasnoyarsk, 660021, Russian Federation.
An important element in ensuring the quality of health care at the current stage of development of the health system is the organization of internal control of drug handling. The article considers the issues of conducting internal audit of drug (HC) and psychotropic substances (TS) in medical organizations.
The authors emphasize the need to develop special checklists for conducting internal control activities of treatment of NC and AB in medical organizations, and also offer recommendations on the structure and content of such checklists for the development of local documents.
The study aims to improve the quality control system of medical care and ensure the safe use of narcotic drugs and psychotropic drugs in medical organizations.
Keywords: quality control of medical care, internal audit of medical organizations, checklists, trafficking in narcotic and psychotropic drugs, control of drug trafficking and psychotropic substances
Background.
Проблемы обеспечения доступности и качества медицинской помощи являются актуальными в современном мире и требуют комплексного подхода для их решения. Законодательством Российской Федерации (РФ), регламентирующим вопросы здравоохранения, закреплены правовые, экономические и организационные основы охраны здоровья граждан, при этом одним из важных элементов обеспечения качества медицинской помощи определены мероприятия по организации государственного, ведомственного и внутреннего контроля в данной сфере1.
Медицинская помощь тесно взаимосвязана с вопросами использования лекарственных препаратов, поэтому внутренний контроль качества и безопасности медицинской деятельности, проводимый на уровне медицинской организации (МО), предусматривает оценку мероприятий по организации безопасного применения лекарственных препаратов (ЛП) и оценку мероприятий по облегчению боли, в том числе с использованием ЛП, содержащих наркотические средства (НС) и психотропные вещества (ПВ), которые требуют соблюдения особых условий при их обращении в МО.
Несмотря на многочисленные изменения нормативных документов, направленные на повышение доступности контролируемых лекарственных средств (ЛС) и упрощение отдельных видов оборота, использование НС и ПВ все еще вызывает трудности в практическом здравоохранении, что отмечено Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор)2.
Для обеспечения контроля за исполнением законодательства о НС и ПВ целесообразно в МО предусмотреть проведение внутреннего аудита деятельности, связанной с обращением наркотических и психотропных лекарственных препаратов (НПЛП).
Данный вид контроля позволит сотрудникам МО при проведении внутренних проверок своевременно выявлять нарушения норм законодательства и проводить корректирующие мероприятия по их устранению.
Цель исследования
Разработка структуры и содержания проверочных листов для проведения внутреннего аудита оборота НПЛП в МО, содержащих ссылки на соответствующие пункты нормативных правовых актов и рекомендации по корректирующим мероприятиям.
Материалы и методы
Проведен анализ нормативных документов, регламентирующих порядок контроля качества и безопасности медицинской деятельности, а также требования к обороту с НС и ПВ в медицинских организациях. Для обработки данных применялся системный подход, включающий контент-анализ материалов и метод группировок.
Результаты и обсуждение
Проводимая в России с 2017 года реформа контрольно-надзорной деятельности в сфере здравоохранения внесла значительные изменения в регламенты проведения контрольно-надзорных мероприятий государственными органами, способствовала актуализации и сокращению количества требований, предъявляемых к различным видам деятельности, содействовала внедрению риск-ориентированного подхода и реализации системы профилактики нарушений3.
Основными целями данной реформы является снижение административных и финансовых нагрузок при осуществлении контроля в сфере обращения лекарственных средств в МО, а также рост качества администрирования контрольно-надзорных функций. Контроль в сфере здравоохранения предусматривает не только совершенствование государственного контроля (внешнего), но и расширяет спектр мероприятий, проводимых в рамках внутреннего контроля качества и безопасности медицинской помощи [1].
Использование риск-ориентированного подхода к государственному контролю (надзору) за осуществлением медицинской и фармацевтической деятельности позволило успешно реализовать данные цели благодаря дифференцированному подходу к объектам контроля (медицинским и аптечным организациям) и разделением их на категории риска причинения вреда. Риск-ориентированный подход законодательно закреплен для следующих видов контроля:
- государственный контроль качества и безопасности медицинской деятельности4;
- федеральный государственный надзор в сфере обращения лекарственных средств5;
- государственный контроль за обращением медицинских изделий6.
Основным инструментом проведения государственного контроля (надзора) в рамках риск-ориентированного подхода являются проверочные листы, содержащие списки контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований. Формы проверочных листов разработаны Росздравнадзором по различным видам деятельности и могут использоваться МО для внутреннего контроля качества и безопасности медицинской деятельности7,8,9.
Особенность использования НС и ПВ, разрешенных к использованию в медицинских целях, заключается в том, что к обороту указанной категории ЛС предъявляются двойные требования: во-первых, требования к выполнению работ с НС и ПВ, которые предусмотрены лицензией на осуществление деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений, а, во-вторых, на НПЛП распространяется действие законодательства об обращении ЛС10.
Контроль за обращением НПЛП в МО осуществляется Росздравнадзором при проверке соответствия соискателя лицензии или лицензиата лицензионным требованиям с использованием оценочного листа, который содержит 18 контрольных вопросов общего характера со ссылкой на пункты нормативных актов, в соответствии с положением о лицензировании деятельности по обороту НС и ПВ11. К сожалению, вопросы данного оценочного листа охватывают не все требования, обязательные к исполнению, и при использовании для внутреннего контроля в МО не могут в полной мере отразить все аспекты работы с НПЛП.
Для проверки соблюдения требований по обращению НС и ПВ, наряду с проведением государственного контроля (надзора), большое значение придается самостоятельному внутреннему контролю в МО, порядок проведения которого регламентирован приказом Минздрава России от 31.07.2020 № 785н12. В соответствии с нормативными документами в МО предусмотрена необходимость проведения плановых и целевых (внеплановых) проверок. В рамках внутренних проверок должна проводится оценка мероприятий по организации безопасного применения ЛП, включающая контроль сроков годности ЛП; контроль хранения ЛП, требующих особых условий хранения; контроль хранения ЛП в специально оборудованных помещениях и (или) зонах для хранения, а также оценка осуществления мероприятий по облегчению боли, в том числе связанных с использованием НПЛП. По итогам проведенных мероприятий внутреннего контроля формируется отчет, включающий выработку мероприятий по устранению выявленных нарушений и улучшения деятельности МО.
Наряду с этим, приказом Минздрава России от 29.04.2025 № 260н установлена необходимость организации системы обеспечения качества хранения ЛС, в том числе и в МО13. Руководитель субъекта обращения ЛС должен назначить лицо, ответственное за внедрение и обеспечение системы качества, осуществляющее мониторинг эффективности системы качества (включающий проведение внутренних плановых аудитов), а также, с целью устранения выявленных нарушений, разработать корректирующие действия (с указанием сроков и ответственных лиц).
При проведении внутреннего контроля рекомендуется брать за основу формы проверочных листов, разработанных Росздравнадзором (при наличии), однако специфика проведения внутреннего контроля и оформления его результатов актуализирует необходимость разработки рекомендательных внутренних документов для самоконтроля, которые будут интерпретировать требования многочисленных нормативно-правовых актов в точные формулировки и позволят своевременно проводить мероприятия по профилактике или корректировке выявленных нарушений.
С учетом имеющихся в лицензии МО видов работ и услуг, составляющих деятельность по обороту НС и ПВ, обязательных условий, регламентированных ст. 57, ч. 3 ст. 58, ч. 3 ст. 58.1, ч. 7 ст. 59 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»; п. 1 ст. 8, п. 1, п. 2, п.3 ст. 10, п. 1, п. 2 ст. 20, п. 2, п.3 ст. 21, ст. 23, ст. 24, ст.29, п.1 ст. 31, п.1 ст. 37, п. 1, п. 2 ст. 38, ст. 39 Федерального Закона от 08.01.1998 № 3-ФЗ «О наркотических средствах и психотропных веществах», а также требованиями подпунктов б, в, г, з, и, к, т, х, ц, э, ю, пункта 6 постановления Правительства РФ (ПП РФ) от 02.06.2022 № 1007 «О лицензировании деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений», нами разработаны следующие примерные формы проверочных листов для проведения внутренних проверок (аудита):
- проверка соблюдения требований к персоналу, выполняющему работы с НС и ПВ (табл. 1);
- проверка соблюдения требований к приобретению и хранению НС и ПВ (табл. 2);
- проверка соблюдения требований к перевозке НС и ПВ (табл. 3);
- проверка соблюдения требований к отпуску и использованию НС и ПВ (табл. 4);
- проверка соблюдения требований к уничтожению НС и ПВ (табл. 5);
- проверка соблюдения требований по учету и формированию отчетности при работе с НС и ПВ (табл. 6).
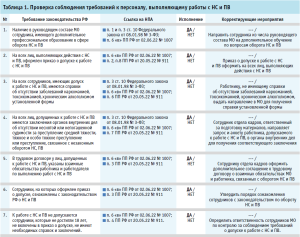

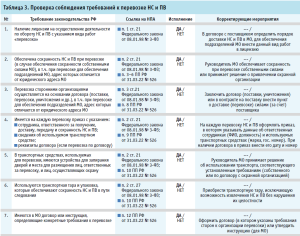

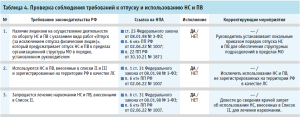
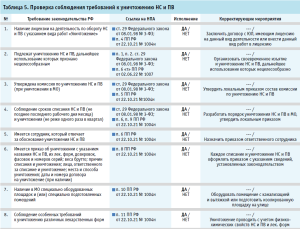

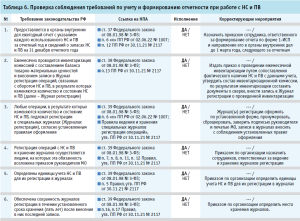
Представленные рекомендуемые формы проверочных листов содержат минимальные требования, они могут быть индивидуально скорректированы, дополнены иными вопросами действующих нормативных правовых актов и утверждены в МО как стандартная операционная процедура для регулярного выполнения мероприятий по внутреннему контролю качества оказания медицинской помощи.
Руководитель МО внутренним документом (приказом) утверждает проверочные листы, вопросы в которых адаптированы под условия конкретной МО, устанавливает оптимальную периодичность аудита (не реже одного раза в год), определяет состав комиссии по проведению внутреннего контроля и назначает сотрудника, ответственного за проведение проверок и анализ их результатов.
Conclusion.
Актуальность проведения внутреннего аудита в МО обоснована нормативными актами в сфере охраны здоровья граждан с учетом особенностей обращения НПЛП. Установлена необходимость разработки рекомендаций руководителям МО, включающих не только предоставление информации о нормативно-правовых актах, которые содержат обязательные требования к обороту НС и ПВ, зарегистрированных в качестве ЛС, но и по разработке примерных форм проверочных листов с интерпретацией отдельных пунктов нормативных документов, которые позволят ответственным сотрудникам МО самостоятельно проводить внутренний контроль, используя конкретные вопросы, анализировать процессы оборота НС и ПВ, своевременно разрабатывать и внедрять в работу МО предупредительные или корректирующие мероприятия, направленные на соблюдение лицензионных требований и условий.
______________________________________________________________________
1 Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (ред. от 07.06.2025). – URL: https://internet.garant.ru/#/document/12191967.
2 Доклад о контроле за оборотом наркотических средств, психотропных веществ и их прекурсоров, культивированием наркосодержащих растений по итогам 2024 года. – URL: https://roszdravnadzor.gov.ru/documents/86331.
3 Паспорт приоритетного проекта «Совершенствование контрольной и надзорной деятельности в сфере здравоохранения» (утв. протоколом заседания проектного комитета от 21 февраля 2017 г. № 13(2)). – URL: https://internet.garant.ru/#/document/71886578/
4 Постановление Правительства РФ от 29.06.2021 № 1048 «Об утверждении Положения о федеральном государственном контроле (надзоре) качества и безопасности медицинской деятельности» (ред. от 30.11.2021). – URL: https://internet.garant.ru/#/document/401422536/
5 Постановление Правительства РФ от 29.06.2021 № 1049 «О федеральном государственном контроле (надзоре) в сфере обращения лекарственных средств» (ред. от 06.11.2024). – URL: https://internet.garant.ru/#/document/401423374/
6 Постановление Правительства РФ от 30.06.2021 № 1066 «О федеральном государственном контроле (надзоре) за обращением медицинских изделий» (ред. от 07.12.2021). – URL: https://internet.garant.ru/#/document/401422556/
7 Приказ Федеральной службы по надзору в сфере здравоохранения от 11.02.2022 № 973 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) качества и безопасности медицинской деятельности». – URL: https://internet.garant.ru/#/document/403583260/
8 Приказ Федеральной службы по надзору в сфере здравоохранения от 16.09.2022 № 8700 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств». – URL: https://internet.garant.ru/#/document/405967643/
9 Приказ Федеральной службы по надзору в сфере здравоохранения от 10.01.2022 № 1 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий». – URL: https://internet.garant.ru/#/document/403561642/
10 Федеральный закон от 08.01.1998 № 3-ФЗ «О наркотических средствах и психотропных веществах» (ред. от 08.08.2024). – URL: https://internet.garant.ru/#/document/12107402/.
11 Приказ Федеральной службы по надзору в сфере здравоохранения от 26.08.2022 № 7973 «Об утверждении формы оценочного листа, в соответствии с которым Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при осуществлении деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений» URL: https://internet.garant.ru/#/document/405761787/
12 Приказ Министерства здравоохранения Российской Федерации от 31.07.2020 № 785н «Об утверждении Требований к организации и проведению внутреннего контроля качества и безопасности медицинской деятельности». – URL: https://internet.garant.ru/#/document/74710282/
13 Приказ Министерства здравоохранения Российской Федерации от 29.04.2025 № 260н «Об утверждении правил хранения лекарственных средств для медицинского применения» (вступает в силу с 01.09.2025). – URL: https://internet.garant.ru/#/document/412109870/
1. Piven D.V., Kitsul I.S., Ivanov I.V. Reform of control and supervision activities and inspection of medical organizations: myths and reality. Menedzher zdravookhraneniya. 2024; 3. – URL: https://cyberleninka.ru/article/n/reforma-kontrolno-nadzornoy-deyatelnosti-i-proverkimeditsinskih-organizatsiy-mify-i-realnost (дата обращения: 27.06.2025) (in Russian).
