INFORMATION TECHNOLOGY AND DIGITALIZATION OF HEALTHCARE
The use of information technologies in the state control of the quality of medicines in federal laboratory complexes
1 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
2 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
The article reflects aspects of the practical use of information technology as a tool to accompany the examination of the quality of medicines in the Federal State Budgetary Institution “Information and Methodological Center for Examination, Accounting and Analysis of Circulation of Medical Products” of the Federal Service for Surveillance in Healthcare.
Keywords: drug quality monitoring, integrated information laboratory system, unified information space, infrastructure, functionality of the information laboratory system
Background.
Согласно первому пункту Перечня поручений Председателя Правительства Российской Федерации М.В. Мишустина по итогам конференции «Цифровая индустрия промышленной России» от 16 июня 2022 года одной из важнейших задач по повышению устойчивости российской экономики в условиях санкционного давления является формирование индустриальных центров компетенций по замещению зарубежных отраслевых цифровых продуктов и решений, включая программно-аппаратные комплексы, в ключевых отраслях экономики.
Факт создания таких индустриальных центров компетенций подчеркивает осознанную необходимость государства проводить масштабные изменения в области IT-инфраструктуры и замещать иностранные программные решения отечественными разработками.
Одним из типов программ, которые вызывают большой интерес как у производителей лекарственных средств, так и у аналитических лабораторий различных форм собственности, является информационная система управления лабораторией (далее – LIMS, сокр. от англ. Laboratory Information Management System).
Большинство имеющихся программ постулирует универсальность применения для любых испытательных лабораторий, что действительно подтверждается общностью бизнес-процессов, реализованных во всех лабораториях, аккредитованных в соответствии с законодательством Российской Федерации об аккредитации в национальной системе аккредитации или проведших независимую аттестацию на соответствие требованиям ГОСТ ISO/IEC 17025-2019. «Межгосударственный стандарт. Общие требования к компетентности испытательных и калибровочных лабораторий». Однако при фактической оценке применимости таких программ к деятельности лабораторных комплексов Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (далее – ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, учреждение) можно отметить, что некоторые особенности, присущие рынку обращения лекарственных средств (например, использование большого количества различных нормативных документов, регламентирующих требования к качеству аналогичных испытуемых образцов; применение стандартных образцов, имеющих особенности утверждения и использования; использование методик Государственной Фармакопеи и т.д.) не находят прямого отражения в доступных системах и требуют доработки программного обеспечения.
В то же время рынок LIMS, предназначенных непосредственно для фармацевтического рынка, был представлен в основном иностранными решениями, использование которых в настоящее время затруднено или не рекомендуется, а в рамках исполнения приказа Минкомсвязи России от 01.04.2015 № 96 «Об утверждении плана импортозамещения программного обеспечения» зарубежное программное обеспечение не может быть использовано в государственных учреждениях.
Единая информационная лабораторная система: цели и задачи
Основным направлением деятельности ФГБУ «ИМЦЭУАОСМП» Росздравнадзора является проведение экспертизы качества лекарственных средств, находящихся в гражданском обороте на территории Российской Федерации. Учреждение ежегодно проверяет до 37 тыс. серий лекарственных средств в рамках государственного контроля (надзора) в соответствии с положениями Федерального закона от 31.07.2020 № 248-ФЗ «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации».
Высокотехнологичные лабораторные комплексы ФГБУ «ИМЦЭУАОСМП» Росздравнадзора функционируют во всех федеральных округах, в городах Москве, СанктПетербурге, Гудермесе, Ростове-на-Дону, Хабаровске, Екатеринбурге, Красноярске, Казани, Курске, Ставрополе, Тамбове, Симферополе, Ярославле. Федеральные лабораторные комплексы работают на единой методологической основе и по единым стандартам.
В связи с интенсивным развитием ФГБУ «ИМЦЭУАОСМП» Росздравнадзора крайне важными стали задачи по оперативному управлению огромным потоком информации в режиме «реального времени», автоматизированному сбору статистической и управленческой отчетности, срочному получению информации о результатах проведения испытаний качества лекарственных средств.
Таким образом, появилась острая потребность внедрения единой информационной лабораторной системы (далее – лабораторная система, ИИЛС, система, информационная система), удовлетворяющей потребностям всего учреждения. Информационная лабораторная система должна была обеспечить автоматизацию процессов учреждения с учетом индивидуальных особенностей каждой лаборатории, создать единое информационное пространство сети федеральных лабораторных комплексов. Первым шагом для разработки системы стало утверждение в 2017 году стратегии развития ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, где наряду с подготовкой квалифицированных специалистов в области контроля качества лекарственных средств и внедрения новых методов испытаний с использованием высокотехнологического аналитического оборудования, была принята концепция разработки единого программного обеспечения для сопровождения экспертизы качества лекарственных средств на территории Российской Федерации.
В течение 18 месяцев (2018–2019 гг.) были проведены работы по разработке «с нуля» Интегрированной информационной лабораторной системы и ее внедрению в подразделениях ФГБУ «ИМЦЭУАОСМП» Росздравнадзора. На сегодняшний день лабораторная система введена в промышленную эксплуатацию, в ней ежедневно работает более 500 пользователей, что позволяет констатировать факт успешного выполнения поставленной задачи. При разработке информационной лабораторной системы были поставлены следующие задачи:
1) создание единого информационного пространства ФГБУ «ИМЦЭУАОСМП» Росздравнадзора;
2) получение оперативных данных о качестве лекарственных средств в целях выполнения государственного задания и внебюджетной деятельности в режиме «реального времени»;
3) формирование централизованной единой базы данных и нормативно-справочной информации;
4) стандартизация, унификация и оптимизация бизнес-процессов федеральных лабораторных комплексов;
5) обеспечение автоматической прослеживаемости жизненного цикла образца за счет внедрения штрих-кодирования;
6) контроль выполнения государственного задания;
7) управление испытаниями в режиме «реального времени»;
8) мониторинг состояния и управления оборудованием;
9) сбор аналитической и управленческой отчетности.
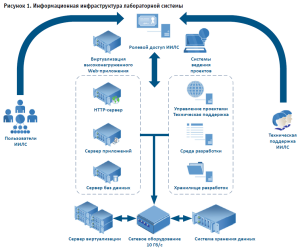
Оптимальным решением была признана самостоятельная российская разработка программы, учитывающей все вышеуказанные особенности, с применением вeб-технологии (онлайн-система типа «тонкий клиент»1). Информационная инфраструктура лабораторной системы, которая представляет высоконагруженное веб-приложение, представлена на рисунке 1. Для работы информационной системы нужен только доступ в интернет и браузер.
Этапы разработки и внедрения
Внедрение программного обеспечения требует привлечения специалистов функциональных бизнес-подразделений и отвлекает их от основной работы, поэтому в целях повышения скорости реализации проекта и достижения конкретных результатов было решено использовать не классическую последовательную схему внедрения – «водопад», а метод «гибкой»2 разработки, подразумевающий выполнение проекта отдельными законченными частями при тесном взаимодействии заказчиков (ими были подразделения) и исполнителя. Классическая последовательная схема внедрения – «водопад» не подходила из-за сжатых сроков разработки и постоянно дополняющихся требований к функционалу системы. Учитывая, что тестирование системы осуществляется после выпуска релизов, такой подход лишает проект гибкости. Метод «гибкой» разработки позволил вовлечь в процесс внедрения лабораторной системы большое количество подразделений, вызвать их интерес, а главное – обеспечить непрерывную коммуникацию с подразделениями. «Гибкая» методология позволила сэкономить время, не тратя его на составление объемной проектной и технической документации. Подразделения могут видеть, какую функциональность лабораторной системы они получают в результате автоматизации процессов и внедрения проекта, и сами активно вовлекаются в процесс разработки [3].
Для построения лабораторной системы был создан уникальный справочник единых нормативных документов (далее – НД) в электронной форме, доступный для специалиста, выполняющего испытания качества лекарственных средств.
Уникальность справочника состоит в том, что данные из НД содержатся в системе в открытом формате и напрямую участвуют в формировании протокола испытания лекарственных средств. Справочник на сегодняшний день включает в себя более 15 000 НД, их можно открыть и при необходимости распечатать с любого персонального компьютера.
Лабораторная система построена с учетом обеспечения безопасности данных:
- Применена ролевая модель (пользователь лабораторной системы получает полномочия по работе только с определенными группами данных). При этом отдельные функциональные полномочия, например, ввод результатов или настройка собственного интерфейса пользователю могут быть предоставлены. Механизм ролей, примененный в лабораторной системе, упрощает работу по настройке безопасности данных и разграничении прав доступа пользователей (рис. 2). В системе настраивается несколько типовых ролей, а затем пользователям назначаются одна или несколько из них.
- Обеспечена поддержка простой и усиленной квалифицированной электронной подписей.
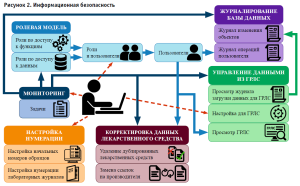
Учитывая имеющиеся требования к работе информационной системы, в рамках решения поставленных задач были реализованы следующие основные функциональные блоки:
1) интеграция с государственными информационными ресурсами;
2) прослеживаемость движения образца;
3) идентификация образца с помощью штрихкода;
4) управление испытаниями и образцами;
5) учет и управление средствами измерения и лабораторным оборудованием;
6) учет и управление персоналом;
7) складской учет (управление расходными материалами и реактивами);
8) модуль «Тренды»;
9) сбор статистической и управленческой отчетности.
Интеграция с информационным ресурсом «Государственный реестр лекарственных средств»
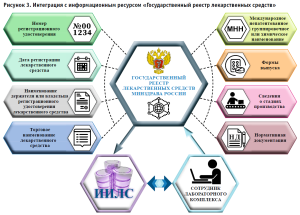
В настоящий момент информационная система интегрирована с информационным ресурсом «Государственный реестр лекарственных средств» (далее – ГРЛС), который позволяет получать справочные данные по лекарственным средствам и НД, экономить время на ввод лекарственного препарата и исключить ручной ввод общей информации из отдельных полей (рис. 3).
Лабораторная система обеспечивает прослеживаемость движения образца лекарственного средства и назначенных на него испытаний с возможностью определения его статуса и местонахождения в любой момент времени (как текущее состояние, так и историю его перемещений между лабораторными комплексами).
Идентификация образца с помощью штрих-кодирования
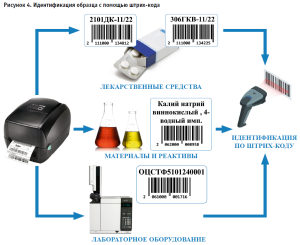
Система поддерживает регистрацию образцов с автоматическим присвоением идентификационного номера, который остается неизменным в процессе испытаний и последующего архивного хранения. Система позволяет идентифицировать образец с помощью штрих-кода, который автоматически считывается при проведении испытаний (рис. 4).
Система позволяет управлять испытаниями выбранного образца лекарственного средства. Задание на испытания представляет собой набор испытаний для выбранного образца, выполняемых в одном подразделении (лаборатории).
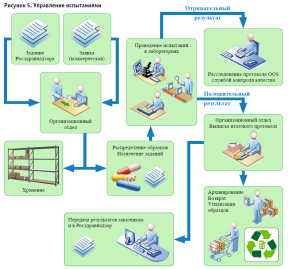
Исходными данными для формирования задания является спецификация к НД. Результатом выполнения испытаний – внутренний протокол испытаний. Информация по заданиям содержится в реестре заданий. На каждом из рабочих столов имеется элемент управления в виде кнопки по выбору заданий с конкретным статусом. В результате выполнения испытаний автоматически формируются внутренние протоколы испытательных лабораторий, а также итоговый протокол испытаний (рис. 5).
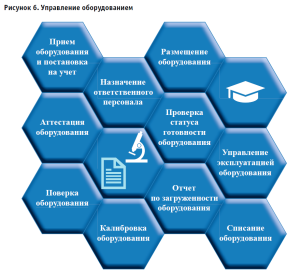
Лабораторная система позволяет учитывать и обрабатывать данные по используемым средствам измерения и лабораторному оборудованию (испытательное и вспомогательное оборудование) и его использование в испытаниях качества лекарственных средств (рис. 6), где обеспечены следующие функции:
- регистрация оборудования (оформление данных об оборудовании в виде карточки);
- обеспечение доступа сотрудников к работе с оборудованием;
- назначение ответственного за данную позицию оборудования;
- операции с оборудованием в части метрологии и технического обслуживания;
- планирование выполнения мероприятий по оборудованию и формирование полного плана мероприятий;
- доступ к методам исследований при работе с оборудованием.
Лабораторная система обеспечивает пользователя актуальной информацией об организационной структуре подразделений, о персонале, включая обеспечение доступа пользователей к работе с системой, где предусмотрены следующие функции:
- регистрация сотрудника (оформление данных о сотруднике виде карточки);
- доступ сотрудников к методам исследований;
- сведения о квалификации и аттестации;
- сведения об обучении (внутреннем и внешнем);
- сведения о работе под контролем (в течение установленного срока стажи ровки);
- планирование мероприятий по обучению.
Лабораторная система обеспечивает учет реактивов, стандартных образцов и других материалов, необходимых для проведения испытаний, а также их местонахождение в любой момент времени в режиме «онлайн».
Все скан-копии документов и электронные версии протоколов испытания качества лекарственных средств хранятся в базе данных и легко доступны.
Особое место в функционале информационной системы занимает модуль «Тренды». Данный модуль лабораторной системы предназначен для статистической обработки данных по количественным показателям результатов лаборатории, а также по данным сводных протоколов производителей иммунобиологических лекарственных препаратов. В соответствии с пунктом 3 приказа Федеральной службы по надзору в сфере здравоохранения от 17.12.2019 № 9452 «Об утверждении порядка оценки объема испытаний качества иммунобиологических лекарственных препаратов Комиссией Федеральной службы по надзору в сфере здравоохранения по качеству иммунобиологических лекарственных препаратов» одним из критериев при принятии решения по определению объема испытаний качества иммунобиологического лекарственного препарата конкретного наименования и производителя является оценка результатов статистического анализа закономерностей количественных данных, полученных в результате проведенных испытаний качества иммунобиологических лекарственных препаратов.
Для построения тренда по заданному числовому показателю качества конкретного лекарственного средства учитываются данные результатов испытаний для всех серий указанного лекарственного средства. Для построения тренда в автоматическом режиме доступны все данные протоколов испытаний, сформированных в ИИЛС сотрудниками филиалов при выполнении испытаний качества лекарственных средств.
Анализ трендов позволяет оценить стабильность производственного процесса. Отслеживание тенденций показателей качества дает возможность выявить негативные процессы на производстве. Информация о негативных тенденциях направляется производителям лекарственных средств и служит основой для разработки корректирующих мероприятий производственного процесса.
Система позволяет формировать отчеты по всем лабораторным комплексам и осуществлять сбор статической и аналитической информации в разрезе отдельных подразделений и филиалов. Все скан-копии документов и электронные версии протоколов испытания качества лекарственных средств хранятся в базе данных и легко доступны.
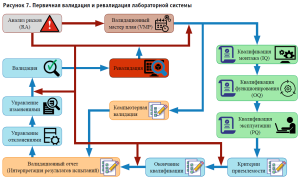
В соответствии с требованиями GХP, ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий» лабораторная система прошла первичную валидацию в 2020 году и ревалидацию в 2022 году (рис. 7). В ходе валидации было получено документальное подтверждение соответствия квалификационных показателей требованиям протоколов квалификации и оценки правильности монтажа, функционирования и эксплуатации лабораторной системы в соответствии с установленными требованиями и спецификациями.

В соответствии с требованиями системы менеджмента качества (ISO/ICE 17025:2019 «Общие требования к компетентности испытательных лабораторий») в учреждении созданы и поддерживаются в актуальном состоянии стандартные операционные процедуры, которые формализуют использование, функционирование, развитие лабораторной системы.
В Федеральной службе по интеллектуальной собственности учреждением зарегистрированы авторские права на базу данных и саму лабораторную систему. Исключительные права на данные объекты закреплены за ФГБУ «ИМЦЭУАОСМП» Росздравнадзора.
В настоящее время информационная лабораторная система в рутинном режиме обеспечивает поддержку полного цикла лабораторных процессов, начиная от поступления образца лекарственного средства и заканчивая выдачей протоколов испытаний, включает полную прослеживаемость движения образца лекарственного средства, обеспечивает управление испытаниями, персоналом, оборудованием, материалами, складским учетом и отчетностью.
Система интегрирована с ГРЛС, что позволяет автоматически получать справочные данные по лекарственным средствам, исключая ручной ввод. Важным свойством является обеспечение информационной безопасности путем поддержки разного уровня доступа к хранимой и обрабатываемой информации для разных пользователей.
Принятая технология обеспечивает оперативность внедрения модификаций в виде новых версий программы, нацеленных на расширение функциональности одновременно для всех федеральных лабораторных комплексов и учреждения в целом. У учреждения отсутствует необходимость каждый раз покупать лицензию или оплачивать новое рабочее место, содержать и нести затраты на свой штат программистов, дизайнеров интерфейсов, аналитиков бизнес-процессов, тестировщиков и других специалистов, необходимых для разработки информационной лабораторной системы.
В 2019 году информационная лабораторная система ФГБУ «ИМЦЭУАОСМП» Росздравнадзора была отмечена, как «Лучшее ИТ-решение для здравоохранения 2019» в рамках Международного конгресса информационных технологий в медицине. Развитие лабораторной информационной системы не стоит на месте и в соответствии с Поручением Заместителя Председателя Правительства Российской Федерации Руководителя Аппарата Правительства Российской Федерации Д.Ю. Григоренко от 24.08.2021 № ДГ-П36-11485, пункт 3, ФГБУ «ИМЦЭУАОСМП» Росздравнадзора ведет работы по интеграции ИИЛС с государственными информационными системами.
Conclusion.
В связи с включением ИИЛС в перечень проектов по замещению зарубежных отраслевых решений программного обеспечения на российские аналоги информационная система ФГБУ «ИМЦЭУАОСМП» Росздравнадзора может использоваться для автоматизации деятельности коммерческих испытательных лабораторий по контролю качества лекарственных средств, производителей лекарственных средств, а также в различных областях промышленности, сельского хозяйства, медицины. Благодаря наличию механизмов настройки регистрации и движения образцов, методов выполнения испытаний, наличию большого количества нормативно-справочной информации, отчетных и печатных форм, универсального функционала по проведению испытаний в любых испытательных лабораториях с возможностью их конфигурации и масштабирования, а также использования различных браузеров, применения российской СУБД, простотой развертывания данного решения ИИЛС с успехом может заменить специализированные иностранные решения. Это позволит российским компаниям избежать потенциальных санкционных проблем, зависимости от курса валют и иностранных вендоров и более рационально планировать свои инвестиции.
______________________________________________________________________
1 Тонкий клиент (англ. thin client) в компьютерных технологиях — компьютер или программа-клиент в сетях с клиент-серверной или терминальной архитектурой, который переносит все или большую часть задач по обработке информации на сервер. Примером тонкого клиента может служить компьютер с браузером, использующийся для работы с веб-приложениями.
2 Метод «гибкой» разработки – (англ. Agile software development), agile-методы — методология, нацеленная на минимизацию рисков путем сведения разработки к серии коротких циклов, называемых итерациями.
- Niyazov R.R. The quality of medicines: the relationship of regulatory documentation with the specification, registration dossier, pharmacopoeia and GMP / R.R. Niyazov, A.N. Vasiliev, E.V. Gavrishina, M.A. Dranitsyna // Remedium. – 2017; 4: 64–71. (In Russ.).
- Dyachuk E.A. Innovations and development of healthcare / E.A. Dyachuk, A.A. Schmidt, A.N. Drygin, A.V. Dyachuk, S.G. Kuzmin // Vestnik Rossijskoj voenno-medicinskoj akademii. – 2015; 1(49): 210–214. (In Russ.).
- Fauler M. Architecture of corporate software applications / M. Fauler. – M.: Williams, 2006: 554 p. (In Russ.).
- Moshkin A.V. Requirements for a laboratory information system for effective management of laboratory processes / A.V. Moshkin, M.G. Vershinina, A.Y. Mamonov, E.V. Tivanova, D.V. Tsaregorodtsev // Laboratornaya sluzhba. – 2017; 6(4): 19–23. (In Russ.).
- Kishkun A.A. Laboratory informative systems and economic aspects of laboratory work / A.A. Kishkun, A.L. Guzovsky. – M.: Labora, 2009: 256 p. (In Russ.).
