CIRCULATION OF MEDICINES
Practice of using systems based on artificial intelligence in the field of circulation of medicines
1 — Federal State Autonomous Educational Institution of Higher Education “I.M. Sechenov First Moscow State Medical University (Sechenov University)” of the Ministry of Health of the Russian Federation, 8, bld. 2, Trubetskaya St., Moscow, 119991, Russian Federation.
2 — Federal State Autonomous Educational Institution of Higher Education “I.M. Sechenov First Moscow State Medical University (Sechenov University)” of the Ministry of Health of the Russian Federation, 8, bld. 2, Trubetskaya St., Moscow, 119991, Russian Federation.
3 — Federal State Autonomous Educational Institution of Higher Education “I.M. Sechenov First Moscow State Medical University (Sechenov University)” of the Ministry of Health of the Russian Federation, 8, bld. 2, Trubetskaya St., Moscow, 119991, Russian Federation.
4 — Federal State Autonomous Educational Institution of Higher Education “I.M. Sechenov First Moscow State Medical University (Sechenov University)” of the Ministry of Health of the Russian Federation, 8, bld. 2, Trubetskaya St., Moscow, 119991, Russian Federation.
Artificial intelligence has many applications in the field of drug circulation, increasing the speed of development, the quality of drugs and the effectiveness of therapy. The article shows the practice of using systems based on artificial intelligence at all stages of circulation of medicines. Publications in the PubMed and IEEEXplore databases were analyzed. Data extraction was carried out by the authors according to the PRISMA methodology, and quality assessment was carried out according to QUADUS-2.
Keywords: machine learning, deep learning, neural network, pharmaceutical products lifecycle, pharmaceutical industry
Background.
Одним из направлений цифровой трансформации в сфере обращения лекарственных средств (ЛС) можно назвать применение искусственного интеллекта (ИИ), работающего с большими данными. Вычислительные системы с применением ИИ способны оказывать существенную помощь в автоматизации процессов, повышая эффективность работы. В разработке ИИ существует обширная область – машинное обучение (machine learning, ML). Она изучает методы построения алгоритмов, способных самостоятельно обучаться. Это необходимо, если не существует четкого решения какой-либо задачи. В этом случае проще не искать правильное решение, а создать механизм, который сам придумает метод для его поиска. Искусственные нейронные сети (ИНС) моделируют работу человеческой нервной системы, особенностью которой является способность к самообучению с учетом предыдущего опыта. Таким образом, с каждым разом система совершает все меньше ошибок, что достигается синергией опыта специалистов из фармацевтической сферы и сферы информационных технологий. На рынке стали появляться профильные ИТ-компании, которые специализируются на цифровой трансформации и внедрении искусственного интеллекта в областях здравоохранения и фармацевтики.
В обращение лекарственных средств входит как разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, так и производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств [1].
Цель работы
Целью настоящей работы является изучение практики применения систем на основе искусственного интеллекта на всех этапах обращения лекарственных средств.
Материалы и методы
Поиск систем на основе ИИ для цифровой трансформации жизненного цикла лекарственных средств был проведен в соответствии с рекомендациями «Предпочтительные элементы отчетности для систематических обзоров и метаанализов» (PRISMA) [2]. Поиск литературы был выполнен с двумя общедоступными базами данных, PubMed и IEEEXplore. Фильтры по языку или году публикации не применялись. Были исключены отчеты об отдельных случаях, руководящие документы, документы конференций, письма, редакционные статьи и обзорные статьи. Основными ключевыми словами поиска были «фармацевтические препараты ИЛИ лекарства», в сочетании с «искусственный интеллект ИЛИ глубокое обучение ИЛИ машинное обучение ИЛИ система глубокого обучения».
Были включены исследования, в которых оценивались алгоритмы ML в отношении средств улучшения по крайней мере одного из этапов жизненного цикла фармацевтической продукции, а также исследования, в которых предложены технические решения на основе ИИ и описан практический опыт внедрения в жизнь. Авторами рассматривались только общедоступные решения.
Решения ML были классифицированы по категориям:
- идентификация мишеней лекарственной терапии;
- репозиционирование и перепрофилирование ЛС;
- создание медицинских биологических препаратов;
- новые малые молекулы;
- клинические исследования;
- анализ естественного языка;
- классификация изображений;
- персонализированная терапия;
- контроль дозирования ЛС;
- логистика и закупка;
- создание отчетов для включения в регистрационное досье;
- эпидемиология.
Результаты и обсуждение
Внедрение цифровых систем, в том числе основанных на ИИ, применимо к автоматизации лабораторных исследований. Первичные электронные протоколы лабораторных исследований разрешают проблему формирования первичного субстрата для глубокого анализа путем применения ИНС и ML. Эти технологии позволяют ускорить процесс научных исследований, а также прогнозировать успешность выполнения научной работы, что, в свою очередь, создает возможность экономии человеческих и финансовых ресурсов.
Другим направлением в рамках данного вопроса является создание электронной системы индексации не только заголовков научных статей, но их содержимого, в основе которых будет лежать определенный язык программирования со множеством словарей и создание BigData с возможностью мета-анализа результатов научных работ [3]. Анализ естественного языка (NLP) можно разделить на категории: количественные методы, основанные на более простом принципе «мешка слов», и более сложные методы понимания естественного языка. «Мешок слов» – это упрощенная модель, используемая при обработке естественного языка и поиске информации. В этой модели текст представлен как неупорядоченный набор слов без учета грамматики и даже порядка слов. Рассматривается упрощающее предположение о том, что эти переменные независимы. Поскольку эти методы в целом основаны на подсчете слов в качестве признаков, возникают проблемы с текстом медицинской направленности из-за того, что разные представления признака будут учитываться как одна и та же особенность [4]. Обработка естественного языка позволяет анализировать текст и извлекать из контента метаданные, такие как концепции, сущности, ключевые слова, категории, тональность, эмоции, отношения, семантические роли и синтаксис.
Мишени для ЛС – это молекулярные структуры, аномальная активность которых, связанная с заболеванием, может быть изменена ЛС, улучшая здоровье пациентов. Алгоритмы ML, которые широко используются при открытии новых мишеней для ЛС – это «случайный лес» (RF), «наивный байесовский метод» (NB) и «машина опорных векторов» (SVM), а также другие методы. Извлечение знаний из большого количества неструктурированной информации – одно из преимуществ данных методов [5]. ИИ генерирует миллионы потенциальных новых молекул, соответствующих определенным спецификациям. Затем платформа ML позволяет предсказать, какие соединения будут активны в отношении сотен тысяч белков-мишеней. Затем третий уровень алгоритмов, называемый активным обучением, автоматически определяет приоритеты, какие соединения исследователи должны создать и протестировать. Эти процессы позволяют ученым точно разработать ЛС, одновременно выполнив большое количество задач проектирования с использованием ИИ.
Анализ главных компонентов (PCA) может быть использован для уменьшения размеров извлеченных признаков. Анализ производится с учетом свойств и молекулярных представлений, используемых в алгоритме моделирования ЛС, молекулярных графов с различным весом для атомов или связей, кулоновских матриц, молекулярных фрагментов или связей, атомных координат в 3D, электронной плотности вокруг молекулы, или их комбинаций. Эти входные данные используются на этапе обучения глубинных нейронных сетей (DNN) и могут обрабатываться различными ИНС на генеративном и прогностическом этапах. Эта процедура способна облегчить обучение с подкреплением (RL). В типичном исследовании генеративная стадия DNN принимает входные данные и обучается производить химически осуществимые представления, тогда как прогностическая стадия обучается свойствам молекул. [6][7][8].
Пандемия COVID-19 потенцировала потребность оценивать существующие химические и биологические субстанции как потенциальные терапевтические средства от новых инфекций. Переназначение ранее разработанных ЛС, одобренных для не связанных с SARS-CoV-2 состояний, широко предлагается в качестве терапевтического подхода против COVID-19. При этом может использоваться интеллектуальный анализ текста на основе словарей в сочетании со специализированным ИИ, например, таким как BioBERT (двунаправленная модель представления биомедицинского языка) [9][10]. Нейронная сеть с прямой связью (Feedforward neural network, FNN) – это архитектура, в которой искусственные нейроны связаны слой за слоем от входных объектов к выходным целям. Вес связан с каждым соединением и оптимизируется путем минимизации потерь прогнозирования выходных целей за счет обратного распространения на обучающих образцах. FNN может быть использован для классификации лекарств в фармацевтические терапевтические классы на основе векторов транскриптомного профиля лекарств [11]. Классификация на основе ИИ может быстро обнаружить лекарства, которые могут бороться с новыми заболеваниями (например, COVID-19) [12][13].
Алгоритмы ИИ могут ускорить проведение клинических исследований, автоматически определяя подходящие субъекты, обеспечивая правильное распределение по группам участников исследования и предоставляя систему раннего предупреждения для клинических исследований, которые не дадут значимых результатов [10]. Алгоритмы ИИ могут использоваться для проверки данных на достоверность (ошибочный ввод), полноту (закономерность и объем отсутствующих данных), систематические ошибки (репрезентативность данных) и своевременность (данные, отражающие текущую практику).
Другой способ использования ИИ в клинических испытаниях основан на реальных клинических данных (RWD). Система на основе ИИ может включать пациентов в исследование, профилировать их (например, с помощью секвенирования ДНК, протеомики, метаболомики и т.д.). Затем система будет использовать RWD для сопоставления ЛС, рассматриваемых в исследовании, с патологиями, идентифицированными при профилировании. Стратегии сопоставления ЛС с профилями пациентов в этих исследованиях могут быть основаны на анализе больших соответствующих наборов данных с помощью ИИ и ML. Данные алгоритмы могут в дальнейшем использоваться для поддержки электронной версии мониторинга исследования, тем самым обеспечивая правильность данных и безопасность пациентов; таким образом снижается потребность в дорогостоящем мониторинге исследования на месте проведения. Кроме того, данные электронной медицинской карты (ЭМК) могут быть объединены с другими типами RWD, такими как геномика и сообщения о проблемах пациентов. Данные могут быть добыты с помощью методов ИИ и ML, чтобы создать более полную картину для открытия ЛС и биомаркеров [14]. OpenAI создала мощную модель обработки GPT-3, которая имеет потенциал для создания человекоподобного текста по требованию. Предлагается использовать GPT-3 для клинических операций, например, для построения регулируемой электронной формы отчета о случае (eCRF) из протокола [15].
ИИ можно обучить на наборе данных, содержащем изображения результатов применения ЛС к нескольким культурам клеток. Классификация изображений может использоваться в клинических исследованиях для обработки медицинских изображений. Наиболее распространенными видами алгоритмов классификации изображений ML являются K-ближайшие соседи, машины опорных векторов, многослойные персептроны. Наиболее часто используемым алгоритмом классификации изображений в последнее время являются сверточные нейронные сети (англ. convolutional neural network, CNN). CNN – это настраиваемые версии нейронных сетей, которые объединяют многослойные нейронные сети со специализированными слоями, которые способны извлекать фрагменты, наиболее важные и релевантные для классификации объекта. Это значительно снижает необходимость вручную маркировать и сегментировать изображения, чтобы подготовить их для алгоритмов ML [16][17].
Персонализированная медицина или более эффективное лечение, основанное на индивидуальных данных о здоровье в сочетании с прогнозной аналитикой, также является актуальной областью исследований и тесно связано с улучшением оценки заболеваний. В настоящее время эта сфера деятельности может быть усовершенствована системами с контролируемым обучением, которое позволяет врачам выбирать, например, из более ограниченных наборов диагнозов или оценивать риск для пациента на основе симптомов и генетической информации. Например, анализ информации о последовательности ДНК, полученной от человека на основе ИИ, может значительно облегчить постановку генетического диагноза заболевания [18]. Разработка многофункциональных платформ ML для извлечения, агрегации, управления и анализа клинических данных может поддержать врачей за счет эффективной стратификации субъектов для понимания конкретных сценариев и оптимизации принятия решений. Внедрение ИИ в здравоохранение может привести к значительным улучшениям для предоставления данных в реальном времени, более персонализированной и популяционно адаптированной медицины с меньшими затратами [19]. Данный подход позволит создать базу, к которой врач сможет обратиться с высоким уровнем доверия и принять решение.
Ошибки при приеме ЛС могут быть вызваны человеческим фактором, но часто они возникают из-за неисправной системы с неадекватными средствами контроля для обнаружения ошибок. Аналитика больших данных и алгоритмы ML для анализа больших данных ЭМК могут быть использованы для изучения того, как врачи лечат пациентов в реальных условиях. Технология ИИ может проверять корректность назначения ЛС во время назначения врачом, отпуском фармацевтом и приема пациентом [20][21][22].
Технологии ML и ИИ также применяются для мониторинга и прогнозирования вспышек эпидемий по всему миру на основе актуальных данных, исторической информации, сообщений в сети Интернет, обновлений в социальных сетях и других источников в режиме реального времени. Машины опорных векторов и ИНС используются, например, для прогнозирования вспышек малярии с учетом таких данных, как температура, среднемесячное количество осадков, общее количество положительных случаев и других данных [23][24].
Все системы с использованием ИИ можно разделить на несколько перекрывающихся категорий. Из 177 проектов наиболее распространенной областью внедрения ИИ являются клинические и доклинические исследования (34%). Некоторые решения имитируют процесс оценки ЛС в ИНС, которая работает как цифровой двойник пациента или тестовой системы. Другие решения помогают управлять полученными данными или подбирать пациентов, подходящих для исследования. Второе место занимают системы дизайна малых молекул – они составляют 33% от общего количества. Эти системы моделируют новые вещества на основе свойств аналогичных ЛС. Третья по популярности область применения ИИ – идентификация мишеней для новых ЛС. Более 25% систем на основе ИИ предоставляют эту функциональность. Интересно, что большинство систем специализируются только на одной области (из 102-х систем 57% – одноцелевые). В основном это продукты начинающих компаний. Ни одна из систем не обеспечивает функциональных возможностей для полного охвата сферы обращения лекарственных средств и функций во всех категориях. Распределение по категориям решений представлено на рисунке.
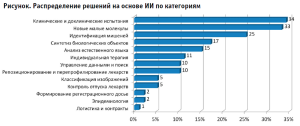
Системы сбора результатов исследований в цифровой форме представлены на рынке. Их функциональные возможности позволяют работать таким решениям, как графическая обработка изображений, подбор новостной ленты на основе историй веб-серфинга. Технология ML применяется в ряде пилотных проектов в области медицины и здравоохранения, например, в ультразвуковой диагностике миозита с применением метода классификации с помощью сверхточных нейронных сетей – и показала положительные результаты по выявлению данной нозологии [25]. Также системы на основе ИИ применяются для оптимизации выбора фармакотерапии [26][27]. Например, построена информационная модель оптимизации выбора схем лекарственной терапии при хроническом гепатите С [28]. Также проведено построение информационного ресурса прогнозирования совместимости лекарственных препаратов и оптимизации выбора препарата замены [29].
Машинное обучение позволяет найти наиболее выгодную комбинацию ЛС при определенном заболевании или их сочетании. А также минимальную дозу того ЛС в комбинации, который имеет низкий порог возникновения токсических эффектов и обладает множеством побочных эффектов. При этом создается возможность повысить долю тех ЛС в комбинации, которые не обладают столь высокими значениями токсичности и побочных эффектов.
Машинное обучение может быть применено для решения следующих задач:
- для создания правильной комбинации ЛС с помощью ML. Для этого необходимы параметрические данные (предикторы синергии) – это общие данные о ЛС: название, химическая структура и субструктурный профиль, фармакологические эффекты, основанные на механизме действия ЛС, токсические и побочные эффекты с учетом дозировок вводимых ЛС;
- для создания базы данных о мишенях действия данных ЛС, нарушения которых являются триггером в патогенезе заболеваний и на основании которых будет вычисляться минимальная доза, при которой возникает фармакологический эффект, а также мишеней действия ЛС, не входящих в патогенез заболевания, но являющихся основой возникновения побочных (нежелательных) эффектов. Важной является токсическая доза – это то количество ЛС, превышение которого вызовет токсический эффект. Комбинации синергетических ЛС будут иметь те же эффекты, но доза комбинированных ЛС будет отличаться от значений дозы их составляющих. Это связано с тем, что ЛС синергетического действия, но разной химической структуры имеют отличные друг от друга соотношения «доза – эффект».
Немаловажным является определение фармакокинетических свойств и способов введения ЛС, а также способность ЛС накапливаться и пересекать гистогематические барьеры. Одновременное использование предикторов синергии позволит уточнить запросы по поиску комбинаций ЛС.
Новые перспективы открывает применение цифровых систем обработки информации при проведении доклинических исследований. «Оценка комбинированной синергии» Combination Synergy Estimation (CoSynE) может спрогнозировать новые синергетические взаимодействия ЛС, а также выявить скрытый антагонизм применяемых в клинике ЛС. Для этой цели необходимо создать базу данных ЛС с известными фармакологическими эффектами действия с учетом вероятности их проявления в когорте. Это значимо и в практике клинической фармакологии, где подобранные комбинации фармацевтических препаратов утверждены эмпирически без привлечения компьютерного моделирования. Для реализации принципов персонализированной медицины могут быть подобраны комбинации из разного количества ЛС в определенной дозировке, каждая из которых будет оценена в соответствии с побочными и токсическими эффектами. В доклинических исследованиях важно отметить достижение отсутствия токсических эффектов и стремление к снижению побочных эффектов. Не следует забывать, что при комбинировании ЛС суммированию подвергаются не только фармакологические эффекты, но и побочные (и токсические). Новая система направлена на быстрое создание комбинаций ЛС, которые могут эффективно применяться в человеческой популяции, а также на подбор индивидуальных комбинаций ЛС.
Conclusion.
Решения на основе ИИ в сфере обращения лекарственных средств могут найти множество способов внедрения. Обработка естественного языка позволяет суммировать документы, генерировать документы, распознавать именованные объекты на основе новых технологий BERT и GPT. ИИ можно использовать для обработки реальных клинических данных, составления отчетов и резюме. RF, NB, SVM и другие методы могут применяться для анализа большого количества неструктурированной информации для идентификации новых мишеней для ЛС. DNN, RL, PCA наиболее полезны для генерации новых молекул in silico и прогнозирования их активности. Репозиционирование и перепрофилирование ЛС может быть выполнено с помощью интеллектуального анализа текста в сочетании с FNN. Генерация синтетической биологии базируется в основном на реализациях NLP для последовательностей на основе РНК. В клинических исследованиях используются подходы RWD. Классификация изображений с помощью CNN может автоматически обнаруживать, генерировать и изучать особенности изображений, что полезно при обработке результатов доклинических и клинических исследований. Персонализированная терапия может помочь прогнозировать риски для пациента и анализ множественных факторов, включая генетику. Контроль за отпуском ЛС, основанный на анализе ЭМК, позволяет предупреждать о противопоказаниях и взаимодействии комбинаций ЛС. В более широком масштабе технологии ML и ИИ также применяются для мониторинга и прогнозирования вспышек эпидемий по всему миру.
- Federal Law No. 61-FZ dated April 12, 2010 “On the Circulation of Medicines”. (in Russian).
- Shamseer L. et al. Preferred reporting items for systematic review and meta-analysis protocols (prisma-p) 2015: Elaboration and explanation // BMJ (Online). BMJ Publishing Group, 2015. Vol. 349.
- Lebedev G.S. et al. Bilding of the medical decision support system on the basis of providing medicine based on evidence-based medicine // Zhurnal telemediciny` i e`lektronnogo zdravooxraneniya (Russian journal of telemedicine and e-health). – 2019. – Vol. 5, № 1. – P. 8–16. (in Russian).
- Carvalho J.P., Curto S. Fuzzy Preprocessing of Medical Text Annotations of Intensive Care Units Patients.
- Danger R. et al. A comparison of machine learning techniques for detection of drug target articles // J. Biomed. Inform. Academic Press, 2010. Vol. 43, № 6. P. 902–913.
- Chan H.C.S. et al. Advancing Drug Discovery via Artificial Intelligence // Trends in Pharmacological Sciences. Elsevier Ltd, 2019. Vol. 40, № 8. P. 592–604.
- Chan H.C.S. et al. Special Issue: Rise of Machines in Medicine Advancing Drug Discovery via Artificial Intelligence // Trends Pharmacol. Sci. 2019. Vol. 40, № 8.
- Piroozmand F., Mohammadipanah F., Sajedi H. Spectrum of deep learning algorithms in drug discovery // Chem. Biol. Drug Des. Blackwell Publishing Ltd, 2020. Vol. 96, № 3. P. 886–901.
- Lee J. et al. BioBERT: a pre-trained biomedical language representation model for biomedical text mining // Bioinformatics / ed. Wren J. Oxford University Press, 2019. Vol. 36, № 4. P. 1234–1240.
- Levin J.M. et al. Artificial intelligence, drug repurposing and peer review // Nature Biotechnology. Nature Research, 2020. Vol. 38, № 10. P. 1127–1131.
- Zhou Y. et al. Artificial intelligence in COVID-19 drug repurposing // The Lancet Digital Health. Elsevier Ltd, 2020. Vol. 2, № 12. P. e667–e676.
- AI Driven Repositioning and Repurposing Summit 2021 – [Electronic resource]. URL: https://pharmaphorum.com/events/ai-driven-repositioning-and-repurposing-summit-2021/ (accessed: 11.02.2021).
- Mohanty S. et al. Application of Artificial Intelligence in COVID-19 drug repurposing // Diabetes and Metabolic Syndrome: Clinical Research and Reviews. Elsevier Ltd, 2020. Vol. 14, № 5. P. 1027–1031.
- Shah P. et al. Artificial intelligence and machine learning in clinical development: a translational perspective // npj Digit. Med. Springer Science and Business Media LLC, 2019. Vol. 2, № 1. P. 1–5.
- Overview / The Conference Forum [Electronic resource]. URL: https://theconferenceforum.org/conferences/webinar-open-aigpt3/overview/ (accessed: 11.02.2021).
- State-Of-The-Art Image Classification Algorithm: FixEfficientNet-L2 / by Hucker Marius / Towards Data Science [Electronic resource]. URL: https://towardsdatascience.com/state-of-the-art-image-classification-algorithm-fixefficientnetl2-98b93deeb04c (accessed: 11.02.2021).
- Cellular Image Classification for Drug Discovery | by Huseyn Gasimov / Intelec AI | Medium [Electronic resource]. URL: https://medium.com/intelec-ai/cellular-image-classificationfor-drug-discovery-4ef55741151c (accessed: 11.02.2021).
- Schork N.J. Artificial Intelligence and Personalized Medicine // Cancer Treatment and Research. Springer International Publishing, 2019. Vol. 178. P. 265–283.
- Ahmed Z. et al. Artificial intelligence with multi-functional machine learning platform development for better healthcare and precision medicine // Database. Oxford University Press, 2020. Vol. 2020.
- Artificial Intelligence to Eradicate Prescription Errors [Electronic resource]. URL: https://www.whatnextglobal.com/post/artificialintelligence-to-eradicate-prescription-errors (accessed: 11.02.2021).
- Review on Artificial Intelligence (AI) in Drug Dispensing and Drug Accountability [Electronic resource]. URL: https://globalresearchonline.net/journalcontents/v61-2/07.pdf (accessed: 11.02.2021).
- Real-World Applications of Artificial Intelligence To Improve Medication Management Across the Care Continuum – Electronic Health Reporter [Electronic resource]. URL: https://electronichealthreporter.com/real-world-applications-ofartificial-intelligence-to-improve-medication-managementacrossthe-care-continuum/ (accessed: 11.02.2021).
- Artificial Intelligence and the Opioid Epidemic – Applications for Relapse Treatment, Abuse Prevention, and More | Emerj [Electronic resource]. URL: https://emerj.com/ai-sector-overviews/artificialintelligenceopioid-epidemic/ (accessed: 11.02.2021).
- Malaria Outbreak Prediction Model Using Machine Learning [Electronic resource]. URL: http://ijarcet.org/wp-content/uploads/IJARCET-VOL-4-ISSUE-12-4415-4419.pdf (accessed: 11.02.2021).
- Burlina P. et al. Automated diagnosis of myositis from muscle ultrasound: Exploring the use of machine learning and deep learning methods. // PLoS One. Public Library of Science, 2017. Vol. 12, № 8. P. e0184059.
- Lebedev G., Tikhonova Y. Information system for pharmacotherapy method selection // Int. Conf. Knowl. Based Intell. Inf. Eng. Syst. KES2017, 6-8 Sept. 2017, Marseille, Fr. / Procedia Comput. Sci. 2017. Vol. 112. P. 1658–1663.
- Lebedev G.S., Kotov N.M., Mironov Yu.G. Using mathematical models when choosing a method pharmacotherapy // Sovremenny`e problemy` nauki i obrazovaniya (Modern problems of science and education). – 2015 – Vol. 2, № 3. (in Russian).
- Korobov N.V. et al. Information model for optimization of choice of drug regimens for chronic hepatitis C // Informacionno-izmeritel`ny`e i upravlyayushhie sistemy` (Information-measuring and control systems). – 2014. – Vol. 10, № 12. – P. 55–62. (in Russian).
- Lebedev G.S. et al. Construction of information resources for prediction drugs compatibility and optimization of choice drug replacement // Sovremenny`e naukoemkie texnologii (Modern high technologies). – 2015. – Vol. 12–4. – P. 615–619. (in Russian).
