REGISTRATION OF MEDICINES
Assessing the effectiveness and efficiency of the processes for preparing registration dossier and registering medicines
1 — Parma Clinical LLC, 1b Prichalnaya str., building 3, Perm, 614101, Russian Federation.
ORCID: https://orcid.org/0000-0001-8164-6521
2 — Parma Clinical LLC, 1b Prichalnaya str., building 3, Perm, 614101, Russian Federation.; Federal State Educational Institution of Higher Education «Perm State Pharmaceutical Academy» of the Ministry of Health of the Russian Federation, 2, Polevaya str., Perm, 614990, Russian Federation.
ORCID: https://orcid.org/0000-0002-3752-7848
3 — Federal State Educational Institution of Higher Education «Perm State Pharmaceutical Academy» of the Ministry of Health of the Russian Federation, 2, Polevaya str., Perm, 614990, Russian Federation.; Federal State Autonomous Educational Institution of Higher Education «Perm State National Research University», 15, Bukireva str., Perm, 614990, Russian Federation.
ORCID: http://orсid.org/0000-0001-5579-394X
4 — Parma Clinical LLC, 1b Prichalnaya str., building 3, Perm, 614101, Russian Federation.
ORCID: https://orcid.org/0000-0001-5755-4184
Improving the management system for the preparation of registration dossier and registration of medicinal products is directly related to the objective assessment and analysis of the effectiveness of these processes.
When analyzing the company's development strategy in terms of planned annual indicators for the introduction of medicinal products into circulation, it was established that plans were not fulfilled. In order to find the reasons for the failure to fulfill the designated tasks of the developer company, the following hypothesis was put forward: lack of timely satisfactory pharmaceutical development.
A study of pharmaceutical development reports for 2019-2024 showed that the implementation of planned pharmaceutical developments can be noted only in 2020 and 2022. The main reasons for the failure to complete pharmaceutical development: the lack of satisfactory technological parameters in production and comparability of the pharmacokinetic characteristics of the study drug in relation to the reference one.
The obtained results of the assessment of efficiency and effectiveness have determined the need to systematize the processes of preparation of the registration dossier and registration of the medicinal product, making organizational decisions regarding the internal structure and procedure for interaction, improving the documentation support of registration processes and preparation of the registration dossier.
Keywords: registration of medicines, pharmaceutical development, preparation of the registration dossier for medicines, effectiveness of the organization of registration and preparation of the registration dossier
На сегодняшний день организации-разработчики находятся под влиянием ряда обстоятельств и факторов, влияющих на вывод в обращение эффективных, безопасных и качественных лекарственных препаратов (ЛП):
новые требования Евразийского экономического союза (ЕАЭС), а также рекомендации межинтеграционных объединений по фармацевтической разработке (ФР);
высокая конкуренция среди отечественных производителей и необходимость их соответствия задачам национальной политики в сфере промышленной фармации в целях получения государственной поддержки;
значимость роста экспортного потенциала;
актуализация вопросов регулирования сферы обращения лекарств, включая аспекты лекарственного обеспечения и др. [1, 2].
Одним из важных этапов, обеспечивающих возможность ввода в обращение ЛП на рынок, является одобрение со стороны уполномоченных органов и регистрация ЛП [3].
Вопросы, связанные с объективной оценкой и анализом результативности процессов, имеют теоретическое и практическое значение в совершенствовании системы управления регистрационными процессами [4].
В этой связи определена необходимость оценки эффективности и результативности как организации регистрационных процессов, так и процессов подготовки регистрационного досье (РД) на уровне организации-разработчика воспроизведенных ЛП. Под эффективностью мы понимаем относительный результат процессов подготовки РД и регистрации ЛП, определяемый как отношение результата к трудозатратам на его достижение. В ходе исследования были использованы следующие методы: наблюдение, сбор объективных свидетельств, опрос, обобщение, анализ и др.
Объектами исследования явились: стратегия развития компании, отчеты фармацевтической разработки ЛП, регистрационные процессы, документация РД, экспертные отчеты уполномоченных органов, документация Службы обеспечения качества (СОК).
Исследование проводилось на базе контрактно-исследовательской организации (КИО). Основные направления КИО: ФР и регистрация ЛП, обеспечивающие ввод в обращение эффективных, безопасных и качественных ЛП в соответствии с условиями заказчика.
Основная цель компании КИО – обеспечение качества и безопасности (разработка, испытания, исследования) продукции, соответствующей требованиям и ожиданиям потребителей, требованиям законодательных и нормативных документов. Основная деятельность КИО направлена на обеспечение компании-заказчика услугами по ФР воспроизведенных ЛП, организации и проведению доклинических и клинических исследований, регистрации и пострегистрационному сопровождению на протяжении всего жизненного цикла РД на ЛП, а также по обеспечению и поддержанию основной деятельности компании-заказчика соответствующей утвержденной регулятором документацией на ЛП, разработанной в соответствии с требованиями действующих регуляторных документов национального и наднационального уровня в области разработки и обращения ЛП.
Основываясь на опыте КИО и компании-производителя (заказчика), а также регламентации новых регистрационных процедур по требованиям ЕАЭС, нами расклассифицированы процедуры регистрации, дана оценка планов, включая их реализацию по количеству ЛП за период 2019–2023 гг. (табл. 1).

С 2021 года компанией-производителем определен основной вектор деятельности – приведение РД на ЛП в соответствие с требованиями ЕАЭС с целью продолжения обращения ЛП на рынке Российской Федерации (РФ) и в странах признания. Оценка результативности управления регистрационными процедурами проводилась с учетом данной процедуры.
Как видно из таблицы 1, именно с этим и связано уменьшение количества подач на регистрацию по требованиям ЕАЭС лекарственных препаратов в период с 2021 по 2022 гг.
Для поиска причин невыполнения обозначенных выше задач была выдвинута следующая гипотеза – отсутствие своевременной удовлетворительной ФР. Незавершенная ФР в установленный срок может служить причиной отсрочки представления ЛП для регистрации в уполномоченных органах.
Фармацевтическая разработка представляет собой сложный поэтапный процесс разработки и производства ЛП. В этих нормативных документах (ICH Q8 (R2) Pharmaceutical development – Scientific guideline1) изложен новый концептуальный подход к фармацевтической разработке ЛП, который взаимосвязан с серийным производством по правилам Good Manufacturing Practice (GMP). Согласно ICH Q8 результатом успешной проведенной ФР является документально оформленные материалы РД на ЛП. Подача на регистрацию ЛП невозможна без наличия всей документальной базы относительно качества, эффективности и безопасности ЛП. Нами был проведен анализ выполнения ФР, количества поданных и зарегистрированных ЛП за период с 2019 по 2023 годы (табл. 2).
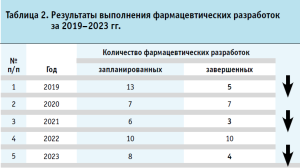
Согласно таблице 2, выполнение запланированных ФР можно отметить только в 2020 и 2022 гг., при этом в 2019, 2021, 2023 годах наблюдается снижение успешных проведенных ФР. Основные причины не завершения ФР: отсутствие эквивалентности профиля высвобождения ЛП по сравнению с референтным ЛП и рост примесей в процессе ускоренного и долгосрочного исследования стабильности. В случае отсутствия соответствующего качества и обоснования процесса производства ЛП, для стабильного выпуска продукции с заданными функциональными характеристиками вывод на рынок такого ЛП будет невозможен.
Таким образом, в результате проведенной оценки эффективности и результативности как организации регистрационных процессов, так и процессов подготовки РД на уровне организации-разработчика воспроизведенных ЛП подтверждено несоответствие планов по вводу в обращение ЛП. Причины данного несоответствия подтвердились в соответствии с выдвинутой гипотезой: отсутствие своевременной удовлетворительной ФР (отсрочка представления ЛП для регистрации в уполномоченных органах).
Полученные результаты определяют необходимость систематизации процессов подготовки РД и регистрации ЛП, принятия организационных решений в части внутренней структуры и порядка взаимодействия в КИО, совершенствования документационного сопровождения регистрационных процессов и подготовки РД и др. Эффективное управление регистрационными процедурами и процессами подготовки РД возможно на основе риск-ориентированного подхода и других технологий, предусмотренных рекомендациями ICH.
Формирование эффективной системы управления и организации регистрационных процессов, а также процессов подготовки РД на уровне организации-разработчика позволит своевременно выводить как на рынок ЕАЭС, так и за его пределы качественные, эффективные и безопасные ЛП в соответствии со стратегией развития компании.
______________________________________________________________________
1 ICH Q8 (R2) Pharmaceutical development — Scientific guideline. Доступно по: https://www.ema.europa.eu/en/ich-q8-r2-pharmaceutical-development-scientific-guideline. Дата обращения: 19.06.2025 г.
- Khalimova A.A. State support for the sustainable development of the pharmaceutical industry in St. Petersburg // Sustainable development (ESG): finance, economics, industry: Mater. National scientific and Practical Conference. (St. Petersburg, October 21, 2022). Asterion Research and Production Technology Center. Saint Petersburg, 2022, pp. 572–576. (In Russian).
- Aladysheva Z.A., Beregovykh V.V., Meshkovskiy A.P., Pyatigorskaya N.V. Drug Regulation in Top Exporters of Pharmaceutical Products. Federalism. 2023; 28(3): 108–136. (In Russian).
- Zaitseva N.Yu. Modern directions of ensuring the safety of medicines. Aktual'nye problemy estestvennykh nauk. 2015: 93–98. (In Russian).
- Tsareva S.A., Zabairachnaya A.A. Evaluation of the effectiveness of the pharmaceutical quality system. Ekonomika: vchera, segodnya, zavtra [Economics: yesterday, today, tomorrow]. – 2022. – Volume 12. – No. 10A. – pp. 200–211. DOI: 10.34670/AR.2022.73.52.050. (In Russian).
