LEGAL REGULATION OF THE CIRCULATION OF MEDICAL DEVICES AND MEDICINES
Review of key changes in regulatory legal acts in the field of circulation of medical devices
1 — Ministry of Health of the Russian Federation, Rakhmanovsky per., 3, GSP-4, 127994, Russian Federation.
2 — Ministry of Health of the Russian Federation, Rakhmanovsky per., 3, GSP-4, 127994, Russian Federation.
3 — Ministry of Health of the Russian Federation, Rakhmanovsky per., 3, GSP-4, 127994, Russian Federation.
4 — Ministry of Health of the Russian Federation, Rakhmanovsky per., 3, GSP-4, 127994, Russian Federation.
The article provides an overview of the main regulatory changes in the sphere of circulation of medical devices in the Russian Federation, including the introduction of mandatory labeling by means of identification, in relation to certain types of medical devices, as well as the issues of the permissive procedure for the export of certain types of medical devices outside the territory of the Russian Federation.
Keywords: medical devices, registration, mandatory labeling, export permit
Background.
Регулирование обращения медицинских изделий является важным аспектом при оказании качественной медицинской помощи гражданам Российской Федерации и требует постоянного совершенствования. Принимаемые в Российской Федерации правовые нормы в сфере обращения медицинских изделий создают необходимые условия для развития российского рынка медицинских изделий.
За последние несколько лет реализация механизма ускоренного доступа на рынок медицинских изделий была продолжена. Постановлением Правительства Российской Федерации от 1 апреля 2022 г. № 5521 утверждены Особенности обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера (далее – Особенности).
Принятие данного постановления облегчило регистрацию медицинских изделий в связи с введением в отношении нашей страны ограничительных мер экономического характера.
В конце 2022 года было принято постановление Правительства Российской Федерации от 29 декабря 2022 г. № 25252, которое внесло изменения в Особенности в части возможности проведения технического обслуживания медицинских изделий с использованием комплектующих или принадлежностей, не предусмотренных в их технической и (или) эксплуатационной документации производителя (изготовителя), если безопасность совместного использования подтверждена техническими испытаниями и в случае применимости – токсикологическими исследованиями, проведенными ФГБУ «ВНИИИМТ» Росздравнадзора, а также клиническими испытаниями.
Принятые изменения будут способствовать организации отечественного производства комплектующих или принадлежностей на территории Российской Федерации.
Приказом Росздравнадзора от 16 мая 2023 г. № 29833 определен перечень документов и их содержание при использовании комплектующих, которые отсутствуют в документации, при проведении технического обслуживания медицинских изделий.
Еще одним немаловажным изменением является внесение изменений в Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года (далее – Соглашение).
Так, 13 февраля 2023 года подписан Протокол о внесении изменений в Соглашение, предусматривающий продление до 31 декабря 2025 года возможности подачи заявления о регистрации медицинского изделия в порядке, установленном законодательством государства-члена Евразийского экономического союза (далее – Союз). Таким образом, ожидается, что процедура регистрации медицинских изделий по правилам Союза станет исключительной с 1 января 2026 года.
Вместе с тем необходимо подчеркнуть преимущества интеграции в части повышения доступности безопасных, эффективных и качественных медицинских изделий для граждан государств-членов Союза.
Так, в целях своевременного и плавного перехода на Правила регистрации медицинских изделий в соответствии с правом Союза распоряжением Совета Евразийской экономической комиссии от 14 декабря 2022 г. № 36 был утвержден план мероприятий (дорожная карта) по обеспечению перехода к осуществлению регистрации медицинских изделий в соответствии с Правилами Союза.
План мероприятий затрагивает аспекты, связанные с работой испытательных лабораторий и баз клинических испытаний, подготовкой экспертов, инспекторов, производителей медицинских изделий и уполномоченных представителей производителей к регистрации медицинских изделий в соответствии с правом Союза, совершенствованием права Союза в области регулирования обращения медицинских изделий. План мероприятий позволяет учесть все вопросы, выявленные в работе общего рынка медицинских изделий, и включает мероприятия уполномоченных органов стран Союза, а также совместные мероприятия с Евразийской экономической комиссией.
Введение обязательной маркировки средствами идентификации в отношении отдельных видов медицинских изделий
В рамках реализации Стратегии по противодействию незаконному обороту промышленной продукции в Российской Федерации на период до 2025 года4 предусмотрено расширение списка товарных групп, подлежащих обязательной маркировке средствами идентификации, с целью дальнейшего сокращения незаконного оборота промышленной продукции (указанный перечень утвержден распоряжением Правительства Российской Федерации от 28 апреля 2018 г. № 792-р).
Маркировка отдельных видов медицинских изделий была апробирована на территории Российской Федерации в рамках проведения эксперимента по маркировке отдельных видов медицинских изделий средствами идентификации, который проходил с 15 февраля 2022 г. по 31 августа 2023 г.5
Вместе с тем, отмечая высокую социальную значимость данной товарной группы, сложности импорта отдельных категорий в текущей ситуации и широкую номенклатуру представленных позиций, было предложено индивидуально подойти к обязательной маркировке по каждой товарной группе.
Так, постановлением Правительства Российской Федерации были утверждены Правила маркировки отдельных видов медицинских изделий средствами идентификации6, в соответствии с которыми установлен дифференцированный подход к обязательной маркировке медицинских изделий, в частности, утверждены сроки поэтапного введения обязательной маркировки средствами идентификации в отношении отдельных видов медицинских изделий (рисунок):
- с 1 сентября 2023 г. – начало обязательной регистрации в государственной информационной системе мониторинга за оборотом товаров, подлежащих обязательной маркировке средствами идентификации (далее – информационная система мониторинга);
- с октября 2023 г. – начало обязательной маркировки в отношении обеззараживателей – очистителей воздуха, обуви ортопедической и вкладных корригирующих элементов для обуви ортопедической;
- с 1 марта 2024 г. – начало обязательной маркировки в отношении аппаратов слуховых, кроме частей и принадлежностей, стентов коронарных, компьютерных томографов, санитарно-гигиенических изделий, используемых при недержании;
- с 1 сентября 2024 г. – устанавливается обязанность передачи сведений в систему маркировки о поэкземплярном выводе из оборота для всех участников оборота;
- с 1 сентября 2025 г. – устанавливается обязанность передачи сведений об обороте маркированных медицинских изделий (поэкземплярный учет).
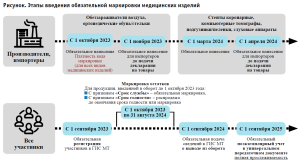
При этом участники оборота товаров вправе представлять в информационную систему маркировки сведения о вводе в оборот, обороте и выводе из оборота товаров со дня вступления в силу постановления.
Также в отношении кресел-колясок введена обязательная маркировка средствами идентификации7, которая будет вводится поэтапно:
- с 1 сентября 2023 г. – начало обязательной регистрации в информационной системе мониторинга;
- с 1 октября 2023 г. – начало обязательной маркировки для производителей и импортеров;
- с 1 октября 2023 г. по 1 сентября 2024 г. – всем участникам оборота необходимо промаркировать товарные остатки кресел-колясок;
- с 1 сентября 2024 г. – устанавливается обязанность передачи сведений об обороте кресел-колясок (поэкземплярный учет) и выводе из оборота кресел-колясок для всех участников оборота.
Одновременно планируется проведение эксперимента по маркировке средствами идентификации отдельных видов технических средств реабилитации с 15 октября 2023 г. по 31 августа 2024 г. Проведение эксперимента по маркировке отдельных видов технических средств реабилитации направлено на противодействие незаконному обороту социально значимых товаров – средств реабилитации, создания условий для обеспечения нуждающихся граждан техническими средствами реабилитации, соответствующих установленным законодательством требованиям по качеству и безопасности.
Разрешительный порядок вывоза за пределы территории Российской Федерации отдельных видов медицинских изделий
Меры по ограничению экспорта из Российской Федерации отдельных видов товаров иностранного производства, в том числе медицинского оборудования и его частей, утверждены постановлениями Правительства Российской Федерации от 9 марта 2022 г. № 3118 и № 3129 (далее – постановление № 311 и № 312) и приняты во исполнение Указа Президента Российской Федерации, а также в рамках реализации комплекса мер по обеспечению развития экономики Российской Федерации в условиях внешнего санкционного давления и направлены на недопущение возникновения дефицита товаров, имеющих критическое значение, а также для бесперебойного функционирования ключевых отраслей экономики в условиях внешнего санкционного давления.
Постановлением № 312 установлен разрешительный порядок вывоза за пределы территории Российской Федерации на территории государств-членов Союза отдельных видов товаров.
Разрешительный порядок вывоза отдельных видов товаров медицинского назначения, включенных в приложение № 6 к постановлению № 312, реализуется посредством выдачи Росздравнадзором разрешений на вывоз.
Для получения разрешения на вывоз в рамках постановления № 312 необходимо руководствоваться приказом Росздравнадзора от 2 мая 2023 г. № 274410. Данным приказом установлены порядок подачи заявления, требования к его содержанию и прилагаемым документам, сроки рассмотрения заявления, основания для отказа в выдаче разрешения.
Постановлением № 311 установлен запрет вывоза иностранной продукции во все страны, кроме государств-членов Союза, Абхазии и Южной Осетии, а также ДНР и ЛНР.
При этом вывоз отдельных товаров, в рамках постановления № 311, в индивидуальных случаях может осуществляться по решениям Правительства Российской Федерации (оформляются поручениями Федеральной таможенной службе), подготовленным на основании предложений отраслевых федеральных органов исполнительной власти. Такие предложения формируются по итогам всестороннего анализа возможности возникновения дефицита товаров на внутреннем рынке, с учетом гарантий экспортеров о возврате вывозимых товаров, предварительного ввоза заменного фонда и прочих факторов.
Таким образом, предусмотрен механизм предоставления компаниям разрешений на вывоз продукции за пределы территории Российской Федерации в случае предоставления заинтересованной организацией документов, подтверждающих необходимость вывоза продукции, с приложением информации о товарах, которые планируются к вывозу с указанием кодов ТН ВЭД Евразийского экономического союза с детализацией до десятого знака, подробным описанием товара, указанием количества товаров и страны, в которую планируется вывозить соответствующую продукцию, информацией о том, кто будет выступать грузоотправителем с указанием ИНН/КПП.
Conclusion.
В условиях санкционного давления и учитывая социальную значимость медицинских изделий, законодательство Российской Федерации создает новые подходы регулирования обращения медицинских изделий, направленные на недопущение возникновения дефицита медицинских изделий и обеспечение граждан Российской Федерации качественными, безопасными и эффективными медицинскими изделиями.
_______________________________________________________________________
1 Постановление Правительства Российской Федерации от 1 апреля 2022 г. № 552 «Об утверждении особенностей обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера».
2 Постановление Правительства Российской Федерации от 29 декабря 2022 г. № 2525 «О внесении изменений в особенности обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера».
3 Приказ Росздравнадзора от 16 мая 2023 г. № 2983 «Об утверждении перечня представляемых документов и требований к их содержанию, формы заключения о возможности (невозможности) использования комплектующих или принадлежностей медицинского изделия, не предусмотренных в их технической и (или) эксплуатационной документации производителя (изготовителя), перечня сведений о комплектующих или принадлежностях медицинского изделия, не предусмотренных в их технической и (или) эксплуатационной документации производителя (изготовителя), публикуемых на официальном сайте федерального государственного бюджетного учреждения “Всероссийский научно-исследовательский и испытательный институт медицинской техники”» Федеральной службы по надзору в сфере здравоохранения в информационно-телекоммуникационной сети «Интернет».
4 Распоряжение Правительства Российской Федерации от 6 февраля 2021 г. № 256-р.
5 Постановление Правительства Российской Федерации от 9 февраля 2022 г. № 137 «О проведении на территории Российской Федерации эксперимента по маркировке отдельных видов медицинских изделий средствами идентификации».
6 Постановление Правительства Российской Федерации от 31 мая 2023 г. № 894 «Об утверждении Правил маркировки отдельных видов медицинских изделий средствами идентификации и особенностях внедрения государственной информационной системы мониторинга за оборотом товаров, подлежащих обязательной маркировке средствами идентификации, в отношении отдельных видов медицинских изделий».
7 Постановление Правительства Российской Федерации от 31 мая 2023 г. № 885 «Об утверждении Правил маркировки кресел-колясок средствами идентификации и особенностях внедрения государственной информационной системы мониторинга за оборотом товаров, подлежащих обязательной маркировке средствами идентификации, в отношении кресел-колясок».
8 Постановление Правительства Российской Федерации от 9 марта 2022 г. № 311 «О мерах по реализации Указа Президента Российской Федерации от 8 марта 2022 г. № 100».
9 Постановление Правительства Российской Федерации от 9 марта 2022 г. № 312 «О введении на временной основе разрешительного порядка вывоза отдельных видов товаров за пределы территории Российской Федерации».
10 Приказ Росздравнадзора от 2 мая 2023 г. № 2744 «Об утверждении Порядка выдачи разрешений на вывоз за пределы территории Российской Федерации отдельных видов товаров медицинского назначения по перечню согласно приложению № 6 к постановлению Правительства Российской Федерации от 9 марта 2022 г. № 312 «О введении на временной основе разрешительного порядка вывоза отдельных видов товаров за пределы территории Российской Федерации».
