DRUG PROVISION
Ensuring compliance with the requirements of the current legislation when dispensing medicines used for induced termination of pregnancy
1 — Territorial body of the Federal Service for Supervision of Healthcare in the Nizhny Novgorod region, 32, Varvarskaya str., Nizhny Novgorod, 603006, Russian Federation.
2 — Territorial body of the Federal Service for Supervision of Healthcare in the Nizhny Novgorod region, 32, Varvarskaya str., Nizhny Novgorod, 603006, Russian Federation.
3 — Territorial body of the Federal Service for Supervision of Healthcare in the Nizhny Novgorod region, 32, Varvarskaya str., Nizhny Novgorod, 603006, Russian Federation.
The article presents aspects of the legal regulation of the use of medicines for induced termination of pregnancy. Instructions for the medical use of these medicines contain an indication of their release to medical obstetric and gynecological institutions and exclude the release for individuals, including prescriptions from doctors, however, violations of the requirements continued to be recorded by control and supervisory authorities. The commissioning of the Federal State Track and Trace Information System of Medicines for medical use made it possible to pinpoint and timely identify violators and ensure drug safety of the population.
Keywords: medical abortion method, dispensing by pharmacies of medicines for induced termination of pregnancy, Federal State Track and Trace Information System of Medicines for medical use
Вопрос о недопустимости самостоятельного применения лекарственных препаратов для искусственного прерывания беременности – один из наиболее острых медико-социальных вопросов современной России, особенно в условиях негативных демографических тенденций, фиксируемых в стране не одно десятилетие подряд.
В статье 56 «Искусственное прерывание беременности» Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (далее – Закон № 323-ФЗ) определено, что каждая женщина имеет право самостоятельно решать вопрос о материнстве, а искусственное прерывание беременности проводится по желанию женщины при сроке беременности до двенадцати недель.
В соответствии с приказом Минздрава России от 20.10.2020 № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология”» (далее – приказ от 20.10.2020 № 1130н) медицинская помощь женщинам при искусственном прерывании беременности оказывается в рамках первичной специализированной медико-санитарной помощи и специализированной медицинской помощи в медицинских организациях, имеющих лицензию на осуществление медицинской деятельности, включая работы (услуги) по «акушерству и гинекологии (искусственному прерыванию беременности)». Для получения направления на искусственное прерывание беременности женщина обращается к врачу – акушеру-гинекологу, а в случае его отсутствия – к врачу общей практики (семейному врачу), медицинскому работнику фельдшерско-акушерского пункта, фельдшерских здравпунктов. Искусственное прерывание беременности в зависимости от срока беременности может быть проведено с использованием медикаментозного или хирургического метода.
В настоящее время лекарственными препаратами, зарегистрированными в Российской Федерации для медикаментозного прерывания беременности являются:
- МНН Мифепристон, таблетки 200 мг;
- МНН Мизопростол, таблетки 200 мкг.
Преимуществами метода являются: отсутствие риска, связанного с анестезией, отсутствие риска осложнений, связанных с хирургическим вмешательством, снижение риска развития восходящей инфекции и связанных с ней осложнений, неинвазивность метода, отсутствие психоэмоциональной травмы, возникающей при хирургическом аборте, снижение неблагоприятного влияния на дальнейшую репродуктивную функцию1.
В соответствии со статьей 56 Закона № 323-ФЗ и приказом от 20.10.2020 № 1130н искусственное прерывание беременности проводится:
1) не ранее 48 часов с момента обращения женщины в медицинскую организацию для искусственного прерывания беременности:
а) при сроке беременности четвертая – седьмая недели;
б) при сроке беременности одиннадцатая – двенадцатая недели, но не позднее окончания двенадцатой недели беременности;
2) не ранее семи дней с момента обращения женщины в медицинскую организацию для искусственного прерывания беременности при сроке беременности восьмая – десятая недели беременности.
При этом, согласно приказу от 20.10.2020 № 1130н, прерывание беременности медикаментозным методом должно проводиться врачом – акушером-гинекологом в амбулаторных условиях или в условиях дневного стационара с обязательным наблюдением женщины не менее 1,5–2 часов после приема лекарственных препаратов. После искусственного прерывания беременности женщинам с резус-отрицательной принадлежностью крови проводится иммунизация иммуноглобулином человека антирезус Rho(D) в соответствии с инструкцией по медицинскому применению лекарственного препарата. Также с каждой женщиной проводится консультирование, в процессе которого пациентка информируется о признаках возможных осложнений, при появлении которых ей следует незамедлительно обратиться к врачу; предоставляются рекомендации о режиме, гигиенических мероприятиях, возможной реабилитации, а также по вопросам профилактики абортов и необходимости сохранения и вынашивания следующей беременности. Контрольный осмотр врача – акушера-гинеколога при отсутствии жалоб проводится через 9–15 дней.
При медикаментозном методе прерывания беременности используются лекарственные препараты, зарегистрированные на территории Российской Федерации, в соответствии с инструкциями по медицинскому применению.
Мифепристон – синтетическое стероидное лекарственное средство для перорального применения, антагонист прогестероновых рецепторов. Препарат широко используется для медикаментозных абортов, зарегистрирован в более чем 40 странах мира. Обладая высоким сродством к рецепторам прогестерона, мифепристон действует как его антагонист. Механизм абортивного действия мифепристона основан на его антипрогестероновом эффекте, обусловленном блокированием действия прогестерона на уровне рецепторов в эндометрии и миометрии, что в свою очередь приводит к подавлению развития трофобласта, повреждению и отторжению децидуальной оболочки, появлению маточных сокращений, развитию менструальноподобного кровотечения, что клинически проявляется медикаментозным абортом1.
Мизопростол – синтетический аналог простагландина E1. Механизм абортивного действия связан с инициацией сокращения гладких мышц миометрия и расширения шейки матки. Способность мизопростола стимулировать сокращения матки облегчает раскрытие шейки и удаление содержимого полости матки. Мизопростол повышает частоту и силу сокращений миометрия, оказывая слабое стимулирующее действие на гладкую мускулатуру ЖКТ. Препарат должен применяться для прерывания беременности в комбинации с мифепристоном только в специализированных учреждениях, которые имеют соответствующим образом подготовленных медицинских работников1.
Следует обратить внимание, что кроме вышеперечисленного, Государственный реестр лекарственных средств содержит МНН Мифепристон, таблетки в дозировке 10 мг. Однако в инструкциях по медицинскому применению таких препаратов указано показание к применению «экстренная посткоитальная контрацепция в течение 72 часов». Кроме того, согласно инструкциям по медицинскому применению, доза мифепристона 10 мг недостаточна для того, чтобы вызвать аборт, поэтому до его дальнейшего применения следует провести высокочувствительный тест на беременность, гарантирующий, что данный препарат применяется только при отсутствии беременности. Таким образом, МНН Мифепристон в дозировке 10 мг не относится к лекарственным препаратам для медикаментозного прерывания беременности. Тем не менее, следует обратить внимание на значительное количество противопоказаний, побочных эффектов, ограничения по возрасту применения и, безусловно, рецептурный отпуск МНН Мифепристон в дозировке 10 мг2.
Инструкции по медицинскому применению лекарственных препаратов МНН Мифепристон, таблетки 200 мг; МНН Мизопростол, таблетки 200 мкг содержат указание на отпуск данных препаратов только в медицинские акушерско-гинекологические учреждения и исключают отпуск данных препаратов физическим лицам, в том числе и по рецептам врачей. Данное указание, несомненно, соотносится с вышеизложенными требованиями приказа от 20.10.2020 № 1130н.
Ограничения на проведение контрольных мероприятий, введенные постановлением Правительства Российской Федерации от 10.03.2022 № 336 «Об особенностях организации и осуществления государственного контроля (надзора), муниципального контроля», мероприятия по сокращению административного давления на бизнес, минимизация штрафов для бизнеса и замена штрафов на предупреждения, деликатность темы аборта и, следовательно, единичное число обращений в надзорные органы, – все эти факторы приводят к чувству вседозволенности и возможности руководства аптечных организаций осуществлять действия по реализации лекарственных препаратов по своему личному усмотрению.
Следует признать, что в настоящее время только Федеральная государственная информационная система мониторинга движения лекарственных препаратов для медицинского применения (далее – ФГИС МДЛП) дает возможность контрольным органам обеспечивать соблюдение требований действующего законодательства в части отпуска лекарственных препаратов.
В соответствии с Федеральным законом от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств», с 1 июля 2020 года в Российской Федерации введена обязательная маркировка лекарственных препаратов, которая позволяет проследить за движением каждой упаковки лекарственных препаратов, включая вывод из оборота конкретной аптечной или медицинской организацией.
Работа территориальных органов Росздравнадзора в ФГИС МДЛП осуществляется посредством личного кабинета в системе. Личный кабинет пользователя АРМ КО для контролирующего органа предназначен для выполнения функций по контролю за оборотом ЛП, возложенных на контролирующий орган3. Следует отметить, что каждый территориальный орган Росздравнадзора работает в личном кабинете с данными своего региона.
Наиболее простым методом мониторинга в ФГИС МДЛП является получение из системы, в соответствии со значениями полей фильтра, данных в разделе «Товары» (рис. 1).
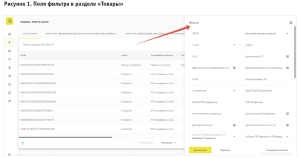
Указав в поле фильтра, например, МНН Мизопростол, в таблице будут отображаться только строки, соответствующие значениям, введенным в поля фильтра, то есть весь имеющийся в системе Мизопростол. В АРМ КО предусмотрена выгрузка (экспорт) данных из таблицы в файл в формате * .xls. и *.csv. Результат выгрузки данных можно посмотреть в разделе «Профиль», «Выгрузка данных»3.
Так, территориальным органом Росздравнадзора по Нижегородской области при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств, в ходе мониторинга ФГИС МДЛП, установлено, что в ряде аптечных организаций, имеющих лицензию на осуществление фармацевтической деятельности, были проданы в розницу лекарственные препараты МНН Мифепристон, таблетки 200 мг (примеры торговых наименований: «Миропристон», «Мифепристон»); МНН Мизопростол, таблетки 200 мкг (примеры торговых наименований: «Миролют», «Мизопростол»); согласно ФГИС МДЛП, тип вывода из оборота данных лекарственных препаратов указан как «Продан в розницу»). С 01.01.2022 по 01.03.2023, по данным ФГИС МДЛП, аптечными организациями, осуществляющими деятельность на территории Нижегородской области, было реализовано в розницу более 100 упаковок лекарственных препаратов МНН Мифепристон, таблетки 200 мг и более 190 упаковок лекарственных препаратов МНН Мизопростол, таблетки 200 мкг (рис. 2, 3).
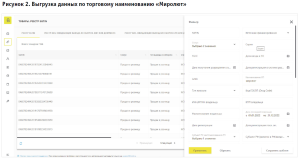
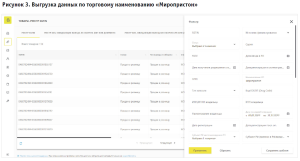
Медицинским работникам запрещается оформлять рецепты, в том числе на лекарственные препараты, которые в соответствии с инструкцией по медицинскому применению предназначены для применения только в медицинских организациях (п.7 Порядка назначения лекарственных препаратов, утвержденного приказом Минздрава России № 1094н от 24.11.2021 (далее – Порядок)).
Рецепт на бумажном носителе в форме электронного документа, оформленный с нарушением установленных настоящим Порядком требований, считается недействительным (п. 25 Порядка).
Рецепты, выписанные с нарушением правил, регистрируются в журнале, в котором указываются выявленные нарушения в оформлении рецепта, фамилия, имя, отчество (при наличии) медицинского работника, выписавшего рецепт, наименование медицинской организации, принятые меры, отмечаются штампом «Рецепт недействителен» и возвращаются лицу, представившему рецепт. О фактах нарушения правил оформления рецептов субъект розничной торговли информирует руководителя соответствующей медицинской организации (п. 20 Правил отпуска лекарственных препаратов для медицинского применения, утвержденных приказом Минздрава России № 1093н от 24.11.2021 (далее – Правила)).
Для обеспечения лечебного процесса в медицинской организации аптечной организацией, являющейся структурным подразделением такой медицинской организации, осуществляется отпуск либо изготовление и отпуск лекарственных препаратов на основании требования медицинской организации, выписанного уполномоченным медицинским работником. Медицинская организация вправе обратиться в стороннюю аптечную организацию при отсутствии аптечной организации, являющейся структурным подразделением такой медицинской организации (п. 28 Правил).
В связи с получением данных, содержащих сведения о признаках нарушений обязательных требований, а именно: ч. 2 ст. 55 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»; п. 6 Положения о лицензировании фармацевтической деятельности, утвержденного постановлением Правительства Российской Федерации № 547 от 31.03.2022, в части соблюдения лицензиатом, осуществляющим розничную торговлю лекарственными препаратами для медицинского применения: аптечной организацией, имеющей лицензию, – правил отпуска лекарственных препаратов для медицинского применения; пп. 20, 28 Правил, территориальным органом аптечным организациям направлены предостережения о недопустимости нарушения обязательных требований (направлено 15 предостережений).
По информации территориального органа Росздравнадзора по Нижегородской области о выявленных фактах, направленных в Прокуратуру Нижегородской области, последней организована проверка с привлечением специалистов территориального органа Росздравнадзора по Нижегородской области.
В период март-апрель 2023 г. сотрудники территориального органа Росздравнадзора по Нижегородской области приняли участие в 15 инициированных Прокуратурой Нижегородской области совместных проверках деятельности организаций здравоохранения.
В ходе проведения совместных мероприятий в деятельности 10 аптечных и 2 медицинских организаций выявлены нарушения требований действующего законодательства.
В ходе проверки выявлено, что отпуск лекарственных препаратов в аптечных организациях осуществлялся по рецептам, выписанным с нарушением Порядка. Также указанные рецепты не были зарегистрированы в журнале, в котором указываются выявленные нарушения в оформлении рецепта, фамилия, имя, отчество (при наличии) медицинского работника, выписавшего рецепт, наименование медицинской организации, принятые меры; данные рецепты не были отмечены штампом «Рецепт недействителен». Кроме того, субъект розничной торговли не проинформировал руководителя соответствующей медицинской организации о фактах нарушения правил оформления рецептов. Также отпуск лекарственных препаратов в аптечных организациях осуществлялся в отсутствие требования медицинской организации, выписанного уполномоченным медицинским работником.
По информации Прокуратуры Нижегородской области, аптечным и медицинским организациям прокурорами районов вынесены представления. Кроме того, в отношении аптечной организации прокурором района вынесено постановление о возбуждении дела об административном правонарушении по ч. 4 ст. 14.1 КоАП РФ, которое направлено в Арбитражный суд Нижегородской области.
Приобретая данные лекарственные препараты, граждане, возможно, обращаются в медицинские организации, не имеющие соответствующей лицензии (незаконное прерывание беременности), пытаются сэкономить на проведении «процедуры» в медицинской организации, либо осуществляют самостоятельное применение данных лекарственных препаратов, руководствуясь информацией из Интернета. Существенной мотивацией при этом может быть сохранение анонимности. Последствия таких «процедур» непредсказуемы и могут повлечь за собой тяжкие последствия, связанные с непосредственной угрозой жизни и здоровью граждан, а в долгосрочной перспективе – негативно повлиять на репродуктивный потенциал населения страны в целом.
Таким образом, приведенный пример обращения лекарственных препаратов МНН Мифепристон, таблетки 200 мг; МНН Мизопростол, таблетки 200 мкг говорит о необходимости усиления мер реагирования в отношении аптечных организаций, реализующих лекарственные препараты, предназначенные для искусственного прерывания беременности, и медицинских организаций, осуществляющих незаконную выписку рецептов на данные препараты. Одним из наиболее эффективных инструментов обеспечения соблюдения требований действующего законодательства при отпуске лекарственных препаратов, применяемых при искусственном прерывании беременности, безусловно, является федеральная государственная информационная система мониторинга движения лекарственных препаратов для медицинского применения, позволяющая точечно и своевременно выявлять нарушителей и обеспечивать лекарственную безопасность населения.
______________________________________________________________________
1 Письмо Минздрава России от 15.10.2015 № 15-4/10/2-6120 [О направлении клинических рекомендаций (протокол лечения) «Медикаментозное прерывание беременности»].
2 Государственный реестр лекарственных средств. – URL: https://grls.rosminzdrav.ru/
3 Руководство пользователей АРМ КО для контролирующих органов. – URL: https://ko.mdlp.crpt.ru/rukovodstvo_polsovatelya_ARM_KO.pdf//
