STATE CONTROL AND SUPERVISION
Legal regulation of the circulation of the software as a medical device
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
2 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
The article describes the main achievements in improving legal regulation in the field of circulation of software as a medical device, including the use of artificial intelligence technologies. The main prospects for the development of regulation in relation to this type of product are considered.
Keywords: medical devices, software, state registration
В период с 2019 по 2021 гг. нормативно-правовое регулирование программного обеспечения, являющегося медицинским изделием, сделало резкий шаг вперед. Предпосылкой изменений стало принятие Указа Президента Российской Федерации от 10.10.2019 № 490 «О развитии искусственного интеллекта в Российской Федерации», утвердившего Национальную стратегию развития искусственного интеллекта на период до 2030 г. В данном документе:
- Сформулированы основные базовые понятия, используемые в области искусственного интеллекта, в том числе определение самого искусственного интеллекта.
Согласно данному указу, под «искусственным интеллектом» понимается комплекс технологических решений, позволяющий имитировать когнитивные функции человека (включая самообучение и поиск решений без заранее заданного алгоритма) и получать при выполнении конкретных задач результаты, сопоставимые, как минимум, с результатами интеллектуальной деятельности человека. При этом комплекс технологических решений включает в себя информационно-коммуникационную инфраструктуру, программное обеспечение (в том числе, в котором используются методы машинного обучения), процессы и сервисы по обработке данных и поиску решений.
- Определены приоритетные направления развития и использования технологий искусственного интеллекта. В частности, одним из таких направлений является использование технологий искусственного интеллекта в социальной сфере в целях способствования созданию условий для улучшения уровня жизни населения, в том числе за счет повышения качества услуг в сфере здравоохранения (включая профилактические обследования, диагностику, основанную на анализе изображений, прогнозирование возникновения и развития заболеваний, подбор оптимальных дозировок лекарственных препаратов, сокращение угроз пандемий, автоматизацию и точность хирургических вмешательств).
- Определены цели и основные задачи развития искусственного интеллекта, а также механизмы его развития, в том числе в части создания и развития информационно-коммуникационной инфраструктуры для обеспечения доступа к наборам данных.
Также в 2019 г. в Росздравнадзоре под председательством руководителя ведомства было проведено рабочее совещание с субъектами обращения медицинского программного обеспечения, по итогам которого на площадке Росздравнадзора при поддержке Минздрава России была создана профильная рабочая группа, целью которой стала выработка консолидированной позиции в части нормативно-правового регулирования вопросов обращения программного обеспечения, являющегося медицинским изделием. Именно с этого момента началась активная работа по пересмотру и совершенствованию законодательства в данной сфере. Первым этапом данной работы стало определение того, что же из всего многообразия программного обеспечения является медицинским изделием.
По итогам обсуждения были сформулированы Критерии отнесения продукции к медицинским изделиям в части программного обеспечения (далее – Критерии), которые были одобрены на заседании Комиссии ФГБУ «ВНИИИМТ» Росздравнадзора по выдаче заключений на запросы, связанные с обращением медицинских изделий. На основании выписки из протокола данного заседания было выпущено письмо Росздравнадзора от 13.02.2020 № 02И-297/20 «О программном обеспечении». Указанное информационное письмо размещено на официальном сайте Росздравнадзора в разделе «Регистрация медицинских изделий».
В соответствии с Критериями программное обеспечение является медицинским изделием при условии соответствия его всем следующим критериям:
- программное обеспечение представляет собой программу для ЭВМ или ее модули вне зависимости от используемой аппаратной платформы, а также способов размещения программного обеспечения и предоставления доступа к нему;
- программное обеспечение не является составной частью другого медицинского изделия;
- программное обеспечение предназначено производителем для оказания медицинской помощи;
- результат действия программного обеспечения заключается в интерпретации в автоматическом режиме, в том числе с использованием технологий искусственного интеллекта, или по заданным медицинским работником параметрам, влияющим на принятие клинических решений, набора данных, полученных от медицинских изделий, допущенных к обращению в установленном порядке или введенных медицинскими работниками в целях оказания медицинской помощи.
Также в Критериях приведены примеры:
- методов и технологий, применяемых в функциях программного обеспечения, которые не являются интерпретацией данных;
- программного обеспечения, которое относится к медицинским изделиям, и программного обеспечения, которое медицинским изделием не является.
Следующим шагом стало определение и установление классификации программного обеспечения, являющегося медицинским изделием, как по классам потенциального риска применения, так и по видам номенклатурной классификации.
Итогом данной работы стало издание приказа Минздрава России от 07.07.2020 № 686н, который, в свою очередь, внес изменения в приказ Министерства здравоохранения Российской Федерации от 06.06.2012 № 4н «Об утверждении номенклатурной классификации медицинских изделий». Указанным приказом в номенклатурной классификации медицинских изделий по видам для программного обеспечения, являющегося медицинским изделием, выделена отдельная группа, которая в настоящее время включает в себя более 90 видов.
Также данным приказом была установлена принципиально новая классификация в отношении программного обеспечения, являющегося медицинским изделием, по классам в зависимости от потенциального риска их применения. Вместо ранее действующей нормы, предусматривающей установление для специального программного обеспечения, являющегося самостоятельным продуктом и используемого с медицинским изделием, того же класса, что и для самого медицинского изделия, в настоящее время для оценки класса потенциального риска применения введен матричный принцип.
Указанный принцип гармонизирован с международным документом IMDRF/SaMD WG/N12FINAL:2014 Software as a Medical Device: Possible Framework for Risk Categorization and Corresponding Considerations и заключается в том, что присвоение класса потенциального риска применения для программного обеспечения, являющегося медицинским изделием, происходит по результатам как оценки влияния полученных результатов работы программного обеспечения, так и его предназначения.
Одним из самых весомых результатов, достигнутых в 2020 г., стало издание Постановления Правительства Российской Федерации от 24.11.2020 № 1906, которое внесло изменения в Правила государственной регистрации медицинских изделий.
Указанным нормативным правовым актом введена одноэтапная процедура государственной регистрации программного обеспечения, являющегося медицинским изделием, в том числе программного обеспечения с применением технологий искусственного интеллекта: клинические испытания таких изделий вне зависимости от класса потенциального риска их применения проводятся до подачи заявления о государственной регистрации без получения разрешения на их проведение.
Кроме того, указанное изменение подразумевает и значительное сокращение сроков прохождения процедуры государственной регистрации программного обеспечения, являющегося медицинским изделием.
В целях приведения законодательства в соответствие с данной нормой был издан приказ Минздрава России от 22.04.2021 № 386н «О внесении изменений в приказ Министерства здравоохранения Российской Федерации от 20 марта 2020 г. № 206н “Об утверждении Порядка организации и проведения экспертизы качества, эффективности и безопасности медицинских изделий”». Данный приказ вступает в силу 1 сентября 2021 года.
Второй нормой, введенной Постановлением Правительства Российской Федерации от 24.11.2020 № 1906, является отмена необходимости представления сведений о выданных регистрирующим органом разрешениях на ввоз программного обеспечения, являющегося медицинским изделием, в том числе программного обеспечения с применением технологий искусственного интеллекта. Указанная норма закреплена также в новом Порядке ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации, утвержденном приказом Минздрава России от 30.06.2020 № 661н, вступившем в силу 1 января 2021 г. и предусматривающем, что получение разрешения на ввоз для программного обеспечения, являющегося медицинским изделием, не требуется.
Также 1 января 2021 г. вступил в силу приказ Минздрава России от 20.11.2020 № 1236н, который внес изменения в Требования к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинского изделия.
Данным приказом установлены требования к содержанию технической и эксплуатационной документации производителя (изготовителя) на программное обеспечение, являющееся медицинским изделием. Данные требования были сформулированы с учетом специфических свойств и уникальных характеристик программного обеспечения. Например, ими предусмотрено указание в документации производителя разъяснения порядка нумераций версий программного обеспечения, сведений об источнике набора данных, аппаратной платформе, способе размещения программного обеспечения, являющегося медицинским изделием, информации о протоколах обмена данными для использования вместе с другими медицинскими изделиями и так далее.
По итогам принятия перечисленных документов были актуализированы и размещены на официальном сайте Росздравнадзора Методические рекомендации по порядку проведения экспертизы качества, эффективности и безопасности медицинских изделий (в части программного обеспечения) для государственной регистрации в рамках национальной системы.
Каковы же перспективы развития нормативно-правового регулирования в сфере обращения программного обеспечения, являющегося медицинским изделием?
Если говорить про национальное законодательство, то одним из направлений развития является конкретизация принципов проведения клинических испытаний с внесением изменений в Порядок проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий.
Другим важным направлением является разработка особой процедуры внесения изменений в документы, содержащиеся в регистрационном досье программного обеспечения, являющегося медицинским изделием. Данный вопрос является очень непростым в реализации, учитывая специфику продукции, но очень важным и актуальным как для пользователей, так и для регуляторов, с учетом практически еженедельного, если не ежедневного, внесения изменений в программные продукты.
Если говорить про законодательство Евразийского экономического союза, то 29 июня 2021 г. рекомендацией Коллегии Евразийской экономической комиссии № 15 внесены изменения в Критерии отнесения продукции к медицинским изделиям в рамках Евразийского экономического союза, в том числе в части программного обеспечения, являющегося медицинским изделием.
Кроме того, ведется разработка проектов по внесению изменений в Правила классификации медицинских изделий в зависимости от потенциального риска применения, утвержденные решением Коллегии Евразийской экономической комиссии от 22.12.2015 № 173, и в Правила проведения клинических и клинико-лабораторных испытаний (исследований) медицинских изделий, утвержденные решением Совета Евразийской экономической комиссии от 12.02.2016 № 29.
Последним, но не менее важным вопросом является контроль качества, безопасности и эффективности использования программного обеспечения с применением технологий искусственного интеллекта. Следует отметить, что указанные изделия являются чрезвычайно сложными продуктами с точки зрения оценки их качества, эффективности и безопасности. Особенность программного обеспечения с применением технологий искусственного интеллекта заключается в том, что в связи с самообучением алгоритма необходим постоянный контроль правильности принятия им решения.
Одним из возможных решений этой задачи является формирование на основе охарактеризованных данных контрольных наборов данных (data set) с целью регулярной проверки правильности результата работы искусственного интеллекта (см. рис.).
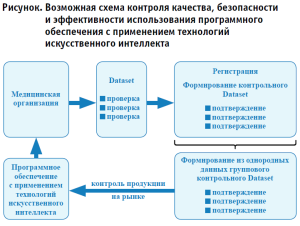
Для реализации такого подхода необходимо обеспечить фиксацию всех решений, возможность автоматизированного предоставления сведений о неблагоприятных событиях в Росздравнадзор и открытость таких систем для контроля. Вместе с тем описанный подход, с одной стороны, обеспечит безопасность программных продуктов, с другой – свободу производителям в выводе таких продуктов на рынок и их развитие.
