DRUG PROVISION
Monitoring of compounding pharmacies in the Russian Federation for 2023–2024 (part 1)
1 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
2 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
3 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.; Federal State Budgetary Educational Institution of Higher Education “A.I. Yevdokimov Moscow State University of Medicine and Dentistry” of the Ministry of Healthcare of the Russion Federation, 20, Delegatskaya str., building 1, Moscow, 127473, Russian Federation.
ORCID: https://orcid.org/0000-0003-2397-6578
4 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
5 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
6 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
7 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0003-4609-0155
8 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0001-6297-9304
9 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0001-5061-0729
10 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0003-0256-6692
11 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0002-2805-3089
12 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0002-5483-6626
This study presents for the first time the expanded results of an independent and maximally comprehensive audit (monitoring) of medical and pharmacy organizations operating in Russia that have a license for pharmaceutical activities with the right to compounding drugs. The study is carried out in two interconnected parts.
The first part describes the methodology in detail, for the first time presents the most accurate number of operating compounding pharmacies, including their territorial distribution, organizational and legal forms, and determines the number of pharmacies that have the right to compounding narcotic drugs and psychotropic substances.
Keywords: methods of personalized medicine, health-saving technologies, high-tech healthcare, compounding pharmacies, extemporaneous drugs, prescription and compounding departments of a pharmacy organization, compounding and dispensing of medicinal products, stock preparation, in-pharmacy packaging of registered medicinal products
Background.
На старте реализации новых национальных проектов «Продолжительная и активная жизнь», «Новые технологии сбережения здоровья», основу которых составляет взаимная интеграция и реализация системного подхода по достижению национальных целей развития, определенных Президентом Российской Федерации (далее – РФ)1, существенная роль отводится необходимости обеспечить технологическую независимость, лекарственную безопасность и сформировать новые рынки по направлениям сбережения здоровья граждан, а также в части перехода к персонализированной, предиктивной и профилактической медицине, высокотехнологичному здравоохранению, в том числе за счет рационального применения лекарственных препаратов для медицинского применения (далее – ЛП), использования генетических данных и технологий.
Во исполнение конституциональных прав граждан на охрану здоровья требуется максимально повысить качество медицинской, фармацевтической помощи населению, в том числе с социально значимыми заболеваниями, существенно нарастить физическую и территориальную доступность как жизненно необходимых и важнейших ЛП (далее перечень – ЖНВЛП), так и самых современных, высокотехнологичных и передовых методов лечения во всех секторах – амбулаторном и госпитальном звене. Основу всеобъемлющего доступа к лекарственной терапии, применяемой в составе методов персонализированной медицины, составляет наличие возможностей для дальнейшего развития на базе медицинских, аптечных организаций (далее соответственно – МО, АО) и их обособленных подразделений – инфраструктуры здравоохранения, которая будет обладать необходимыми компетенциями в разработке, проведении испытаний, освоении, внедрении передовых и важнейших технологий изготовления ЛП, а также будет способна предоставить и обеспечить бесперебойный, своевременный и незамедлительный доступ к персонифицированной терапии, высокотехнологичным и новым методам лечения пациентам, вне зависимости от территориального признака по месту жительства гражданина и (или) месту его регистрационного учета. Такая инфраструктура здравоохранения способна наиболее гибко и оперативно реагировать на изменения объемов, потребностей, в том числе при возникновении дефицита или дефектуры ЛП, угроз распространения заболеваний, представляющих опасность для окружающих и (или) обеспечения необходимыми ЛП пострадавших в чрезвычайных ситуациях [1, 2, 3, 4], и полностью ориентирована на фактические потребности клинической практики, что, в свою очередь, как минимум, в определенных условиях позволяет сокращать операционные вложения при укрупнении сети на территории одного или нескольких субъектов РФ.
Особое внимание должно уделяться сохранению и укреплению здоровья детского населения. Важно, чтобы каждому ребенку была доступна квалифицированная медицинская и фармацевтическая помощь. Для этого в рамках национальных проектов определены задачи по активному внедрению современных технологий профилактики, диагностики, лечения и медицинской реабилитации детей, созданию новых ЛП. В этом смысле деятельность по изготовлению ЛП обеспечивает необходимую широту диапазона востребованных дозировок, комбинаций действующих веществ и соответствующих лекарственных форм (далее – ЛФ), предназначенных для их удобного и комфортного приема ребенком [5, 6, 7, 8, 9]. В ряде случаев решающее значение имеет своевременное обеспечение детского населения ЛФ, промышленное производство которых отсутствует по различным причинам, а следовательно – укрепление действующих производственных аптек (далее – ПА) и материально-технической базы перинатальных центров, детских поликлиник, больниц, что отвечает принципам необходимости освоения критически значимых технологий. Особо важно подчеркнуть положения постановления Совета Федерации Федерального Собрания РФ от 15.02.2023 № 49-СФ2, в которых отмечаются принимаемые меры, которые позволяют существенно сократить младенческую смертность в РФ. При этом пп. 5 п. 9 указанного документа органам государственной власти субъектов РФ рекомендовано обеспечить функционирование ПА в соответствии с Федеральным законом от 05.12.2022 № 502-ФЗ3 и в связке с пп. 6 п. 3 рекомендаций Правительству РФ обеспечить дальнейшую модернизацию инфраструктуры объектов детского здравоохранения в рамках проведения Десятилетия детства (2018– 2027 гг.), объявленного Указом Президента РФ от 29.05.2017 № 2404, что в целом повышает актуальность настоящего исследования, имеет еще большее и принципиальное значение, потому как показатели заболеваемости и младенческой смертности отражают как общее благосостояние населения, так и эффективность государственной политики, работы системы здравоохранения в области охраны здоровья матери и ребенка в соответствии правами, которые предусмотрены гл. 6 Федерального закона от 21.11.2011 № 323-ФЗ5.
Для медицины и фармации главный вопрос – кадры. В связи с более длительными сроками подготовки квалифицированных специалистов, по сравнению с другими профессиями, необходимо предусмотреть усиление не только качественной, но и количественной подготовки молодых специалистов по номенклатуре медицинских и фармацевтических работников, а также предусмотреть возможность получения ими углубленных знаний и компетенций, прохождения переподготовки, повышения квалификации в ходе реализации программ дополнительного профессионального образования в рамках системы непрерывного медицинского и фармацевтического образования [10–16]. В части возможного снижения или устранения дефицита фармацевтических работников для ПА, представляется обоснованной необходимость внедрения механизма «раннего (ускоренного) допуска» к осуществлению фармацевтической деятельности в ПА для специалистов с высшим фармацевтическим образованием на базе программ дополнительного профессионального образования, либо через поэтапный (дискретный) механизм обучения (п. 11 ст. 82 Федерального закона от 29.12.2012 № 273-ФЗ6), включая прохождение аттестации (итоговой аттестации) с присвоением квалификации, позволяющей занимать должности «провизор-аналитик», «провизор-технолог» (возможно, «провизор-аналитик стажер», «провизор-технолог стажер»). С точки зрения развития деятельности по изготовлению ЛП, всесторонне выверенные решения по совершенствованию программ фармацевтического образования будут качественно влиять на достижение ряда показателей, в том числе предусмотренных в составе национальной цели «Реализация потенциала каждого человека, развитие его талантов, воспитание патриотичной и социально ответственной личности».
В последнее десятилетие активно развивается гармонизация фармацевтического законодательства на наднациональном уровне стран Евразийского экономического союза. Уже действует целый ряд надлежащих практик и регламентов, которые помогают эффективно развивать фармацевтические рынки [17, 18]. Однако единственным отсутствующим в настоящее время элементом являются единые, гармонизированные правила надлежащей практики изготовления и отпуска ЛП, которые были бы применимы по отношению к организации деятельности по изготовлению ЛП, вне зависимости от их типов, видов, ЛФ и назначаемых комбинаций действующих веществ. В данном направлении актуальным является углубленное изучение мирового опыта по организации деятельности в сфере индивидуального и мелкосерийного изготовления ЛП различных классов (радиофармацевтических, биологических, биотехнологических, высокотехнологичных и других видов лекарственной терапии) [19] и, в частности, дальнейшее продвижение по пути сближения регуляторных требований об обращении лекарственных средств (далее – ЛС) в рамках межгосу дарственных объединений (союзов), транс региональных партнерств (сообществ) ЕАЭС и БРИКС, выработка лучших практик и «золотых» стандартов по организации соответствующего социально значимого вида деятельности. Такой подход может привести к созданию единой системы надлежащих аптечных практик, где задача по проведению соответствующих исследований может отводится научным центрам мирового уровня или национальным фармацевтическим исследовательским центрам, которые только предстоит создать в России. [20].
Наличие доступа к консолидированным сведениям, структурированным и обработанным данным о деятельности ПА, в частности: состоянии действующей инфраструктуры здравоохранения в сфере изготовления ЛП; сохранившейся фармацевтической деятельности на базе МО и АО (деятельности ПА); количественных показателях ежегодных объемов индивидуально изготовленных ЛП, в том числе в виде внутриаптечной заготовки (далее – ВАЗ); высокой востребованности индивидуальной (внутриаптечной) фасовки зарегистрированных ЛП; уровне дефектуры или дефицита по структурированной потребности в исходном сырье, материалах и фармацевтических субстанциях (далее – ФС), в том числе в малых фасовках; наличии критического порога или дефицита квалифицированных фармацевтических работников, в том числе по направлениям подготовки «Фармацевтическая технология» и «Фармацевтическая химия и фармакогнозия», обеспечения качества, клинической фармакологии, задействованных в изготовлении ЛП; – в совокупности имеет ключевое значение при принятии выверенных и скоординированных управленческих решений. Такие данные способствуют наиболее точному определению направлений развития требований к качеству экстемпоральных ЛП (далее – ЭЛП), включая определение подходов к их экспресс-анализу, разработке необходимых фармакопейных статей на фармацевтические субстанции для изготовления ЛП, фармакопейных статей на часто встречающиеся прописи экстемпоральных ЛП [21, 22].
В целях повышения устойчивости лекарственного обеспечения населения, определения перспективных направлений в области научно-технического развития сферы изготовления ЛП и стратегически значимых мероприятий по развитию персонализированной, предиктивной и профилактической медицины, перехода к высокотехнологичному здравоохранению и технологиям здоровьесбережения, в т. ч. за счет рационального применения ЛП, а также уточнения ключевых инициатив и консолидации предложений по совершенствованию законодательного и нормативного правового регулирования деятельности ПА, членами Рабочей группы по подготовке к реализации норм Федерального закона от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона “Об обращении лекарственных средств”» при Комитете Государственной Думы по охране здоровья (далее – Рабочая группа), совместно с Федеральным государственным бюджетным образовательным учреждением высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, инициировано настоящее исследование, посвященное мониторингу МО и АО, осуществляющих фармацевтическую деятельность с правом изготовления и отпуска ЛП, и обзору лучших практик на территории РФ за 2023–2024 гг. (далее – Мониторинг).
Исследование выполнено в виде двух взаимосвязанных частей, в первой части подробно раскрыты методология работы, количественные и качественные показатели функционирования производственных аптек, включая их территориальное распределение, организационно-правовые формы, кадровый состав. Во второй части проведен детальный анализ спроса на изготавливаемые ЛП, потребности в фармацевтических субстанциях, особенности работы АО различного типа. Рассмотрены лучшие практики организации работы ПА в регионах России. Особое внимание уделено вопросам технического оснащения и регуляторным аспектам деятельности.
Материалы и методы
Мониторинг проведен согласно п. 2 протокола заседания Рабочей группы № 4 от 25 июня 2024 г. В качестве материалов использованы открытые данные Единого реестра лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности Росздравнадзора по состоянию на 10 июля 2024 г. (далее – Реестр РЗН)7. Анализ данных и обработка анкет осуществлена с использованием MS Excel, графическое представление информации выполнено в MS PowerPoint.
В проведенной работе применены эмпирические методы исследования. В частности, использован опросный метод в форме дистанционного анкетирования (как устного, так и письменного), что позволило:
- уточнить количество МО и АО, сохранивших деятельность по изготовлению ЛП;
- провести систематизацию имеющихся и ранее полученных сведений, выполнить анализ новых данных;
- определить номенклатуру направлений и перспективных задач фармацевтической промышленности для повышения уровня обеспеченности ПА исходным сырьем;
- уточнить объемы неудовлетворенных потребностей в исходном сырье, которые в совокупности могут служить ориентиром для поставщиков и производителей ЛС;
- конкретизировать направления в области научно-технического развития сферы изготовления ЛП;
- подтвердить обоснованность ранее разработанных ключевых инициатив по совершенствованию законодательного и нормативного правового регулирования деятельности ПА, необходимым мерам государственной поддержки инфраструктуры, осуществляющей социально значимый вид деятельности посредством консолидации предложений фармацевтических работников.
Экспериментальная часть Мониторинга (опрос в форме дистанционного анкетирования) проведена в период с 01 августа 2024 г. по 23 октября 2024 г.
Основу Мониторинга составила разработанная в предшествующем исследовании [23] форма анкеты, которая была усовершенствована авторами настоящей работы и включила в себя 16 системных блоков для последующей консолидации сведений о юридических лицах (далее – ЮЛ); наличии лицензий на фармацевтическую деятельность (регистрационный номер); количестве аптек ЮЛ с правом на изготовление и отпуск ЛП, а также общем количестве аптек ЮЛ; фактических адресах (местах) осуществления лицензируемого вида деятельности; видах и подвидах аптек по перечню выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность (приказ Минздрава России от 31.07.2020 № 780н; далее – Приказ № 780)8; площадях помещений, задействованных при осуществлении деятельности по изготовлению ЛП; количестве фармацевтических работников, задействованных при осуществлении деятельности по изготовлению ЛП; объемах изготовленных ЛП в количественном выражении, в том числе в виде ВАЗ с градацией на вид отпуска, а также объемах расфасованных ФС, которые отпускаются в виде изготовленного ЛП (моноформы по количеству веществ в составе) и зарегистрированных ЛП, прошедших процедуру внутриаптечной фасовки по требованиям МО.
Уникальными блоками анкеты и Мониторинга, которые были включены на основании п. 2 Протокола № 4 от 25 июня 2024 г. заседания Рабочей группы, стали: определение натуральных выражений фактической потребности по номенклатуре ФС в трехлетней динамике; выявление неудовлетворенной потребности в малых фасовках ФС; определение объемов и номенклатуры используемых при изготовлении зарегистрированных ЛП. Также новой задачей исследования стал блок по формированию раздела с «лучшими практиками», содержащий сведения: об участии ПА в реализации национальных проектов, грантов, субсидий и других мер государственной поддержки федерального и регионального уровней; о вкладе ПА в социально-экономическое развитие РФ в части повышения качества функционирования системы лекарственного обеспечения и доступности ЛП. Результаты исследования по последнему блоку содержат различную информацию, которая может уточняться в дальнейшем и использоваться для подтверждения потенциала ПА по внесению вклада в достижение целевых показателей научно-технологического развития РФ в части перехода к персонализированной, предиктивной и профилактической медицине, высокотехнологичному здравоохранению и технологиям здоровьесбережения, в т.ч. за счет рационального применения ЛП (прежде всего антибактериальных) и использование генетических данных и технологий, установленных Указом Президента РФ от 28.12.2024 № 1459 и Указом Президента РФ от 18.06.2024 № 52910.
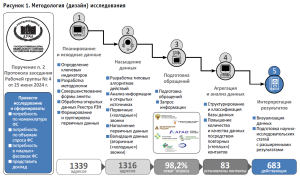
Методология (дизайн) исследования (рис. 1) основывалась на последовательном выполнении следующих мероприятий, позволяющих говорить о высокой степени достоверности полученных результатов работы:
- Выгрузка и анализ сведений Реестра РЗН (исходно 1342 адреса):
- установление фильтра по видам фармацевтической деятельности, указанным в лицензии (ключевое слово «изготовление»);
- удаление дублирований по адресу осуществления фармацевтической деятельности (три адреса);
- формирование базы данных ПА (1339 адресов11).
- Сопоставление сведений Реестра РЗН с фактическими сведениями о функционировании ПА в России, включая совершенствование базы данных контактов для последующего сбора аналитических данных в соответствии с разработанной анкетой, последовательно реализовано посредством:
- разработки двух типовых алгоритмов действий («скриптов») при взаимодействии с фармацевтическими работниками ПА, содержащих восемь сценариев;
- поиска контактной информации по адресам изготовления ЛП в сети «Интернет» (1316 адресов);
- осуществления первичных («холодных») звонков в МО и АО по сформированной базе данных ПА, в результате которых получено 462 утвердительных ответа об осуществлении деятельности по изготовлению ЛП, при этом на данном этапе были исключены контакты с ПА, входящими в структуру «государственных (региональных) фармаций» Москвы и Санкт-Петербурга, а также ПА, расположенной на территории космодрома Байконур);
- наполнения базы данных ПА информацией о фактическом осуществлении деятельности по изготовлению ЛП, в том числе полученной по результатам предыдущего исследования, а также структурирование информации данного этапа;
- валидации данных первичных звонков (их проверка по критериям корректности и полезности для дальнейшего применения), проведенной вторичными звонками в целях исключения человеческого фактора, что реализовано по случайной выборке адресов, где 365 подтвердили ранее полученные утвердительные ответы об осуществлении деятельности по изготовлению ЛП (доля валидации данных достигла 79,0%).
- Подготовка обращений в адрес руководителей МО и АО, некоммерческих и саморегулируемых организаций, органов государственной власти субъектов РФ (при необходимости), Минздрав России, Минпромторг России, Росздравнадзор в целях информирования о проведении Мониторинга, включая запрос дополнительных сведений в сфере изготовления ЛП, а также осуществление рассылки анкет по почтовым адресам и запрос данных с учетом контактной информации, которая была получена в результате предшествующего исследования [23].
- Сбор, анализ и консолидация данных по полученным ответам. На данном этапе также реализованы дополнительные мероприятия по заполнению данных анкеты респондентами, которые проводились в случаях ее непредставления или предоставления части данных – выполнялись повторные («теплые») звонки в МО и АО, в том числе подтвердивших осуществление деятельности в ходе первичных («холодных») и (или) вторичных звонков. Кроме того, установлено отсутствие сведений об 1 (одном) ЮЛ с 1 (одним) адресом ведения деятельности по изготовлению ЛП, которое, в соответствии с Реестром РЗН, не обладает поименованным правом, но было готово осуществить изготовление ЛП. Выявленный факт интерпретирован тем, что организация возобновила деятельность и в период осуществления Мониторинга реализовывала мероприятия по внесению изменений в реестр лицензий на осуществление фармацевтической деятельности. Таким образом, в результате данного этапа структурирована информация в отношении двух категорий: 659 адресов, по которым при выполнении п. 1–2 методологии получены ответы / обратная связь и 681 адрес, по которому при выполнении п. 1–2 методологии не была представлена какая-либо значимая информация о фактах осуществления деятельности в сфере изготовления ЛП. При этом реализованные повторные («теплые») звонки в МО и АО на данном этапе позволили повысить качество Мониторинга, увеличить количество и уточнить данные по 109 адресам.
- Визуализация данных и интерпретация результатов. Случаи повторного непредставления анкеты и (или) ответа, а также отказа от предоставления данных, в том числе в связи с отнесением информации к «коммерческой тайне», определены как ограничения настоящего исследования, однако в целях проведения оценки объема площадей инфраструктуры, потенциально нуждающейся в модернизации материально-технической базы, обеспечения полноты и минимизации отклонений от фактического состояния сферы изготовления ЛП была использована методика экстраполяции результатов фактического количества общих площадей действующих ПА Мониторинга, разработанная в предыдущем исследовании [23].
По мнению авторов, основным ограничением и препятствием для исследования явилось отсутствие реализованного в нормативном правовом поле механизма, порядка и (или) процедуры предоставления отчетности о деятельности ПА в адрес уполномоченных органов государственной власти и (или) организации, формируемой по итогам за год (период), в том числе электронного в рамках определенного модуля (подсистемы) Единой государственной информационной системы в сфере здравоохранения. Данный тезис подтверждается значительным количеством случаев практики как при письменном: «Информация по используемым фармацевтическим субстанциям, готовым лекарственным формам зарегистрированных лекарственных препаратов не может быть представлена по причине отсутствия автоматического учета данных в производственном отделе аптеки», так и при устном взаимодействии с фармацевтическими работниками. Заполнение определенного объема данных в сочетании с вышеуказанным ограничением по отсутствующей системе единой отчетности требует значительных ресурсов со стороны специалистов, задействованных при изготовлении ЛП, а также тесно сопряжено с мотивационными факторами, влияющими на побуждение в предоставлении сведений о показателях деятельности, при одновременном наличии дисфункциональных глубинных убеждений об отсутствии системных решений и политической воли как по развитию условий осуществления указанной деятельности, так и ожидаемому уровню поддержки в развитии профессии, что в совокупности может существенно сказаться на результатах последующих мониторингов и различных опросов в случаях постановки таких задач на различных уровнях, в том числе в рамках научно-исследовательских целей.
В данном ключе как с точки зрения развития и повышения эффективности осуществления деятельности, компетентного планирования при модернизации действующей инфраструктуры, так и с точки зрения дальнейшего совершенствования регулирования деятельности по изготовлению ЛП, мы сохраняем рекомендации о необходимости рассмотрения данного вопроса об определении Правительством РФ учреждения или организации с присвоением статуса государственного научного центра РФ в сфере изготовления ЛП, который может быть определен в соответствии с Указом Президента РФ от 22.06.1993 № 93912 и п. 2 ст. 5 Федерального закона от 23.08.1996 № 127-ФЗ13 или инициации процесса создания научно-образовательного центра мирового уровня в сфере изготовления ЛП, организуемого на основе интеграции образовательных организаций высшего образования, научных организаций и их кооперации с организациями, действующими в реальном секторе экономики или наделение Правительства РФ (соответствующего федерального органа исполнительной власти) необходимыми полномочиями.
В результате вышеописанной методологии исследования сделан вывод, что по итогам выполнения всех ее мероприятий и этапов получены достоверные сведения о фактах осуществления деятельности в сфере изготовления ЛП по 683 адресам, что составило ключевой тезис исследования: «По состоянию на октябрь 2024 года на территории Российской Федерации осуществляют деятельность по изготовлению лекарственных препаратов не менее 683 производственных аптек и (или) рецептурно-производственных отделов аптечных организаций по адресам осуществления деятельности, действующих в структуре 505 юридических лиц», раскрытый в следующем разделе.
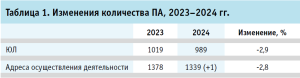
Результаты и обсуждение Количество действующих производственных аптек, их распределение по территориальному признаку и формам хозяйствующих субъектов. В соответствии с результатами анализа сведений Реестра РЗН, по состоянию на 10 июля 2024 г., правом на изготовление ЛП в 2024 г. обладали 989 ЮЛ, которые осуществляли свою деятельность по 1339 (+1) адресам14. Установлено, что в соответствии с реестром РЗН ПА отсутствуют в Республике Ингушетия, а также на момент проведения исследования отсутствуют сведения об их наличии на территории новых субъектов РФ15. При этом, в сравнении с данными Реестра РЗН по состоянию на 28 марта 2023 г., за прошедший период количество ЮЛ и указанных адресов осуществления деятельности сократилось на 2,9% и 2,8% соответственно (табл. 1).
Несмотря на общее снижение количества ЮЛ и адресов, зафиксировано появление новых 22 ЮЛ с 25 новыми заявленными адресами осуществления деятельности по изготовлению ЛП, что составляет 2,2% и 1,9% от общего числа ЮЛ и адресов соответственно, из которых:
- шесть ЮЛ ранее не имели лицензию на осуществление фармацевтической деятельности с правом изготовления ЛП или не осуществляли изготовление ЛП по указанному в лицензии адресу;
- четыре ЮЛ получили лицензию на фармацевтическую деятельность с правом изготовления радиофармацевтических ЛП (далее – РФЛП) и ранее не обладали лицензией на изготовление ЛП;
- шесть ЮЛ были реорганизованы;
- шесть ЮЛ были объединены с другими ЮЛ, которые имели соответствующую лицензию.
Таким образом, с 28 марта 2023 г. по 10 июля 2024 г. прекратили деятельность 49 ПА, шесть ЮЛ реорганизованы по восьми адресам, шесть ЮЛ по шести адресам объединены в одно ЮЛ, а фактическое количество ПА за прошедший период, согласно данным Реестра РЗН, уменьшилось на 30 ЮЛ и 38 адресов.
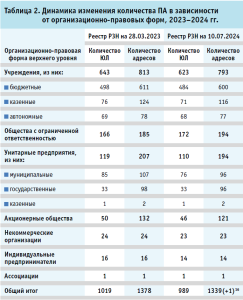
В таблице 2 представлена динамика изменения количества ПА в зависимости от организационно-правовых форм верхнего уровня, согласно данным Реестра РЗН. Мы наблюдаем рост количества ЮЛ только в организационно-правовых формах обществ с ограниченной ответственностью, который связан с открытием новых АО и реорганизацией учреждений и предприятий – за рассматриваемый период количество новых ООО составило девять ЮЛ (Москва и Московская область – по два адреса, Новосибирская, Свердловская, Челябинская, Смоленская области, Республика Крым, Республика Северная Осетия-Алания – по одному адресу) и реорганизованных – три ЮЛ (Ростовская, Самарская и Свердловская области). В то же время прекратили деятельность по изготовлению ЛП шесть ЮЛ.
В совокупности мероприятий п. 2 и п. 4 методологии охват Мониторинга по количеству адресов осуществления деятельности, в сравнении с реестром РЗН, составил 98,3%. Доля активности (участия) ПА в Мониторинге относительно всех ПА составила 45,5% (49,2% от всех адресов изготовления ЛП, информация о которых содержится реестре РЗН). Количество полученных ответов и любого рода информации от МО и АО составила 659, что в 2,4 раза больше в сравнении с результатами предшествующего исследования [23].
В результате анализа данных вся полученная информация по всем 1339(+1)17 адресам реестра РЗН (рис. 2) была структурирована на два блока с выделением категорий:
- 450 ответов ЮЛ, полученные по 659 адресам осуществления деятельности в сфере изготовления ЛП, которые были классифицированы в следующем порядке:
а) подтверждено осуществление деятельности (522 адреса – 39,0% от всего Реестра РЗН):
- 216 ЮЛ (281 адрес) – предоставлена информация в виде полностью заполненной анкеты;
- 50 ЮЛ (127 адресов) – предоставлена информация в виде частично18 заполненной анкеты;
- 101 ЮЛ (109 адресов) – не предоставлена информация в виде полностью или частично заполненной анкеты на момент окончания сбора данных (23 октября 2024 г.) и данные зафиксированы как «в процессе заполнения/уточнения анкеты»;
- пять ЮЛ (пять адресов) – не предоставлена информация в виде полностью или частично заполненной анкеты по причине планирующегося прекращения деятельности19;
б) 21 ответ (24 адреса – 1,8% от всего Реестра РЗН) – получен отказ в предоставлении любого рода сведений (данных), но устно подтвержден факт осуществления деятельности в сфере изготовления ЛП;
в) прекратили фармацевтическую деятельность с правом изготовления ЛП (113 адресов – 8,4 % от всего Реестра РЗН):
- 21 ЮЛ (22 адреса) – предоставлена информация в отношении ранее задействованных площадей и помещений для изготовления ЛП;
- 56 ЮЛ (91 адрес) – не предоставлена информация о ранее осуществляемой деятельности;
- Отсутствие сведений в отношении 573 ЮЛ и 681 адреса осуществления деятельности в сфере изготовления ЛП, по которым при выполнении п. 1–2 методологии не была представлена какая-либо значимая информация о фактах осуществления деятельности в сфере изготовления ЛП, но в рамках мероприятий п. 4 методологии по осуществлению повторных («теплых») звонков, уточнены сведения по ряду адресов, что позволило классифицировать данную группу в следующем порядке:
а) подтверждено осуществление деятельности (137 адресов – 10,2% от всего Реестра РЗН):
- 54 ЮЛ (60 адресов) – установлен контакт с ответственным лицом, а также получена информация о возможности заполнения анкеты или представления данных, то есть подтверждено осуществление деятельности;
- 73 ЮЛ (77 адресов) – не установлен контакт с ответственным лицом, но по п. 1–3 методологии имеется подтвержденная информация, что в организации осуществляется деятельность по изготовлению ЛП;
б) отсутствуют достоверные данные об осуществлении деятельности по изготовлению ЛП (544 адреса – 40,6% от всего Реестра РЗН):
- семь ЮЛ (семь адресов) – установлены контакты с ответственным лицом, но не подтверждена информация об осуществлении деятельности;
- 379 ЮЛ (422 адреса) – не установлен контакт с ответственным лицом, но имеются контактные сведения по адресам изготовления ЛП в сети «Интернет», при этом отсутствует какого-либо рода информация об осуществлении деятельности в сфере изготовления ЛП, в том числе по п. 2–3 методологии частично подтверждено, что по адресу не осуществляется деятельность по изготовлению ЛП;
- 95 ЮЛ (115 адресов) – отсутствует какого-либо рода информация об осуществлении деятельности по изготовлению ЛП в результате выполнения всех мероприятий п. 2–4 методологии.
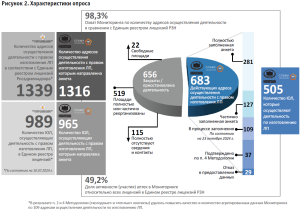
В результате данного шага удалось повысить качество и количество агрегированных данных Мониторинга по 109 адресам осуществления деятельности по изготовлению ЛП.
Таким образом, по итогам выполнения всех мероприятий методологии получены достоверные сведения о фактах осуществления деятельности в сфере изготовления ЛП по 683 адресам20.
В совокупности выполнения мероприятий п. 1–4 методологии получена информация в рамках 353 анкет (полностью или частично заполненных), которые позволили сформировать базу для углубленного анализа консолидированных данных в отношении объема изготовленных ЛП; определения площадей помещений, задействованных при изготовлении ЛП; проведения исследования номенклатуры и объемов спроса на фармацевтические субстанции, а также установления неудовлетворенной потребности ПА в «малых» фасовках; изучения номенклатуры и объемов изготовления ЛП из зарегистрированных ЛП; результаты которого представлены в разделе «Консолидированные результаты анкетирования» настоящей работы.
Детальная информация относительно полученных ответов в разрезе федеральных округов РФ и дополнительная характеристика каждого округа по количеству ПА; количеству фармацевтических работников, задействованных при изготовлении ЛП; количеству изготовленных единиц продукции; представлена на рисунке 3.
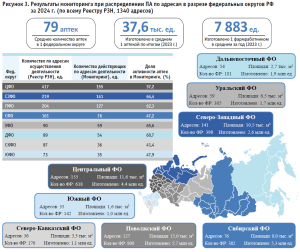
В своих ответах 75 ЮЛ (113 адресов ПА) заявили о прекращении деятельности по изготовлению ЛП. Из них выделяются следующие федеральные округа – ЦФО (59,1%), СФО (9,6%) и ПФО (8,7%). Причины уже широко известны [23].
Мы акцентируем внимание на том, что именно от ПА, располагающихся в сельских поселениях, поступало большее количество обращений, в которых заявлялась готовность возобновления деятельности по изготовлению ЛП, но указаны причины невозможности ее восстановления в ближайшее время, связанные:
- с необходимостью проведения модернизации (реконструкции) помещений;
- необходимостью приобретения (обновления) парка технологического и инженерного оборудования;
- отсутствием «малых» фасовок ФС;
- недостаточным уровнем спроса со стороны врачебного сообщества;
- отсутствием возможностей назначения медицинскими работниками ЭЛП в соответствии с клиническими рекомендациями по сопоставимым МНН, комбинациям и ЛФ зарегистрированных ЛП, а также ЛП, входящих в перечень ЖНВЛП.
В сравнении с аптеками розничной торговли зарегистрированными ЛП отмечались причины, связанные:
- с необходимостью увеличения штатной численности фармацевтических работников более высокого уровня квалификации и размера оплаты труда и (или) необходимостью осуществления переподготовки фармацевтических работников по утвержденной номенклатуре должностей;
- более более высоким влиянием роста стоимости роста стоимости коммунальных услуг и содержания помещений, задействованных при изготовлении ЛП;
- дополнительными расходами на выполнение лицензионных требований (приобретение реактивов, проведение анализов, обслуживание приборов и аппаратов;
- дополнительным контролем уполномоченных органов государственной власти.
«Для сохранения социально значимого вида деятельности в сфере изготовления ЛП в условиях аптечных организаций необходима государственная поддержка, ввиду отсутствия возможности конкуренции с частными аптеками, осуществляющими розничную торговлю зарегистрированными ЛП, открывающимися в радиусе 20–100 метров на площадях в 20–50 м2 и имеющими минимальное количество персонала».
В рамках Мониторинга установлено, что действующие ПА расположены в 82 субъектах РФ, где средневзвешенное количество адресов ведения деятельности по изготовлению ЛП составило 8 (восемь), при медианном значении – 5 (пять) адресов на субъект РФ. Полученные результаты выявили, что помимо Республики Ингушетия, действующие ПА отсутствуют в Ненецком и Чукотском автономных округах. В таблице 3 представлены топ-10 субъектов РФ по количеству действующих ПА (по адресам).
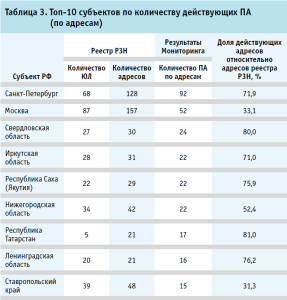
По количеству действующих производственных аптек первую строку занимает г. Санкт-Петербург с 128 адресами, из которых действующими оказались 71,9%. Вторую строку занимает г. Москва с 157 адресами, из которых подтверждено осуществление деятельности у 33,1%. На третьей строке расположилась Самарская область с 39 адресами, из которых 74,4% оказались действующими. Важно обратить внимание, что количество действующих ПА в Санкт-Петербурге наибольшее и составляет 13,5% от общего количества действующих ПА. На наш взгляд, данный факт подтверждает эффективность реализации действующей региональной меры государственной поддержки по предоставлению льгот организациям, осуществляющим социально значимый вид деятельности в объектах нежилого фонда, арендодателем которых является Санкт-Петербург21,22,23. Данная льгота в отношении государственной (региональной) фармации предоставляет существенный стимул для сохранения в своей структуре 57 рецептурно-производственных отделов.
Согласно реестру РЗН, более трех ПА действуют в структуре 25 АО, которые относятся к государственной или муниципальной собственности. Из них 22 в структуре государственных учреждений, государственных унитарных предприятий, акционерных обществах или обществах с ограниченной ответственностью, 100% акций которых принадлежит соответствующим субъектам РФ. Таким образом, можно сделать вывод, что подавляющее большинство производственных аптек функционируют в АО, являющихся государственными (региональными) фармациями. В таблице 4 представлены топ-5 аптечных сетей по количеству производственных аптек Реестра РЗН, которые являются государственными (региональными) фармациями.

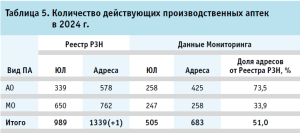
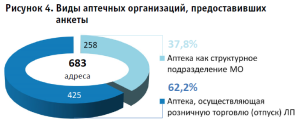
Признаки видов и подвидов по перечню выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность, определены в соответствии с классификацией, приведенной в Приказе № 780н. Распределение по действующим больничным и общественным ПА представлено в таблице 5, где, в соответствии с Реестром РЗН, наибольшую долю занимают ПА как структурное подразделение МО.
При этом, по результатам Мониторинга, большинство действующих ПА относится к аптекам, осуществляющим розничную торговлю (отпуск) лекарственными препаратами (далее – общественная ПА). Количество респондентов данного вида АО (рис. 4), которые обладают правом на изготовление ЛП, составило 425 адресов (62,2%), в то время как количество аптек – структурных подразделений медицинской организации (далее – больничная ПА) составило 258 адресов (37,8%) [20]24.
Как известно, с 1 марта 2023 г. изготовление РФЛП выделено в отдельный вид выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность. На момент проведения Мониторинга в Реестре РЗН установлено, что 12 ЮЛ имеет лицензию с правом изготовления РФЛП и осуществляют деятельность по 14 адресам, которые в зависимости от организационно-правовой формы относятся к семи бюджетным учреждениям (семь адресов), одному автономному учреждению (один адрес) и четырем обществам с ограниченной ответственностью (шесть адресов). Распределение адресов по субъектам РФ представлено на рисунке 5. Здесь также важно отметить, что ряд структурных подразделений МО осуществляют производство РФЛП в рамках лицензии на производство ЛС, но одновременно имеют лицензию на осуществление фармацевтической деятельности с правом изготовления РФЛП.
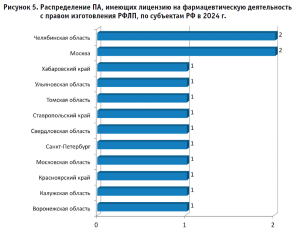
Таким образом, мы сделали заключение, что по состоянию на октябрь 2024 г. на территории РФ осуществляют деятельность по изготовлению ЛП не менее 683 ПА или рецептурно-производственных отделов аптечных организаций (по адресам осуществления деятельности) в структуре 505 юридических лиц.
Количество производственных аптек, обладающих правом на изготовление наркотических средств и психотропных веществ, внесенных в список II и III перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации. В соответствии с перечнем федеральных органов исполнительной власти и государственных корпораций, осуществляющих лицензирование конкретных видов деятельности, утвержденным постановлением Правительства РФ от 21.11.2011 № 95725, Росздравнадзор осуществляет лицензирование оборота наркотических средств, психотропных веществ и их прекурсоров, культивирования наркосодержащих растений, в том числе изготовления лекарственных препаратов из наркотических средств, психотропных веществ и их прекурсоров (далее – НСиПВ). Согласно данным Единого реестра лицензий на деятельность по обороту НСиПВ Росздравнадзора, по состоянию на 12 ноября 2024 г. (далее – Реестр НСиПВ)26, на территории РФ деятельностью по изготовлению НСиПВ, внесенных в список II и III перечня НСиПВ, подлежащих контролю в РФ (далее – деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ) обладали 98 ЮЛ (159 адресов, 11,9% от общего количества ПА). В таблице 6 представлено распределение по видам.

В таблице 7 представлено распределение по формам собственности действующих ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ. На долю унитарных предприятий приходится 43,1% от общего количества действующих ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ, из которых большинство приходится на государственные унитарные предприятия (31,0%). Вторую строку по количеству адресов занимают бюджетные учреждения, на долю которых приходится 30,2%.

Большинство действующих ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ, являются общественными (98 адресов, 84,5%, рис. 6).
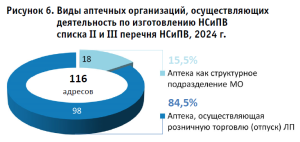
Важно подчеркнуть, что данная деятельность требует дополнительных расходов, а само по себе изготовление ЛП из НСиПВ списка II и III перечня НСиПВ является уникальным на сегодняшний день и с точки зрения значимости для системы лекарственного обеспечения выступает одной из «…форм социальной ответственности и нагрузки.» Такие производственные аптеки несут дополнительные затраты при организации деятельности, в составе которых:
- При приемке и приемочном контроле ЛП и ФС возникает необходимость создания специальной комиссии (временные затраты ставка фонда оплаты труда), а также необходимость подготовки внутренних нормативных документов (приказов), в том числе по определению лиц, ответственных за хранение; лиц, допущенных к контролю наличия (целостности упаковки), которые должны получить соответствующие документы о допуске к работе с НСиПВ, а именно:
- заключение органов по контролю за оборотом НСиПВ о соответствии объектов и помещений, в которых осуществляются деятельность по обороту НСиПВ, установленным требованиям к оснащению этих объектов и помещений инженерно-техническими средствами охраны;
- заключения, выданные государственными (муниципальными) учреждениями здравоохранения в установленном законодательством РФ порядке, справки об отсутствии у работников, которые в соответствии со своими служебными обязанностями должны иметь доступ к НСиПВ, заболеваний наркоманией, токсикоманией, хроническим алкоголизмом;
- заключение органов по контролю за оборотом НСиПВ об отсутствии у работников, которые в соответствии со своими служебными обязанностями должны иметь доступ к НСиПВ, непогашенной или неснятой судимости за преступление средней тяжести, тяжкое, особо тяжкое преступление или преступление, связанное с незаконным оборотом НСиПВ либо с незаконным культивированием наркосодержащих растений, в том числе за преступление, совершенное за пределами РФ.
- При хранении необходимо соблюдать дополнительные требования, выделять дополнительные помещения, в том числе для термолабильных ЛП и ФС, учитывать расходы на запирающиеся сейфы / металлические шкафы или металлические контейнеры, сейфы-холодильники определенных классов, включая приобретение дополнительных средств измерений относительной влажности и температуры воздуха, кондиционирования, пломбировочный материал, а также повышать уровень охраны помещений с учетом стоимости военизированной охраны (по часам и только государственная).
- При учете и отпуске требуется соблюдать особенности такого вида изготовленных ЛП, а также планировать затраты на их уничтожение (при необходимости), включая организацию сбора и утилизации пустой первичной упаковки (при необходимости), на соответствующие журналы и лицензирование по классам отходов.
- При подготовке и обучении персонала (144 часа) с получением сертификата специалиста, подтверждающего соответствующую профессиональную подготовку руководителя юридического лица или руководителя соответствующего подразделения юридического лица.
- Кроме того, в отношении изготовления НСиПВ необходимо учитывать затраты на весовое хозяйство, дистиллятор, сушильный шкаф, автоклав, мерную посуду, вспомогательный материал, которые должны использоваться исключительно для данного типа ЛП.
При определении дополнительных затрат мы не учитываем внештатные случаи, перечень, размеры предусмотренных законодательством РФ штрафов и возможные последствия нарушений по обороту НСиПВ.
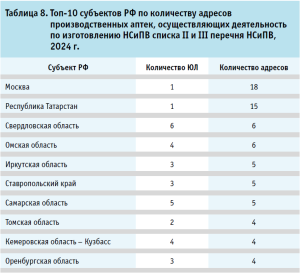
Деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ осуществляется в 39 субъектах РФ. В таблице 8 представлены топ-10 субъектов РФ по количеству адресов ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ. Из представленных данных выделяются первые два региона, которые очевидно представлены региональными фармациями – г. Москва и Республика Татарстан. При этом по количеству ЮЛ также очевидно, что в указанных регионах отсутствуют больничные аптеки, которые осуществляют деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ.
На долю топ-10 аптечных сетей приходится 46,6% от общего числа действующих ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ. В таблице 9 представлен топ-10 аптечных сетей по количеству адресов ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ. Стоит отметить, что большинство аптечных сетей изготавливает НСиПВ списка II и III перечня НСиПВ. Наименьшая доля адресов ПА, осуществляющих деятельность по изготовлению НСиПВ списка II и III перечня НСиПВ, приходится на самую крупную аптечную сеть производственных аптек РФ, расположенную в Санкт-Петербурге, где из 57 аптек с рецептурно-производственным отделом изготовление НСиПВ списка II и III перечня НСиПВ осуществляет всего одна производственная аптека.

Conclusion.
Одним из ключевых вопросов в сфере изготовления ЛП в РФ на сегодняшний день является реальная оценка количества действующих ПА и ключевых параметров их деятельности. Для сбалансированного развития мер государственной поддержки и совершенствования регулирования важно понимать особенности организации процессов по изготовлению и контролю качества ЛП, специфику деятельности, а также текущие реалии данной сферы. В составе основных выводов первой части Мониторинга необходимо выделить:
- Принятый Федеральный закон от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств» позволил существенно снизить темпы закрытия производственных аптек, однако в 2024 г. общее количество ПА продолжило сокращаться (как по количеству юридических лиц, так и по адресам осуществления деятельности на 2,9% и 2,8% соответственно), что было вызвано низкой рентабельностью, устаревшим оснащением, низким уровнем спроса, сложностями при реализации контрактов, отсутствием ряда ФС, в том числе в «малых» фасовках».
- По состоянию на октябрь 2024 г., впервые установлено точное количество – не менее 683 действующих ПА в структуре 505 ЮЛ, при том, что имеются сведения о выданных лицензиях для 1339 аптек, то есть каждая вторая аптека по факту прекратила деятельность.
- Наибольшее количество функционирующих аптек располагается в Центральном, Северо-Западном и Поволжском ФО.
- ПА действуют в 82 субъектах (без учета новых регионов), 41,3% аптек располагаются в 10 субъектах России, в 27 субъектах страны действуют три и менее аптеки, в 11 субъектах – только одна аптека.
- Большинство производственных аптек являются общественными.
- Основная часть производственных аптек (73,5%) сосредоточена в аптечных организациях, осуществляющих розничную торговлю ЛП.
- 275 из не менее 683 действующих ПА функционируют в составе организаций с государственными формами собственности – то есть 40,3%. Если рассматривать только общественные ПА, то аналогичный показатель составит 64,7%.
- На ТОП-5 государственных (региональных) фармаций приходится 107 действующих производственных аптек.
- Деятельность по изготовлению наркотических средств и психотропных веществ осуществляется в 39 субъектах РФ, при этом наибольшее количество таких аптек зарегистрировано в Москве и Республике Татарстан.
Вышеуказанные ключевые выводы представлены 17 декабря 2024 г. на пятом заседании Рабочей группы, где также были рассмотрены концепции двух законопроектов, предусматривающие снятие основных текущих барьеров, с которыми сталкиваются действующие производственные аптеки и пациенты. Полученные результаты подтверждают необходимость дальнейшего совершенствования законодательного регулирования и нормативной базы в сфере изготовления ЛП аптечными организациями, а также формирования механизмов государственной поддержки ПА, что будет в том числе подробно рассмотрено во второй части настоящей работы, включая дополнительные предложения авторов в данной сфере деятельности. Также во второй части исследования будут представлены детализированные результаты анализа опроса действующих производственных аптек, где будет установлен кадровый состав, объемы спроса на услуги (работы) по изготовлению ЛП и внутриаптечной фасовке зарегистрированных ЛП, определены задействованные площади и помещения, изучен уровень спроса на ФС, в том числе определена номенклатура и объемы неудовлетворенных потребностей в «малых» фасовках, проанализирована номенклатура изготовления из зарегистрированных ЛП, структурированы «портреты» общественной и госпитальной производственной аптеки, а также рассмотрены лучшие практики субъектов России по организации фармацевтического дела в сфере аптечного изготовления.
______________________________________________________________________
Авторы выражают благодарность за участие, поддержку и доверие при выполнении настоящего исследования:
Фармацевтическим работникам производственных аптек Российской Федерации, которые ежедневно содействуют повышению уровня лекарственного обеспечения, предоставляя доступ к персонализированным видам лекарственной терапии, прежде всего, для детского населения, а также руководителям медицинских и аптечных организаций, сохраняющих и развивающих социально значимый вид фармацевтической деятельности;
Федеральной службе по надзору в сфере здравоохранения (Росздравнадзор) за помощь в реализации методологии и содействие в повышении качества данных об осуществлении фармацевтической деятельности с правом изготовления лекарственных препаратов;
Федеральному государственному бюджетному учреждению «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (ФГБУ «ИМЦЭУАОСМП» Росздравнадзора) за ценные рекомендации при рецензировании данной работы и содействие в публикации;
Федеральному государственному бюджетному учреждению «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации (ФГБУ «НЦЭСМП» Минздрава России) за содействие и информационную поддержку при выполнении данного исследования;
Региональным органам исполнительной власти, в частности, Комитету по здравоохранению Ленинградской области, Комитету по здравоохранению Санкт-Петербурга, Департаменту здравоохранения города Москвы, за содействие и информационную поддержку при выполнении данного исследования;
Некоммерческим и саморегулируемым организациям: Ассоциации государственных аптечных сетей; Ассоциации независимых аптек; Ассоциации аптечных учреждений «Союзфарма»; Ассоциации содействия развитию аптечной отрасли «Аптечная гильдия»; Союзу «Национальная Фармацевтическая Палата» за содействие и информационную поддержку при выполнении данного исследования
______________________________________________________________________
1 Указ Президента РФ от 07.05.2024 № 309 «О национальных целях развития РФ до 2030 и на перспективу до 2036 года». URL: https://docs.cntd.ru/document/1305894187 (дата обращения: 24.10.2024).
2 Постановление Совета Федерации Федерального Собрания Российской Федерации от 15.02.2023 № 49-СФ «О государственной политике в сфере охраны здоровья матери и ребенка». Электронный ресурс. URL: https://base.garant.ru/406399493/ (дата обращения: 24.10.2024).
3 Федеральный закон от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств». Электронный ресурс. URL: https://docs.cntd.ru/document/1300131660 (дата обращения: 24.10.2024).
4 Указ Президента РФ от 29.05.2017 № 240 «Об объявлении в Российской Федерации Десятилетия детства» Электронный ресурс. URL: http://www.kremlin.ru/acts/bank/41954 (дата обращения: 24.10.2024).
5 Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://docs.cntd.ru/document/902312609 (дата обращения: 24.10.2024).
6 Федеральный закон от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации». Электронный ресурс. URL: https://docs.cntd.ru/document/902389617 (дата обращения: 24.10.2024).
7 Единый реестр лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности. URL: https://roszdravnadzor.gov.ru/services/licenses (дата обращения: 10.07.2024).
8 Приказ Минздрава России от 31.07.2020 № 780н «Об утверждении видов аптечных организаций». URL: https://docs.cntd.ru/document/565649073 (дата обращения: 24.10.2024).
9 Указ Президента РФ от 28.02.2024 № 145 «О Стратегии научно-технологического развития Российской Федерации». URL: https://docs.cntd.ru/document/1305071057 (дата обращения: 24.10.2024).
10 Указ Президента РФ от 18.06.2024 № 529 «Об утверждении приоритетных направлений научно-технологического развития и перечня важнейших наукоемких технологий». URL: https://docs.cntd.ru/document/1306389112 (дата обращения: 24.10.2024).
11 В разделе «Результаты и обсуждение» учитывается информация, полученная в ходе выполнения п. 1–4 методологии, где установлено отсутствие сведений об 1 (одном) ЮЛ с 1 (одним) адресом ведения деятельности по изготовлению ЛП, которая в соответствии с в Реестром РЗН не обладает поименованным правом, но была готова осуществить изготовление ЛП (устно).
12 Указ Президента РФ от 22.06.1993 № 939 «О государственных научных центрах Российской Федерации». URL: https://docs.cntd.ru/document/9006316/titles/7D80K5 (дата обращения: 24.10.2024).
13 Федеральный закон от 23.08.1996 № 127-ФЗ «О науке и государственной научно-технической политике». URL: https://docs.cntd.ru/document/9028333 (дата обращения: 24.10.2024).
14 Повторно: Здесь и далее учитывается информация п. 1–4 методологии, где в последнем установлено отсутствие сведений об 1 (одном) ЮЛ с 1 (одним) адресом ведения деятельности по изготовлению ЛП, которая в соответствии с в Реестром РЗН не обладает поименованным правом, но была готова осуществить изготовление ЛП.
15 Согласно международным договорам и Федеральным конституционным законам РФ (от 04.10.2022 № 5-ФКЗ, № 6-ФКЗ, № 7-ФКЗ, № 8-ФКЗ), до 1 января 2026 года установлен переходный период, в течение которого урегулируются вопросы интеграции Донецкой Народной Республики, Луганской Народной Республики, Запорожской и Херсонской областей в экономическую, финансовую, кредитную и правовую системы России, а также в систему органов государственной власти и, в частности, сохранено и продлено действие ранее выданных лицензий на медицинскую и фармацевтическую деятельность до 1 января 2026 года для государственных организаций и частично для негосударственных, при этом частные аптеки новых регионов обязаны получить лицензию на ведение деятельности до 1 января 2024 года. На момент проведения исследования имеется неподтвержденная информация, что: в структуре ГУП Луганской Народной Республики «Лугмедфарм» 2 аптеки обладают правом на изготовление ЛП (в том числе в асептических условиях); на территории ДНР данным – Аптека № 1 Гомеопатия, Аптека № 509, Аптека № 417; в Запорожской области – Аптека № 107, Аптека № 196, Аптека № 221, Аптека Примула, Аптека № 9, Социальная аптека № 8; в Херсонской области – Аптека № 3, Арника, Аптека № 139 межбольничная, Аптека № 111, Аптека № 8, Аптека № 70.
16 См. п. 1–4 методологии Мониторинга.
17 Там же.
18 В основной доле случаев не представлена информация о потребности в ФС.
19 В ходе коммуникаций в отношении данных ПА определены основные причины планирующегося прекращения деятельности таких аптек, а именно: «недостаточный объем спроса для обеспечения рентабельности», «усиление конкуренции с аптеками розничной торговли зарегистрированными ЛП и продажа собственности соответствующему лицу, где рецептурно-производственный отдел скорее всего будет закрыт», «осуществление реорганизации ЮЛ» (форма МУП) и «ликвидация ЮЛ (форма МУП) с исключением из лицензии изготовления ЛП».
20 Сумма произведена по пп. а) п. 1, пп. б) п. 1, пп. а) п. 2 структурированных данных по двум блокам с выделением категорий.
21 Закон Санкт-Петербурга от 03.09.1997 № 149-51 «О порядке определения арендной платы за нежилые помещения, арендодателем которых является Санкт-Петербург». URL: https://docs.cntd.ru/document/9109809 (дата обращения: 24.10.2024).
22 Закон Санкт-Петербурга от 19.07.2005 № 377-57 «О порядке предоставления льгот по арендной плате за объекты нежилого фонда, арендодателем которых является Санкт-Петербург». URL: https://docs.cntd.ru/document/8414026 (дата обращения: 24.10.2024).
23 Постановление Правительства Санкт-Петербурга от 28.12.2005 № 2002 «О мерах по реализации Закона Санкт-Петербурга от 29 июня 2005 г. № 377-57 «О порядке предоставления льгот по арендной плате за объекты нежилого фонда, арендодателем которого является Санкт-Петербург». URL: https://docs.cntd.ru/document/8423475 (дата обращения: 24.10.2024).
24 Сокращения «общественная» и «больничная» использованы в связи с унификацией словосочетаний, используемых в других регуляторных системах.
25 Постановление Правительства Российской Федерации от 02.06.2022 № 1007 «О лицензировании деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений». URL: https://docs.cntd.ru/document/350558817 (дата обращения: 24.10.2024).
26 Единый реестр лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности. URL: https://roszdravnadzor.gov.ru/services/licenses (дата обращения: 12.11.2024).
- Miroshnichenko Yu.V. Analysis of the range of drugs manufactured in pharmacies of military medical organizations / Yu.V. Miroshnichenko, E.A. Klimkina, R.A. Enikeeva // Voennomedicinskij zhurnal (Military medical journal). – 2024. – Vol. 345, № 11. – P. 69–74. – DOI 10.52424/00269050_2024_345_11_69. – EDN KZBPPS. (In Russian).
- Kochin I.V., Troshina S.V., Troshin D.O.Expediency of deployment and operation of pharmacies for the manufacture of medicinal forms in the emergency zone // Voennaya medicina (Military medicine). – 2017. – №. 3. – P. 114–118. (In Russian).
- Voronkov O.V., Shevchenko L.I. Use of means and facilities of pharmacy network for drugs manufacture in emergency situations // Medicina katastrof (Disaster medicine). – 2018. – №. 1. – P. 47–49. (In Russian).
- Kabakova T.I. Methodological foundations for improving drug provision for persons affected by emergency situations at the hospital and rehabilitation stages of treatment: dis. ... Doctor of Pharmaceutical Sciences: 14.04.03 / Taisiya Ivanovna Kabakova. - Pyatigorsk, 2016. - 346 p. (In Russian).
- Medvedeva D.M., Narkevich I.A., Nemyatykh O.D. Analysis of the availability and affordability of pharmaceuticals for children in need of palliative care // Farmakoe`konomika. Sovremennaya farmakoe`konomika i farmakoe`pidemiologiya (Farmakoekonomika. Modern pharmacoeconomics and pharmacoepidemiology). – 2021. – Vol. 14. – №. 2. – P. 167–179. (In Russian).
- Ponomareva E.A. Optimization of production pharmacies in modern conditions: author's abstract. dis. … candidate of pharmaceutical sciences: 14.04.03 / Elena Aleksandrovna Ponomareva. – Pyatigorsk, 2012. – 24 p. (In Russian).
- Narkevich I.A., Pokhvalenko E.V. Extemporaneous drugs for neonatal infants // Farmatsiya. – 2013. – №. 7. – P. 27–29. (In Russian).
- Pelyushkevich A.V. et al. Extemporaneous dosage forms for children: prospects and ways of improvement // Medicina: teoriya i praktika (Medicine: theory and practice). – 2019. – Vol. 4. – №. S. – P. 420–421. (In Russian).
- Sineva T.D. et al. Prospects for the production of children's extemporaneous dosage forms and the possibility of their transfer to small-scale production // Innovations in the health of the nation. – 2018. – P. 338–342. (In Russian).
- Levinstein I. Ukrainian deviations. On the issue of pharmaceutical education (From a co-report at the All-Ukrainian Congress of Pharmacy Workers) / I. Levinstein // Herald of Pharmacy. – 1924. – No. 8–9. – P. 132–134. (In Russian).
- Petrishche T.L. Izrail Ionasovich Levinstein (1883–1972) – organizer of pharmacy, pharmaceutical education and science in the 1920s (on the 130th anniversary of his birth) // Herald of Pharmacy. – 2013. – №. 4 (62). – P. 93–98. (In Russian).
- Semenova T.V. Health care staff of Russia. Staff imbalance and its elimination in health care. // Vestnik Roszdravnadzora. – 2019. – Vol. 4. – P. 49–59. EDN: CYJAKX (In Russian).
- Semenova T.V., Prirodova O.F. E-learning in continuing medical education: emphasis on interactive educational modules // Vestnik Roszdravnadzora. – 2020. – Vol. 3. – P. 70–77. (In Russian).
- Semenova T.V., Shlemskaya V.V., Timoshina E.N., Antonov A.E. Methodological Approaches to Assessing the Effectiveness of Measures to Attract and Retain Medical Personnel in the Workplace in the Regions of Russia // Vestnik Roszdravnadzora. – 2022. – Vol. 6. – P. 34–48. (In Russian).
- Krishtanova N.A. et al. The acquisition of practical skills is a priority task preparing a pharmacist within educational process // Vuzovskaya pedagogika. – 2021. – P. 674-679. (In Russian).
- Mandrik M.A., Sadkovskii I.A., Korol L.A., Egorova S.N., Krasnyuk I.I., Bykov A.V. Development of Extemporaneous Compounding as an Initiating Factor in the Transformation of Pharmaceutical Education: International Experience and Current Trends. // Regulyatorny`e issledovaniya i e`kspertiza lekarstvenny`x sredstv (Regulatory Research and Medicine Evaluation). – 2024. – № 14(4). – P. 419–436.
- Shestakov V.N., Denisova E.V. PIC/S and its impact on access of drugs to other markets // Vestnik sluzhby` krovi Rossii (Bulletin of the Russian Blood Service). – 2015. – No. 3. – P. 58–60. (In Russian).
- Smirnov V.A., Shestakov V.N., Abramovich R.A., Denisova M.N. The importance of pharmaceutical quality system design at the drug manufacturers in the context of formation of the EAEU single pharmaceutical market // Remedium. – 2018. – №. 10. – P. 33–36. (In Russian).
- Farrakhov A.Z. Compounding Pharmacy Restoration as a Current Healthcare Priorit. // Regulyatorny`e issledovaniya i e`kspertiza lekarstvenny`x sredstv (Regulatory Research and Medicine Evaluation). – 2024. – № 14(4). – P. 380–385. https://doi.org/10.30895/1991-2919-2024-14-4-380-385 (In Russian).
- Yurochkin D.S., Mamedov D.D., Erdni-Garyaev S.E., Yarutkin A.V., Bagirova V.L., Guryanov P.S., Loudiyi O., Li W. Review of BRICS regulatory practices in the field of drugs compounding. // Farmaciya i farmakologiya (Pharmacy & Pharmacology). – 2024. – № 12(2) – P. 172–194. DOI: 10.19163/2307-9266-2024- 12-2-172-194. (In Russian).
- Shishova L.I., Yarutkin A.V., Bagirova V.L. Current and Future Pharmacopoeial Requirements for the Quality of Extemporaneous Medicinal Products: A Review of Regulatory Standards. // Regulyatorny`e issledovaniya i e`kspertiza lekarstvenny`x sredstv (Regulatory Research and Medicine Evaluation). – 2024. – № 14(4). – P. 386–399. DOI: 10.30895/1991-2919-2024-14-4-386-399. (In Russian).
- Yarutkin A.V., Bagirova V.L.State Pharmacopoeia of the Russian Federation Edition XV: Development Priorities. Regulatory Research and Medicine Evaluation. 2024;14(5):572-579. DOI: 10.30895/1991-2919-2024-14-5-572-579. (In Russian).
- Fisenko V.S., Farrakhov A.Z., Solomatina T.V., Alekhin A.V., Yurochkin D.S., Erdni-Garyaev S.E., Mamedov D.D., Golant Z.M. Monitoring of compounding pharmacies in the Russian Federation // Vestnik Roszdravnadzora. – 2023. – Vol. 3. – P. 22–33. – EDN XZJIJT. (in Russian).
