CONTROL OVER THE CIRCULATION OF MEDICAL DEVICES
Мониторинг безопасности медицинских изделий в субъектах Российской Федерации. Актуальные данные
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
ORCID: http://orcid.org/0000-0002-9142-8808
2 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
3 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
ORCID: http://orcid.org/ 0000-0002-9080-332X
Система мониторинга безопасности медицинских изделий и пострегистрационный клинический мониторинг – важные механизмы получения обратной связи о функционировании и применении медицинских изделий. В статье представлен актуальный порядок проведения мониторинга безопасности медицинских изделий на территории Российской Федерации, а также рассмотрены мероприятия по отслеживанию наступивших неблагоприятных событий при применении медицинских изделий.
Keywords: субъект Российской Федерации, мониторинг безопасности медицинских изделий, пострегистрационный клинический мониторинг медицинских изделий, неблагоприятные события медицинских изделий
Background.
В настоящее время все больше внимания уделяется качеству и безопасности оказания медицинской помощи. Одним из важных компонентов оказания медицинской помощи является ответственное отношение субъектов обращения медицинских изделий, направленное на поддержание качества, эффективности и безопасности применяемых медицинских изделий.
Прежде чем получить право обращения на территории Российской Федерации, медицинское изделие проходит несколько этапов. С момента получения регистрационного удостоверения, допускающего медицинское изделие к обращению на территории РФ, производителям (уполномоченным представителям производителя) медицинского изделия необходимо проводить пострегистрационный клинический мониторинг безопасности. Мониторинг безопасности медицинских изделий заключается в сборе и направлении в уполномоченный федеральный орган исполнительной власти клинических данных при применении вновь зарегистрированного медицинского изделия с целью подтверждения его эффективности и безопасности в клинической практике на пострегистрационном этапе. Наряду с этим, осуществляются мероприятия по отслеживанию неблагоприятных событий, которые могут произойти при использовании медицинского изделия на протяжении всего жизненного цикла. Такие мероприятия и составляют мониторинг безопасности медицинских изделий.
Проведение мониторинга безопасности медицинских изделий, зарегистрированных в соответствии с требованиями Евразийского экономического союза, и находящихся в обращении на территории Российской Федерации, осуществляется Росздравнадзором в соответствии с Решением Коллегии Евразийской экономической комиссии от 22.12.2015 № 174 «Об утверждении Правил проведения мониторинга безопасности, качества и эффективности медицинских изделий».
Порядок проведения мониторинга безопасности медицинских изделий на территории Российской Федерации регламентирован приказом Минздрава России от 19.10.2020 № 1113н «Об утверждении Порядка сообщения субъектами обращения медицинских изделий обо всех случаях выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий» и приказом Минздрава России от 15.09.2020 № 980 н «Об утверждении порядка осуществления мониторинга безопасности медицинских изделий» (далее – Порядок № 1113н и Порядок № 980н, соответственно).
Неблагоприятные события медицинских изделий
Неблагоприятными событиями являются все случаи выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, сведения о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, а также о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий.
К мероприятиям по отслеживанию наступивших неблагоприятных событий при применении медицинских изделий можно отнести сообщение от любого субъекта обращения медицинского изделия.
К объектам обращения медицинского изделия относятся: «Организации, созданные в установленном порядке на территории Российской Федерации, либо представительства иностранных организаций, аккредитованные в установленном порядке на территории Российской Федерации, либо индивидуальные предприниматели, зарегистрированные на территории Российской Федерации, либо физические лица, осуществляющие технические испытания, токсикологические исследования, клинические испытания, экспертизу качества, эффективности и безопасности медицинских изделий, их государственную регистрацию, производство, изготовление, ввоз на территорию Российской Федерации, вывоз с территории Российской Федерации, подтверждение соответствия, государственный контроль, хранение, транспортировку, реализацию, монтаж, наладку, применение, эксплуатацию, в том числе техническое обслуживание, предусмотренное нормативной, технической и (или) эксплуатационной документацией производителя, а также ремонт, утилизацию или уничтожение (далее – субъекты обращения медицинских изделий), за исключением субъектов обращения медицинских изделий, осуществляющих деятельность на территории международного медицинского кластера или на территориях инновационных научно-технологических центров».
Сообщение о неблагоприятном событии при применении медицинского изделия направляется непосредственно в Росздравнадзор через официальный сайт путем регистрации с использованием ЕСИА, либо подается на бумажном носителе как в адрес Росздравнадзора, так и в его территориальные органы.
Объем сведений о неблагоприятном событии, который необходим для проведения дальнейшей экспертизы, представлен в приложении № 1 Порядка № 1113н. Также сообщение о неблагоприятном событии можно сопроводить фотоматериалами и копиями документов, подтверждающими те или иные факты об инциденте.
Система мониторинга безопасности медицинских изделий и пострегистрационный клинический мониторинг являются важными механизмами получения обратной связи о функционировании и применении медицинских изделий.
Поэтому, понимая, что основным источником информации о практическом качестве медицинских изделий является врач, Росздравнадзор упростил процедуру направления сообщения о неблагоприятном событии и теперь подать сообщение можно просто пройдя по ссылке на официальном сайте ведомства, где авторизация проводится автоматически через ЕСИА, а подача сообщения о неблагоприятном событии занимает менее минуты.
По QR-кодам на рисунке 1 можно перейти к электронной форме подачи «Сообщения о неблагоприятных событиях медицинских изделий» и к руководствам пользователя по подаче сообщений, а также отчетам, размещенным на официальном сайте Росздравнадзора.

Динамика роста сообщений о неблагоприятных событиях
В настоящее время, в условиях высоких темпов импортозамещения, становится ценной информация о неблагоприятных событиях в сфере обращения медицинских изделий. Своевременность предоставления такой информации также приобретает все большее значение.
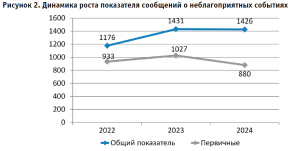
Благодаря активной работе и бдительности территориальных органов Росздравнадзора, медицинских организаций, поставщиков и производителей (их уполномоченных представителей) во многих субъектах Российской Федерации количество поступивших сообщений о неблагоприятных событиях в систему АИС Росздравнадзора растет. Динамика роста сообщений о неблагоприятных событиях по годам следующая: за 2022 – 1176 (из них первичных сообщений – 933), 2023 – 1431 (из них первичных сообщений – 1027), 2024 – 1426 (из них первичных сообщений за неполный 2024 год – 880) (рис. 2). Необходимо отметить, что показатель общей сообщаемости о неблагоприятных событиях имеет тенденцию к повышению из года в год.
Работа системы организована таким образом, что сообщение о неблагоприятном событии медицинского изделия от любого субъекта обращения медицинского изделия фиксируется и подробно прорабатывается Центром мониторинга экспертной организации, в качестве которой выступает ФГБУ «ВНИИИМТ» Росздравнадзора. Кроме того, информация о возникновении неблагоприятного события незамедлительно доводится до производителя (уполномоченного представителя производителя), и впоследствии Росздравнадзором контролируются принимаемые производителем меры (так называемые корректирующие мероприятия), результатами которых должно являться повышение качества и эффективности производимых медицинских изделий.
В случае несоблюдения сроков по предоставлению первоначальных сведений производителем (уполномоченным представителем производителя), либо дополнительных сведений по наступившему неблагоприятному событию, Росздравнадзор по истечении 15 дней с момента регистрации сообщения о неблагоприятном событии, за исключением случаев, в которых экспертной организации признаки угрозы или причинения вреда очевидны, может принять решение о приостановке применения медицинского изделия с целью соблюдения необходимых мер для того, чтобы до завершения проверки возможный вред, связанный с обращением данной продукции, не увеличился.
Пострегистрационный клинический мониторинг медицинских изделий Клинический мониторинг обеспечивает наблюдение за медицинским изделием на пострегистрационном этапе. Клинический мониторинг позволяет оценить достаточность данных о медицинском изделии, погруженных в эксплуатационную документацию. Таким образом, могут быть выявлены новые клинические эффекты при применении, что позволит расширить перечень показаний к применению и (или) назначению, область применения медицинского изделия. Наряду с этим, также могут быть выявлены и новые побочные эффекты, о которых ранее было не известно, либо такие эффекты ранее были сгруппированы в одно общее понятие.
Пострегистрационный клинический мониторинг медицинских изделий заключается в предоставлении Отчетов производителя (его уполномоченного представителя) ежегодно в течение трех лет после регистрации медицинского изделия на территории Российской Федерации (далее – Отчет, ОПКМ). Пострегистрационный клинический мониторинг обязателен для медицинских изделий высокого класса риска: 3 и имплантируемых медицинских изделий 2б классов риска.
Нормативно закреплен срок, до которого должен быть представлен Отчет – 1 февраля года, следующего за годом регистрации медицинского изделия. При этом стоит отметить, что период сбора клинических данных и их объем должны быть достаточными для проведения объективной оценки представленных отчетных данных.
Приведем примеры.
Пример 1. Медицинское изделие получило регистрационное удостоверение в марте 2021 года. Для него пострегистрационным отчетным периодом является период с 2021 по 2023 гг., и отчеты должны предоставляться за 2021, 2022, 2023 гг. Но медицинское изделие обращалось в 2021 и 2023, и не обращалось в 2022. Тогда Отчет с клиническими данными предоставляется за 2021 и 2023 год, а за 2022 год предоставляется, но с указанием сведений о том, что обращение медицинского изделия не осуществлялось. В случае, если отчеты за 2021 и 2023 будут содержать достаточно данных для подтверждения клинической эффективности и безопасности, но с учетом того, что в 2022 году клинические данные не были получены в связи с отсутствием обращения, отчетный период может быть продлен на 2024 год.
Пример 2. Если медицинское изделие зарегистрировано в октябре 2021 года, но оно не обращалось, то в данном случае отчетный период с 2021 года будет перенесен на 2022 год. Если медицинское изделие зарегистрировано в октябре 2021 года и при этом имеет достаточный объем данных об обращении и, одновременно, достаточный объем клинических данных, то данный период, хоть и короткий (2 месяца), может быть клинически значимым для подтверждения клинической эффективности и безопасности на первом году обращения.
В дополнение стоит отметить, что опыт применения медицинского изделия за рубежом будет приниматься во внимание при оценке Отчетов. Однако первостепенное значение будут иметь клинические данные, полученные при применении медицинского изделия на территории Российской Федерации.
Подтверждение клинической эффективности и безопасности медицинских изделий в отчетный период позволяет укрепить позиции производителей в обеспечении российского рынка продукцией надлежащего качества.
Показатели клинического мониторинга медицинских изделий
На базе АИС Росздравнадзора выстроена система передачи Отчетов по клиническому мониторингу в электронном формате. При своевременной и планомерной подаче Отчета производителем (его уполномоченным представителем) в систему АИС Росздравнадзора, осуществляя фиксацию присвоенного системой номера предыдущего Отчета, без труда можно предоставить последующий и заключительные Отчеты в электронной форме. Так, с января 2024 года внедренный и адаптированный для подачи сведений цифровой способ сбора Отчетов существенно упростил процесс подачи отчетных сведений для организаций, упростил процессы обработки Росздравнадзором. Кроме того, такой способ подачи отчетных данных способствует развитию преемственности при рассмотрении отчетов на всем пути – от заявителя до экспертной организации и обратно.
За истекший период 2024 года
в Росздравнадзор поступило 1483 ОПКМ для подтверждения клинической эффективности и безопасности медицинского изделия в пострегистрационный период обращения. Из них в цифровом формате поступило 384 Отчета, что составляет 25% от общего показателя, тогда как в 2022– 2023 годах цифрового способа подачи не существовало.
Conclusion.
Сегодня многое сделано для повышения качества жизни и уровня доверия граждан к государству. Качественная медицинская помощь пациентам невозможна без безопасных и доступных медицинских изделий. Для этого необходим баланс интересов всех участников процесса – пациента, медицинской организации, бизнеса и государства.
Общими усилиями сегодня участники сферы обращения медицинских изделий добиваются позитивных изменений как в области регулирования, так и в преодолении возникающих вызовов за счет скорости принимаемых решений и гибкости подходов.
