CIRCULATION OF MEDICAL DEVICES
Медицинские изделия для диагностики in vitro для молекулярного тестирования в онкологии
1 — Federal State Organization «National quality institute» Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
ORCID: https://orcid.org/0000-0003-4656-1025
2 — Federal State Organization «National quality institute» Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
ORCID: https://orcid.org/0000-0003-0971-853X
Cancer is the second leading cause of death worldwide, with morbidity and mortality increasing every year. In vitro diagnostics play a critical role in clinical decision-making for cancer screening, diagnosis and treatment. Invitro diagnostic medical devices (MI IVD) specific to cancer screening include methods such as cytology, flow cytometry, and molecular testing. This review presents an assessment of the landscape of medical devices for in vitro diagnostic of oncological diseases registered in the Russian Federation over the past few years.
Keywords: Oncology, medical devices for in vitro diagnostics, molecular testing, companion diagnostics
Background.
Онкологические заболевания являются второй по значимости причиной смерти во всем мире, причем с каждым годом заболеваемость и смертность растут. Однако с помощью надежных мер профилактики, скрининга и раннего выявления, сопровождаемых доступом к качественной диагностике, а также благодаря своевременному и эффективному лечению и уходу, число летальных исходов можно значительного сократить. Как правило, когда рак обнаруживается на ранней стадии, он легче поддается лечению, что приводит не только к лучшим результатам, но и к снижению стоимости лечения с существенной экономией для систем здравоохранения.
Например, исследование Cancer Research UK, проведенное в 2014 г., показало, что поздняя диагностика является основным фактором, влияющим на затраты Национальной службы здравоохранения Великобритании (NHS) на лечение рака. Стоимость лечения рака толстой кишки, прямой кишки, легких и яичников III и IV стадии почти в 2,5 раза превышает затраты на лечение рака I и II стадии1. Что касается рака груди, проведенный в 2013 г. анализ общей экономии от эффективной стратегии профилактики, раннего выявления и лечения по сравнению с подходом, предусматривающим только лечение, оценивается примерно в 60% во всем мире [1].
Диагностика in vitro играет решающую роль в принятии клинических решений по скринингу, диагностике и лечению рака. Медицинские изделия для диагностики in vitro (далее – МИ ИВД), специфичные для скрининга рака, включают такие методы, как цитология, проточная цитометрия и молекулярное тестирование. Кроме того, растворимые биомаркеры рака – белки или другие вещества, которые в больших количествах вырабатываются раковыми клетками, чем нормальными клетками, могут быть обнаружены в крови, моче, стуле или других жидкостях организма некоторых больных раком. Альфа-фетопротеин (AFP) является примером скринингового биомаркера, который помогает в диагностике гепатоцеллюлярной карциномы2. Все чаще геномные маркеры, такие как мутации опухолевых генов, паттерны экспрессии опухолевых генов и эпигенетические изменения в опухолевой ДНК, также используются в качестве опухолевых маркеров как часть диагностики патологии3.
Кроме того, тестирование с помощью МИ ИВД может ответить на важные вопросы о состоянии здоровья пациента, включая риск или предрасположенность к развитию определенного вида рака; стадии заболевания и прогноза прогрессирования / ремиссии после терапии [2]. Примеры тестирования МИ ИВД включают скрининг на вирус папилломы человека (HPV), который имеет причинную связь с раком шейки матки, наличие гена слияния bcr-abl для определения того, следует ли использовать иматиниб для лечения хронического миелоидного лейкоза (ХМЛ). Таким образом, МИ ИВД служат для принятия правильных решений о лечении после постановки диагноза.
Основные достижения в области технологий и иммунохимии привели к разработке точных и недорогих МИ ИВД, включая тестирование на месте (POC) и самотестирование. Включение онкологических МИ ИВД во второй Модельный список Всемирной организации здравоохранения (ВОЗ) основных средств диагностики in vitro для использования в клинических лабораториях (WHO EDL) иллюстрирует их все более важную роль в профилактике и лечении рака4.
Молекулярное тестирование охватывает любое изделие для диагностики рака, которое анализирует молекулярные сигнатуры (т.е. ДНК, РНК, белок) качественно или количественно. Общие методы включают (но не ограничиваются ими) полимеразную цепную реакцию (ПЦР), ПЦР в реальном времени (количественная), ПЦР с обратной транскриптазой в реальном времени (количественная РНК), секвенирование, масс-спектроскопию, иммуногистохимию.
Цель работы
Цель данной статьи – сделать обзор медицинских изделий для диагностики in vitro онкологических заболеваний, зарегистрированных в Российской Федерации за последние несколько лет.
Медицинские изделия для диагностики in vitro на основе полимеразной цепной реакции
Медицинские изделия, которые были зарегистрированы в России в качестве МИ ИВД для диагностики онкологических заболеваний, представлены в таблице 1. Отличительной особенностью указанных изделий является то, что они основываются на полимеразной цепной реакции. Как видно из представленных данных, основные мишени изделий – это мутации в протоонкогенах, кодирующих семейство белков RAS (KRAS и NRAS), в EGFR гене, который кодирует трансмембранный рецептор, активирующийся при связывании с эпидермальным фактором роста, в гене B-Raf, серин/треониновой протеинкиназе семейства MAP3K, продуктом которого является BRAF-белок.
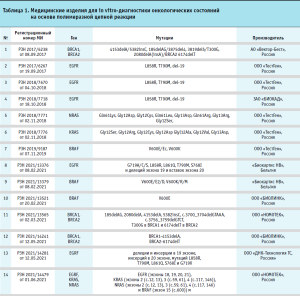

Мутации RAS присутствуют примерно в 50–55% случаев колоректального рака (КРР). Клиническая значимость обнаружения мутаций RAS была ранее установлена как обязательный тест перед началом терапии антителами против рецептора эпидермального фактора роста (EGFR) для прогнозирования эффективности при метастатическом КРР [3–4]. Проспективно-ретроспективный анализ биомаркеров в рандомизированных клинических испытаниях последовательно продемонстрировал, что антитела против EGFR, цетуксимаб и панитумумаб, вряд ли принесут пользу пациентам с мутациями в экзонах 3 и 4 KRAS и экзонах 2, 3 и 4 NRAS, в дополнение к пациентам с мутациями в экзоне 2 KRAS [5]. Более того, результаты клинических испытаний показали, что общая выживаемость, возможно, лучше, когда пациенты получают терапию против EGFR в качестве терапии первой линии, чем при лечении бевацизумабом в популяции дикого типа RAS [6]. Это говорит о том, что статус мутации RAS имеет большое влияние на решение о лечении у пациентов с метастатическим КРР.
Во многих исследованиях сообщается, что мутация V600E в гене BRAF выявляется примерно у 5–12% пациентов с метастатическим КРР. Мутации RAS и BRAF V600E практически исключают друг друга. В отличие от мутаций RAS, прогностическая ценность мутаций BRAF для эффективности терапии антителами против EGFR менее определена. С другой стороны, мутация V600E в гене BRAF приводит к плохому прогнозу или быстрому прогрессированию независимо от лечения метастатического КРР [7]. Недавно появилась информация о том, что триплетная химиотерапия, сочетающая 5-фторурацил, оксалиплатин и иринотекан (FOLFOXIRI) с бевацизумабом, более эффективна, чем другие виды химиотерапии для пациентов с мутацией V600E в гене BRAF. Консенсусные рекомендации по онкологии (ESMO) рекомендуют FOLFOXIRI плюс бевацизумаб в качестве предпочтительного выбора для этих пациентов [8].
Гены BRCA1/2 относятся к группе генов-онкосупрессоров. Продукты этих генов участвуют в процессе гомологичной репарации двунитевых разрывов ДНК. Клинически значимые мутации в генах BRCAI и BRCA2 ассоциированы с повышенным риском развития рака молочной железы и яичников у женщин, рака грудной и предстательной железы у мужчин [9]. Порядка 5–10% случаев рака молочной железы и 10–20% рака яичников являются наследственными [10]. Мутации в генах BRCA1 и BRCA2 объясняют от 20 до 50% всех случаев наследственных новообразований при раке молочной железы [11–12]. Анализ на наличие мутаций в генах BRCA1 и BRCA2 показан в рамках программы скрининга и профилактики рака молочной железы с целью выявления наследственной предрасположенности женщинам, у родственников которых был диагностирован рак молочной железы или яичников, или была обнаружена мутация в одном из генов. Обнаружение мутаций у клинически здоровых женщин позволяет провести своевременную диагностику, выявить опухоль на ранних этапах развития, малотравматично удалить её, сохраняя после операции комфортный уровень жизни в течение продолжительного срока. Обнаружение мутаций в генах BRCAI и BRCA2 крайне важно и для тех пациентов, у которых диагноз уже установлен, поскольку позволяет более точно определить прогноз заболевания и подобрать более эффективную схему лечения.
Таким образом, следует отметить, что в настоящее время зарегистрированы актуальные с научной и клинической точки зрения изделия для диагностики онкологических состояний. Среди производителей изделий присутствуют как отечественные, так и зарубежные компании.
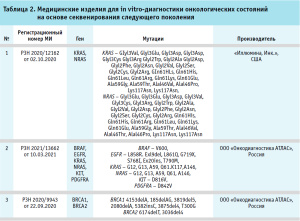
Медицинские изделия для диагностики in vitro на основе секвенирования следующего поколения (NGS)
Секвенирование следующего поколения (NGS), также называемое массовым параллельным секвенированием, было разработано в последнее десятилетие и позволяет одновременно секвенировать миллионы фрагментов ДНК без предварительного знания последовательности. Эта передовая технология произвела настоящую революцию по сравнению с традиционными методами секвенирования, в которых один или несколько относительно коротких фрагментов ДНК, ранее амплифицированных с помощью полимеразной цепной реакции (ПЦР), можно было секвенировать в каждой пробирке. Из-за высокой стоимости и трудоемкости традиционное секвенирование выполнялось только на определенных участках ДНК и на конкретных образцах. Например, генетический скрининг гетерозиготных мутаций, таких как в случае рака груди / яичников или синдромов Линча, ранее был основан на скрининге гетеродуплексов ДНК с помощью различных методов, не связанных с секвенированием. Проекту «Геном человека», который был запущен в 1990 г., потребовалось 13 лет и миллиарды евро, чтобы секвенировать полный геном человека. Секвенирование следующего поколения (NGS) позволяет секвенировать большое количество нуклеотидов в короткие сроки по доступной цене.
В 2017 г. FDA одобрило два теста NGS, которые анализируют большее количество генов – FoundationOne CDx (F1CDx) и тест MSK-IMPACT. Есть также несколько других тестов NGS, одобренных FDA, которые нацелены на конкретный ген или набор генов, например, Oncomine Dx Target Test для рака легких (в 2017 г.), Расширенная панель RAS Illumina для рака толстой кишки (в 2017 г.) или Focus CDx BRCA LOH (в 2018 г.). В России изделия для анализа большого количества генов стали регистрироваться относительно недавно. Российская компания «Онкодиагностика АТЛАС» зарегистрировала первый тест в России на основе секвенирования следующего поколения для анализа мутаций в генах BRCА1 и BRCA2 в 2020 г.
В настоящее время зарегистрировано уже несколько тестов (см. табл. 2), в том числе изделие «Набор реагентов Praxis Extended RAS Panel для качественного определения специфических мутаций генов RAS (KRAS (экзоны 2, 3 и 4) и NRAS (экзоны 2, 3 и 4) методом секвенирования нового поколения в пробе геномной ДНК человека, выделенной из образцов тканей колоректального рака, фиксированных в формалине и заключенных в парафиновые блоки», которое позволяет одновременно определять 56 мутаций в клиническом образце.
Медицинские изделия для диагностики in vitro на основе иммуногистохимии и флуоресцентной гибридизации in situ
Достижения в области новых и инновационных методов таргетной терапии произвели революцию в лечении многих видов рака. Примерами являются моноклональные антитела (например, пембролизумаб и др.) для различных опухолей, а также ингибиторы BRAF для рака, такого как метастатическая меланома, для которого ранее не было эффективного лечения. Однако эти целевые методы лечения работают только тогда, когда также доступна сопутствующая диагностика, которая используется для определения того, является ли таргетная терапия подходящим вариантом лечения для человека. Например, иматиниб эффективен при лечении ХМЛ, однако его следует назначать только пациентам, лейкозные клетки которых содержат слитый белок bcr-abl, и для определения этого требуется доступ к цитогенетическим или молекулярным исследованиям. Аналогичная сопутствующая диагностика необходима для тамоксифена (тестирование рецепторов эстрогена), пембролизумаба (тестирование PD-L1 и/или микросателлитной нестабильности) и ингибиторов BRAF (тестирование опухолевых клеток BRAF).
В настоящее время в России зарегистрирован ряд изделий, которые могут использоваться в сопутствующей диагностике для таргетной терапии (см. табл. 3).
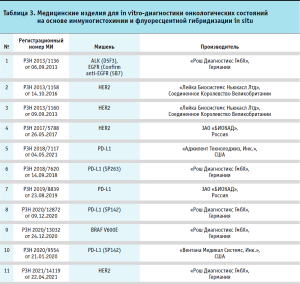
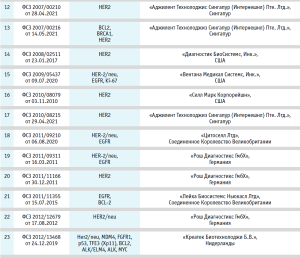
Как видно из представленных данных, одной из мишеней для сопутствующей диагностики является PD-L1 – белок лиганда-1 программируемой клеточной смерти (PD-L1). Данный реагент был разработан для определения пациентов, которые с большей степенью вероятности отреагируют на лечение препаратом, например, TECENTRIQ®. PD-L1 – это трансмембранный белок, который подавляет иммунные ответы, связываясь с двумя рецепторами белка программируемой смерти-1 (PD-1) и B7.1. Белок представляет собой ингибиторный рецептор, который экспрессируется на Т-лимфоцитах после активации Т-лимфоцитов, стабильно присутствующий при состояниях постоянной стимуляции, таких как хроническая инфекция или рак. Связывание PD-L1 с PD-1 подавляет пролиферацию T-лимфоцитов, продукцию цитокинов и цитолитическую активность, что приводит к функциональной инактивации или истощению Т-лимфоцитов. B7.1 – молекула, которая экспрессируется на антигенпредставляющих клетках и активированных Т-лимфоцитах. Связывание PD-L1 с B7.1 на T-лимфоцитах и антигенпредставляющих клетках может способствовать снижению числа иммунных ответов, включая ингибирование активации T-лимфоцитов и выработки цитокинов. Таким образом, прерывание метаболического пути PD-L1/ PD-1 представляет собой перспективную стратегию укрепления опухолеспецифического Т-клеточного иммунитета, подавляемого экспрессией PD-L1 в опухолевом микроокружении.
Другой важный белок – онкопротеин c-erbB-2 является одним из важнейших маркеров рака груди и желудка (HER2). Он обладает значительным сходством с EGFR и, как и EGFR, проявляет тирозинкиназную активность. Амплификация и избыточная экспрессия гена белка c-erbB-2 обнаружена во многих опухолях, в том числе в клетках рака груди и желудка [13–14]. При раке груди и желудка в ряде случаев продемонстрирована эффективность направленной терапии HER2. Направленная терапия HER2 будет эффективна только при раке груди и желудка, положительных на антиген HER2. Диагностика in vitro HER2-статуса при раке груди и желудка является важным методом, помогающим клиницисту определить пациентов, которым может быть назначена направленная терапия HER2. Исследование экспрессии HER2 используется для оценки опухоли у пациентов с раком груди или желудка, которым планируется назначить препарат Herceptin, и у пациентов с раком молочной железы, которым планируется назначить такие препараты, как адо-трастузумаб эмтанзин или пертузумаб.
Conclusion.
В заключение необходимо отметить, что понимание традиционных и текущих методов диагностики рака жизненно важно для представления «желаемого будущего» диагностики рака, когда будущие формы диагностики рака будут интегрированы в региональные, национальные или местные планы борьбы с раком. В целом следует заключить, что текущий ландшафт IVD в России позволяет решать большинство задач в диагностике онкологических заболеваний.
_______________________________________________________________________
1 Cancer Research UK. Saving lives, averting costs – An analysis of the financial implications of achieving earlier diagnosis of colorectal, lung and ovarian cancer.; 2014 [Cited 2020 Sept.01. URL: https://www.cancerresearchuk.org/sites/default/files/saving_ lives_averting_costs.pdf.
2 World Health Organization. Second WHO Model List of Essential In Vitro Diagnostics. [Online].;2019 [Cited 2020 Sept 15. URL: https://www.who.int/medical_devices/publications/Standalone_document_v8.pdf?ua=1.
3 National Cancer Institute. Tumor Markers. [Online].;2019 [Cited 2020 Sept.15. URL: https://www.cancer.gov/about-cancer/ diagnosis-staging/diagnosis/tumor-markers-fact-sheet
4 World Health Organization. Second WHO Model List of Essential In Vitro Diagnostics. [Online].;2019 [Cited 2020 Sept.15. URL: https://www.who.int/medical_devices/publications/Standalone_document_v8.pdf?ua=1.
- Ginsburg O., Yip C.H., Brooks A., Cabanes A., Caleffi M., Dunstan Yataco J.A., Gyawali B., McCormack V., McLaughlin de Anderson M., Mehrotra R., Mohar A., Murillo R., Pace L.E., Paskett E.D., Romanoff A., Rositch A.F., Scheel J.R., Schneidman M., Unger-Saldan˜a K., Vanderpuye V., Wu T.Y., Yuma S., Dvaladze A., Duggan C., Anderson B.O. Breast cancer early detection: A phased approach to implementation. Cancer. 2020 May 15; 126 Suppl 10(Suppl 10): 2379–2393. doi: 10.1002/cncr.32887.
- Binder C., et al. Costs and benefits of diagnostic testing: four ways to improve patient care by purposive use of in vitro diagnostics. Swiss Med Wkly. 2017 Nov; 147: w14546
- Douillard J.Y., Siena S., Cassidy J., Tabernero J., Burkes R., Barugel M., Humblet Y., Bodoky G., Cunningham D., and Jassem J., et al (2010). Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 28(31), 4697–4705. http://dx.doi.org/10.1200/JCO.2009.27.4860.
- Lie`vre A., Bachet J.B., Le Corre D., Boige V., Landi B., Emile J.F., Coˆte J.F., Tomasic G., Penna C., and Ducreux M., et al (2006). KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 66(8), 3992–4005. http://dx.doi.org/10.1158/0008-5472.CAN-06-0191.
- Heinemann V., von Weikersthal L.F., Decker T ., Kiani A., Vehling-Kaiser U., AlBatran S.E., Heintges T., Lerchenmuller C., Kahl C., and Seipelt G., et al (2014). FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomized, open-label, phase 3 trial. Lancet Oncol 15, 1065–1075. http://dx.doi. org/10.1016/S1470-2045(14)70330-4.
- Rivera F., Karthaus M., Hecht J.R., Sevilla I., Forget F., Fasola G., Canon J.L., Guan X., Demonty G., and Schwartzberg L.S., et al (2017). Final analysis of the randomised PEAK trial: overall survival and tumour responses during first-line treatment with mFOLFOX6 plus either panitumumab or bevacizumab in patients with metastatic colorectal carcinoma. Int J Color Dis 32, 1179–1190. http://dx.doi.org/10.1007/s00384-017-2800-1.
- Yokota T., Ura T., Shibata N., Takahari D., Shitara K., Nomura M., Kondo C., Mizota A., Utsunomiya S., and Muro K., et al (2011). BRAF mutation is a powerful prognostic factor in advanced and recurrent colorectal cancer. Br J Cancer 104, 856–862. http://dx.doi.org/10.1038/bjc.2011.
- Van Cutsem E., Cervantes A., Adam R., Sobrero A., Van Krieken J.H., Aderka D., Aranda Aguilar E., Bardelli A., Benson A., and Bodoky G., et al (2016). ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 27(8), 1386–1422. http://dx.doi.org/10.1093/annonc/ mdw235.
- Wooster R., Bignell G., Lancaster J., Swift S., Seal S., Mangion J., Collins N., Gregory S., Gumbs C., Micklem G. Identification of the breast cancer susceptibility gene BRCA2. Nature. 1995 Dec 21–28; 378(6559): 789–92. doi: 10.1038/378789a0. Erratum in: Nature 1996 Feb 22; 379(6567): 749. PMID: 8524414
- Mavaddat N., Antoniou A.C., Easton D.F., Garcia-Closas M. Genetic susceptibility to breast cancer. Mol Oncol. 2010 Jun; 4(3): 174–91. doi: 10.1016/j.molonc.2010.04.011. Epub 2010 May 21. PMID: 20542480; PMCID: PMC5527934.
- Antoniou A.C., Pharoah P.D., Narod S., Risch H.A., Eyfjord J.E., Hopper J.L., Olsson H., Johannsson O., Borg A., Pasini B., Radice P., Manoukian S., Eccles D.M., Tang N., Olah E., Anton-Culver H., Warner E., Lubinski J., Gronwald J., Gorski B., Tulinius H., Thorlacius S., Eerola H., Nevanlinna H., Syrjakoski K., Kallioniemi O.P., Thompson D., Evans C., Peto J., Lalloo F., Evans D.G., Easton D.F. Breast and ovarian cancer risks to carriers of the BRCA1 5382insC and 185delAG and BRCA2 6174delT mutations: a combined analysis of 22 population based studies. J Med Genet. 2005 Jul; 42(7): 602–3. doi: 10.1136/jmg.2004.024133. PMID: 15994883; PMCID: PMC1736090.
- Turnbull C., Rahman N. Genetic predisposition to breast cancer: past, present, and future. Annu Rev Genomics Hum Genet. 2008; 9: 321–45. doi: 10.1146/annurev.genom.9.081307.164339. PMID: 18544032.
- Corbett I.P., Henry J.A., Angus B., Watchorn C.J., Wilkinson L., Hennessy C., Gullick W.J., Tuzi N.L., May F.E., Westley B.R., et al. NCL-CB11, a new monoclonal antibody recognizing the internal domain of the c-erbB-2 oncogene protein effective for use on formalin-fixed, paraffin-embedded tissue. J Pathol. 1990 May; 161(1): 15–25. doi: 10.1002/path.1711610105. PMID: 1973458.
- Nicholson R.I., McClelland R.A., Finlay P., Eaton C.L., Gullick W.J., Dixon A.R., Robertson J.F., Ellis I.O., Blamey R.W. Relationship between EGF-R, c-erbB-2 protein expression and Ki67 immunostaining in breast cancer and hormone sensitivity. Eur J Cancer. 1993; 29A(7): 1018–23. doi: 10.1016/s0959-8049(05)80215-1. PMID: 8098946.
