DRUG PROVISION
Marketing analysis of the Russian market of biologically active additives: realities and prospects
1 — Federal State Budgetary Educational Institution of Higher Education “St. Petersburg State Chemical and Pharmaceutical University” of the Ministry of Health of the Russian Federation, 14 lit. A, Prof. Popov str., St. Petersburg, 197022, Russian Federation.
2 — Federal State Budgetary Educational Institution of Higher Education “St. Petersburg State Chemical and Pharmaceutical University” of the Ministry of Health of the Russian Federation, 14 lit. A, Prof. Popov str., St. Petersburg, 197022, Russian Federation.
3 — Federal State Budgetary Educational Institution of Higher Education “St. Petersburg State Chemical and Pharmaceutical University” of the Ministry of Health of the Russian Federation, 14 lit. A, Prof. Popov str., St. Petersburg, 197022, Russian Federation.
4 — Federal State Budgetary Educational Institution of Higher Education “St. Petersburg State Chemical and Pharmaceutical University” of the Ministry of Health of the Russian Federation, 14 lit. A, Prof. Popov str., St. Petersburg, 197022, Russian Federation.
The study presents the results of a marketing analysis of the Russian market of dietary supplements, as well as data from the monitoring of judicial practice in terms of dietary supplements turnover. A persistent monotonous trend towards expanding the range of dietary supplements has been established, indicating a high rate of product range renewal. At the same time, in the assortment matrix of dietary supplements, the majority of positions (60,29%) are represented by Russian pharmaceutical manufacturers. Monitoring of judicial practice demonstrates the prevalence of violations of legislation caused by the content of prohibited substances (57,89%). It is impossible to solve the safety problem of dietary supplements without taking into account medical, organizational, pharmaceutical and legal aspects.
Keywords: biologically active additives, marketing analysis
Background.
На сегодняшний день неоспоримым представляется тот факт, что российский рынок БАД характеризуется монотонной тенденцией к расширению номенклатуры и росту объемов продаж, конкурируя с рынком лекарственных препаратов (ЛП) [4, 6, 7]. По данным DSM Group, за последние пять лет рынок БАД в аптечном сегменте характеризуется ежегодными темпами прироста на уровне 13–20% [2].
Во многом это обусловлено тем обстоятельством, что оборот пищевых добавок в преломлении к современному нормативно-правовому полю обращения ЛП характеризуется упрощенными требованиями и механизмами государственного регулирования, в том числе в отношении показателей качества и безопасности. Так, в качестве эквивалента доклинических исследований ЛП рекомендована оценка функциональной активности БАД. Исследование клинической эффективности и безопасности в отношении данной категории товаров аптечного ассортимента может быть реализовано в рамках изучения органолептических свойств, переносимости, а также путем проведения общеклинических и дополнительных тестов. Стоит отметить, что вопросы механизма действия БАД остаются открытыми или носят вероятностный характер, основанный на эмпирических данных опыта применения компонентов конечного продукта.
Специфика БАД заключается в том, что их производство и реализация напрямую связаны с правоотношениями в сфере оборота пищевых продуктов, а косвенно – с правоотношениями в сфере здравоохранения. БАД относится к пищевым продуктам, что закреплено в ст. 1 Федерального закона от 02.01.2000 №29-ФЗ «О качестве и безопасности пищевых продуктов». Согласно дефиниции, пищевые продукты (пищевая продукция, продовольственные товары, продукты питания) – продукты животного, растительного, микробиологического, минерального, искусственного или биотехнологического происхождения в натуральном, обработанном или переработанном виде, которые предназначены для употребления человеком в пищу. Биологически активные вещества, компоненты пищи и продукты, являющиеся их источниками, используемые при изготовлении БАД к пище, должны обеспечивать их эффективность и не оказывать вредного воздействия на здоровье человека. На территории Российской Федерации процессы производства (изготовления), хранения, перевозки (транспортирования), реализации и утилизации, а также маркировка и безопасность БАД регламентируются техническими регламентами Таможенного союза ТР ТС 021/2011, ТР ТС 022/2011, ТР ТС 029/2012 [9, 10, 11]. При этом БАД не относятся к лекарственным препаратам, их производство и реализация лицензированию не подлежат. Все это, в конечном итоге, обуславливает цели их конечного использования, правила реализации, стратегию ценообразования и определяет привлекательность для производителя с точки зрения формирования ассортиментного портфеля, в т.ч. в аптечном сегменте.
Цель исследования
Целью настоящего исследования стала оценка состояния российского рынка биологически активных добавок, а также выявление векторов его приоритетного развития.
Материалы и методы
Материалами для исследования служили данные реестра свидетельств о государственной регистрации Роспотребнадзора по состоянию на 01.01.2024 г. Для проектирования максимально корректного дизайна исследования сформирован информационный массив, характеризующий ассортиментную матрицу БАД в рамках национального фармацевтического рынка Российской Федерации. Мониторинг судебной практики проводили с помощью кросс-платформенной справочной правовой системы «Консультант плюс» на уровне решений высших судов за период с 01.01.2016 г. по 31.12.2023 г. с использованием расширенного поиска по ключевым словам «биологически активные добавки».
Оценку сформированных баз данных проводили с помощью контент-анализа, а также методов группировки, ранжирования и систематизации. Графический анализ использован для визуализации результатов. Обработка данных осуществлялась с использованием MS Excel 2021.
Результаты и обсуждение
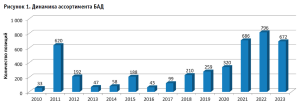
Установлено, что за период с 10.09.2010 по 31.12.2023 гг. на территории Российской Федерации зарегистрировано 4223 позиции БАД. При этом обращает на себя внимание монотонная тенденция к расширению номенклатуры данной категории товаров аптечного ассортимента на протяжении исследуемого периода с максимумом в 796 единиц, что указывает на высокие темпы обновления (рис. 1).
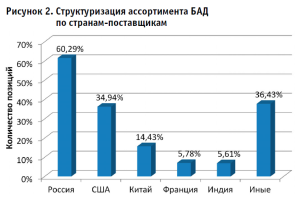
Анализ ассортиментной матрицы БАД позволил установить, что 60,29% позиций представлены российскими производителями, 39,71% – зарубежного происхождения. Структура импорта сформирована 56 странами-поставщиками. Наибольший вклад в структуру импорта вносят Соединенные Штаты Америки (34,94%), Китай (14,43%), Франция (5,78%) и Индия (5,61%) (рис. 2). Вклад других стран-поставщиков составляет менее 3%, охватывая суммарно более 36% ассортимента.
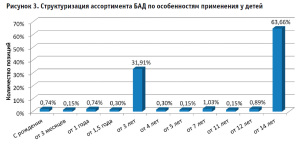
Сегментирование российского рынка БАД по возрастным группам потребителей позволило установить, что производители преимущественно обозначают возможность применения добавок взрослыми (85,63%), в меньшей степени – детьми (14,24%) и гериатрической когортой (0,13%). В свете данных рассуждений обращает на себя внимание ограничение числа позиций для применения на ранних и поздних периодах развития и функционирования организма. При этом возрастная дифференциация ассортимента отмечается также для категории потребителей младше 18 лет (рис. 3).
Результаты структурного анализа предложения в разрезе гендерной специфики демонстрируют превалирующую разработку БАД на население без дифференциации (97,23%). Целевые позиции, ориентированные на мужчин, составляют 1,75%, для женщин – 1,02%.
Оценка ассортимента по особенностям применения позволяет констатировать преобладание позиций, применяемых в качестве дополнительного источника биологически активных веществ в целом (97,30%). В отдельных случаях БАД рекомендуют при повышенных физических нагрузках (1,14%), для контроля массы тела (0,71%), а также при беременности и лактации (0,54%), планировании беременности (0,26%) или менопаузе (0,05%).
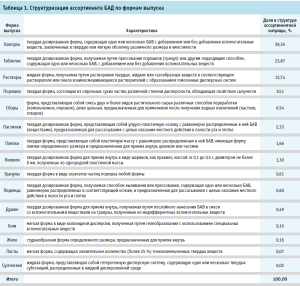
Ранжирование ассортимента БАД по формам выпуска демонстрирует наибольшую распространенность капсул и таблеток, удельный вес которых составляет 39,46% и 23,87% в структуре матрицы соответственно (табл. 1).
Анализ российского рынка БАД по содержанию биологически активных веществ и пробиотических микроорганизмов позволяет отметить тенденцию к сочетанию нескольких групп действующих веществ в одном продукте. Так, монокомпонентные добавки охватывают 45% ассортимента, бинарные композиции составляют 34% в структуре матрицы, тройные комбинации веществ – 15%, содержащие более трех активов – 6%. Структуризация ассортимента БАД по составу приведена в табл. 2.
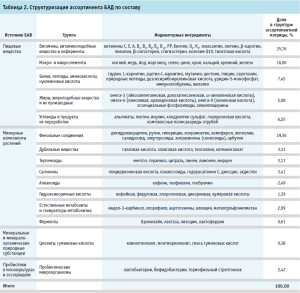
Сравнительная оценка монокомпонентных БАД позволила выделить позиции, разработанные на основе витаминов, витаминоподобных веществ и коферментов (22,99%), фенольных соединений (21,52%), а также макро- и микроэлементов (13,39%).
Установлено, что превалирующими по частоте встречаемости бинарными композициями являются комбинации витаминов, витаминоподобных веществ и коферментов с макро- и микроэлементами (411 БАД), фенольными соединениями (149 БАД), а также жирами, жироподобными веществами и их производными (111 БАД).
Анализ тройных композиций демонстрирует преобладание БАД, сочетающих в одном продукте витамины, витаминоподобные вещества и коферменты, макро- и микроэлементы с фенольными соединениями (100 БАД), белками, пептидами, аминокислотами, нуклеиновыми кислотами (41 БАД), а также с углеводами и продуктами их переработки (36 БАД) .
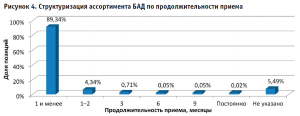
Результаты ассортиментного анализа реестра БАД демонстрируют вариабельность показателей по срокам годности и рекомендуемой продолжительности приема. Так, максимальный срок годности (до пяти лет) имеют чаи и сборы, а минимальный (до 15 суток) – добавки животного происхождения. Длительность применения конечного продукта, как правило, составляет до одного месяца (рис. 4).
В результате систематизации полученных данных построен макроконтур российского рынка БАД (рис. 5).
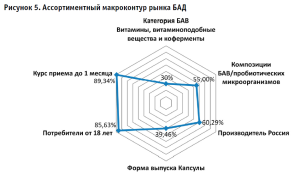
Основные параметры ассортимента демонстрируют, что формирование рынка осуществляется преимущественно (60,29%) российскими компаниями-производителями. При этом макроконтур регистрирует лидирующие позиции витаминов, витаминоподобных веществ и коферментов (30,25%) в составе БАД. Наиболее широко представлены добавки в композициях (55%) в форме капсул (39,46% предложения). Важно подчеркнуть, что 85,63% позиций разрешены к применению с 18 лет, превалирующая доля БАД рассчитана на продолжительный курс применения.
В контексте безопасности БАД стоит отметить, что такие обязательные для лекарственного средства показатели качества, как чистота и количественное содержание действующих веществ, производитель БАД контролировать не обязан. Более того, несмотря на необходимость нанесения на потребительскую упаковку информации по входящим ингредиентам, методы оценки клинической эффективности, в т.ч. в условиях применения конкретной группы БАВ, на сегодняшний день не установлены, что зачастую приводит к формализации данного требования и, как следствие, обуславливает риски для конечных потребителей [12]. При этом каждая партия продукта должна сопровождаться документацией, позволяющей определить происхождение и соответствие качества по показателям токсикологической и микробиологической безопасности, заявленным в Технических условиях производителя и соответствующих положениям ТР ТС 021/2011 [9].
Анализ судебной практики в отношении оборота БАД за 2016–2023 гг. позволяет утверждать, что превалирующим (57,89%) нарушением является содержание запрещенных веществ, несоответствие заявленной дозировке (31,58%) и профилю микробиологической безопасности БАД по содержанию бактерий группы кишечной палочки (10,53%) [9].
Conclusion.
На сегодняшний день нет прямого запрета на применение или рекомендацию БАД медицинскими и фармацевтическими работниками. Более того, при формировании клинических рекомендаций допустимо включать лекарственные препараты, медицинские изделия и специализированные продукты лечебного питания, имеющие государственную регистрацию. Стойкое развитие рынка БАД, разнообразие рыночных позиций в сегменте пищевых добавок, а также смешение понятий лекарственного препарата и БАД в глазах потребителя, требуют совершенствования механизмов государственного регулирования оборота на всех этапах жизненного цикла продукта. Решение проблемы безопасности БАД невозможно без учета медицинских, организационно-фармацевтических и правовых аспектов.
- Register of state registration certificates [Website]. Available at: http://fp.crc.ru/evrazes/?type=max / (Accessed: 01.12.2024). (In Russian).
- DSM Group [Website]. Available at: https://dsm.ru/ (Accessed: 01.12.2024). (In Russian).
- ConsultantPlus [Website]. Available at: https://www.consultant.ru (Accessed: 01.12.2024). (In Russian).
- AlphaRM [Website]. Available at: https://alpharm.ru/ru/ (Accessed: 01.12.2024). (In Russian).
- Nemyatyh O.D. Drugs and dietary supplements: what can we prescribe to patient and when. / O.D. Nemyatyh, S.K. Zyryanov, A.V. Abricov // Klinicheskij razbor v obshhej medicine (Clinical review for general practice). – 2023. – №4(7). – P. 85–93. DOI: 10.47407/kr2023.4.7.00292. (In Russian).
- Sigova A.S. The dietary supplement market after the pandemic / A.S. Sigova // Molodoj ucheny`j (Young scientist). – 2020. – No. 51 (341). – P. 108–110. – EDN URUZXR. (In Russian).
- Belousova O.V. Biologically active additives as a promising direction for the development of the pharmaceutical market // Scientific results of biomedical research / O.V. Belousova, E.A. Belousov, A.O. Ivaschenkova // Nauchny`j rezul`tat. Medicina i farmaciya (Scientific result. Medicine and pharmacy). – 2016. – Vol. 4, № 4. – P. 89–94. DOI: 10.18413/2313-8955-2016-2-4-89-94. (In Russian).
- Zamkina M.A. Medicines and biologically active supplements: legal basis, regulatory mechanisms of state regulation, risks in the sphere of circulation / M.A. Zamkina // Young pharmacy – the potential of the future: Collection of materials of the XIV All-Russian scientific conference with international participation of the Youth Scientific Society of St. Petersburg Chemical Pharmaceutical University, St. Petersburg, March 28, 2024. - St. Petersburg: St. Petersburg State Chemical Pharmaceutical University, 2024. – P. 986–990. – EDN RUOQPD. (In Russian).
- Decision of the Customs Union Commission dated 09.12.2011 No. 880 (as amended on 25.11.2022) “On the adoption of the technical regulations of the Customs Union “On Food Safety” (together with “TR CU 021/2011. Technical regulations of the Customs Union. On Food Safety”)” [Website] URL: https://www.consultant.ru/document/cons_doc_LAW_124768/ (Accessed: 01.12.2024). (In Russian).
- Decision of the Customs Union Commission dated 09.12.2011 No. 881 “On adoption of technical regulations of the Customs Union “Food Products Labelling” (together with “TR CU 022/2011. Technical regulations of the Customs Union. Food products in terms of their labeling“)” [Website] URL: https://www.consultant.ru/document/cons_doc_LAW_124614/ (Accessed: 01.12.2024). (In Russian).
- Decision of the Council of the Eurasian Economic Commission of 20.07.2012 No. 58 (as amended on 29.08.2023) “On adoption of the technical regulations of the Customs Union “Safety requirements for food additives, flavorings and technological aids” (together with “TR CU 029/2012. Technical regulations of the Customs Union. Safety requirements for food additives, flavorings and technological aids”)” [Website] URL: https://www.consultant.ru/document/cons_doc_LAW_133445/ (Accessed: 01.12.2024). (In Russian).
- MUK 2.3.2.721-98. 2.3.2. Food products and food additives. The definition of safety and efficacy of biologically active additives to food [Website]. Available at: https://www.consultant.ru (Accessed: 01.12.2024). (In Russian).
