CIRCULATION OF MEDICAL DEVICES
Changes of the procedure of medical devices import into the territory of the Russian Federation for the purpose of their state registration
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
The article deals with import of medical devices into the Russian Federation for state registration. The import procedure of medical devices into the Russian Federation for state registration, which entered into force on 01.01.2021, is described. Some of the peculiarities of the import procedure of medical devices into the Russian Federation for state registration are explained.
Keywords: medical devices, import of medical devices, permit for medical device import, notice of rejection to issue a permit for medical device import, public service
С 1 января 2021 г. вступили в силу приказ Минздрава России от 30.06.2020 № 661н «Об утверждении порядка ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации» и приказ Росздравнадзора от 30.11.2020 № 11205 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче разрешений на ввоз на территорию Российской Федерации медицинских изделий в целях их государственной регистрации», которые регламентируют порядок ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации (далее – ввоз медицинских изделий). Вследствие этого признаны утратившими силу приказ Минздрава России от 15.06.2012 № 7н «Об утверждении Порядка ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации» и приказ Минздрава России от 25.03.2016 № 184н «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче разрешений на ввоз на территорию Российской Федерации медицинских изделий в целях их государственной регистрации».
Основным изменением государственной услуги по выдаче разрешений на ввоз медицинских изделий является полный перевод услуги в электронный формат. Подача заявителем комплекта документов для получения разрешений на ввоз медицинских изделий, рассмотрение представленного комплекта документов и предоставление заявителю разрешения на ввоз медицинских изделий или уведомления об отказе в выдаче разрешения на ввоз медицинских изделий осуществляются посредством электронных документов и информационных систем: Единого портала государственных услуг (далее – ЕПГУ) и автоматизированной информационной системы Федеральной службы но надзору в сфере здравоохранения (далее – Росздравнадзор, АИС Росздравнадзора).
Заявитель путем использования личного кабинета на ЕПГУ заполняет заявление о выдаче разрешения на ввоз, прикладывает копии договоров на проведение необходимых испытаний (исследований) и копию документа, подтверждающего полномочия уполномоченного представителя производителя, и направляет данный комплект документов в адрес Росздравнадзора.
Под необходимыми испытаниями (исследованиями) понимаются технические испытания, токсикологические исследования, клинические испытания, а также испытания в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений), требуемые для государственной регистрации, в том числе для внесения изменений в документы, содержащиеся в регистрационном досье на медицинское изделие.
Копия документа, подтверждающего полномочия уполномоченного представителя производителя, не входит в подаваемый комплект документов, если производителем медицинского изделия, место производства которого находится на территории иностранного государства, является юридическое лицо или индивидуальный предприниматель, зарегистрированные на территории Российской Федерации.
Направленный комплект документов поступает в АИС Росздравнадзора, рассматривается ответственным исполнителем, затем подготавливается решение о выдаче разрешения на ввоз медицинских изделий или об отказе в выдаче разрешения на ввоз медицинских изделий. Разрешение на ввоз медицинских изделий или уведомление об отказе в выдаче разрешения на ввоз медицинских изделий в форме электронного документа, подписанного усиленной квалифицированной электронной подписью, направляется в личный кабинет на ЕПГУ и указанную в заявлении электронную почту заявителя. Разрешения на ввоз медицинских изделий также размещаются в электронном сервисе «Информация о выданных разрешениях Росздравнадзора о ввозе медицинских изделий на территорию Российской Федерации» на официальном сайте Росздравнадзора.
Считаем важным остановиться на особенностях требований, предъявляемых к договорам на проведение необходимых испытаний (исследований) и документам, подтверждающим полномочия уполномоченного представителя производителя.
Договоры на проведение технических испытаний, токсикологических исследований, а также испытаний в целях утверждения типа средств измерений должны быть заключены с испытательными организациями, аккредитованными Федеральной службой по аккредитации. Клинические испытания должны проводиться медицинскими организациями, которые соответствуют требованиям, установленным приказом Минздрава России от 16.05.2013 № 300н «Об утверждении требований к медицинским организациям, проводящим клинические испытания медицинских изделий, и порядка установления соответствия медицинских организаций этим требованиям». Перечень медицинских организаций, которые имеют право на проведение клинических и клинико-лабораторных испытаний, опубликован в электронном сервисе «Перечень медицинских организаций, проводящих клинические испытания медицинских изделий» на официальном сайте Росздравнадзора.
Копия документа, подтверждающего полномочия уполномоченного представителя производителя, должна представляться с заверенным в установленном порядке переводом на русский язык согласно ст. 81 «Основ законодательства Российской Федерации о нотариате» от 11.02.1993 № 4462-1. Нотариус свидетельствует верность перевода с одного языка на другой, если владеет соответствующими языками. Если нотариус не владеет соответствующими языками, перевод может быть сделан переводчиком, подлинность подписи которого свидетельствует нотариус.
В свою очередь, существуют особые требования к легализации документов в зависимости от страны происхождения медицинского изделия. Согласно ст. 37 Федерального закона от 05.07.2010 № 154-ФЗ «Консульский устав Российской Федерации» официальные документы, предназначенные для представления на территории Российской Федерации, составленные с участием должностных лиц компетентных органов государства пребывания или от них исходящие, должны быть легализованы консульским должностным лицом, если иное не предусмотрено международными договорами, участниками которых являются Российская Федерация и государство пребывания. К таким международным договорам относятся «Конвенция, отменяющая требование легализации иностранных официальных документов» (заключена в г. Гааге 05.10.1961) и «Конвенция о правовой помощи и правовых отношениях по гражданским, семейным и уголовным делам» (заключена в г. Минске 22.01.1993).
Также обращаем внимание, что в соответствии с п. 10 Постановления Правительства Российской Федерации от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинского изделия» (далее – Постановление № 430) допускается ввоз в Российскую Федерацию без получения разрешения Росздравнадзора незарегистрированных медицинских изделий по Перечню медицинских изделий, которые предназначены для применения в условиях военных действий, чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, предусмотренному Приложением 1 к Постановлению № 430. При этом в течение трех рабочих дней со дня ввоза в Российскую Федерацию незарегистрированных медицинских изделий необходимо представить сведения о ввезенных сериях (партиях) медицинских изделий посредством автоматизированной системы «Сведения о медицинских изделиях, подаваемые в соответствии с Постановлением Правительства Российской Федерации от 03.04.2020 № 430» на официальном сайте Росздравнадзора.
Необходимо подчеркнуть, что процедура выдачи разрешений на ввоз медицинских изделий установлена только национальным законодательством Российской Федерации, а порядок ввоза медицинских изделий на территорию государств – членов Евразийского экономического союза не регламентирован.
Государственная услуга на получение разрешения на ввоз медицинских изделий с каждым годом становится более востребованной. После перевода государственной услуги полностью в электронный формат в 2021 г. наблюдается значительное увеличение количества подаваемых заявлений о выдаче разрешения на ввоз медицинских изделий (рис. 1).
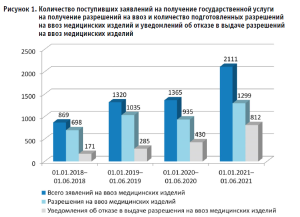
С другой стороны, качество подготовки комплектов документов, подаваемых для получения разрешений на ввоз медицинских изделий, все еще недостаточно высокое, что на фоне увеличившегося количества заявлений приводит к относительно большему количеству отказов в выдаче разрешений на ввоз медицинских изделий (рис. 2).

Таким образом, изменения порядка ввоза медицинских изделий в целях их государственной регистрации в части широкого использования информационных технологий позволяет модернизировать предоставление государственной услуги, сделать ее проще и удобнее для получения без потери качества проверки предоставляемых комплектов документов.
Надеемся, что широкое освещение вопроса о порядке ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации, в том числе в данной статье и в рамках конференции ФармМедОбращение 2021, поможет субъектам обращения медицинских изделий оптимизировать свою деятельность в данном направлении. Также на официальном сайте Росздравнадзора www.roszdravnadzor.gov.ru в подразделе «Медицинские изделия» «Ввоз медицинских изделий в целях их государственной регистрации» опубликованы методические указания «Типичные ошибки при подаче документов для получения разрешений на ввоз медицинских изделий в целях их государственной регистрации».
