STATE CONTROL AND SUPERVISION
State control over the circulation of medical devices. Results
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
The article summarizes the results of state control over the circulation of medical devices during the period of validity of the Decree of the Government of the Russian Federation dated September 25, 2012 No. 970 “On approval of the Regulation on state control over the circulation of medical devices”.
Keywords: medical device, State control over the circulation of medical devices, examination of quality, efficiency, safety of medical devices
Обращение медицинских изделий до 01 июля 2021 г. регулировалось правовыми нормами, заложенными:
- в Федеральном законе от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (далее – Закон № 323-ФЗ);
- Постановлении Правительства Российской Федерации от 25.09.2012 № 970 «Об утверждении Положения о государственном контроле за обращением медицинских изделий» (далее – Постановление № 970);
- приказе Росздравнадзора от 09.12.2019 № 9260 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению государственного контроля за обращением медицинских изделий» (далее – Приказ № 9260) Кодексе Российской Федерации об административных правонарушениях от 30.12.2001 № 195-ФЗ (далее – КоАП РФ);
- Уголовном кодексе Российской Федерации от 13.06.1996 № 63-ФЗ (далее – УК РФ).
Статьей 38 Закона № 323-ФЗ определено, что медицинские изделия – это любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека.
Государственный контроль за обращением медицинских изделий является одним из видов контроля в сфере охраны здоровья и включает в себя контроль за техническими испытаниями, токсикологическими исследованиями, клиническими испытаниями, эффективностью, безопасностью, производством, изготовлением, реализацией, хранением, транспортировкой, ввозом на территорию Российской Федерации, вывозом с территории Российской Федерации медицинских изделий, за их монтажом, наладкой, применением, эксплуатацией, включая техническое обслуживание, ремонтом, применением, утилизацией или уничтожением.
Статьей 95 Закона № 323-ФЗ установлено, что обращение медицинских изделий, которое осуществляется на территории Российской Федерации, подлежит государственному контролю.
Государственный контроль за обращением медицинских изделий включает в себя:
1) проведение проверок соблюдения субъектами обращения медицинских изделий утвержденных уполномоченным федеральным органом исполнительной власти правил в сфере обращения медицинских изделий;
2) выдачу разрешений на ввоз на территорию Российской Федерации медицинских изделий в целях их государственной регистрации;
3) проведение мониторинга безопасности медицинских изделий;
4) проведение контрольных закупок в целях проверки соблюдения запрета реализации фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий.
За прошедший период в обращении были выявлены недоброкачественные, фальсифицированные, незарегистрированные медицинские изделия (табл. 1). Росздравнадзором за период с 2014 г. было предотвращено обращение порядка 25 млн единиц медицинских изделий, не соответствующих требованиям российского законодательства, тем самым предотвращена возможная угроза причинения вреда жизни и здоровью 25 млн граждан, нуждающихся в оказании медицинской помощи.
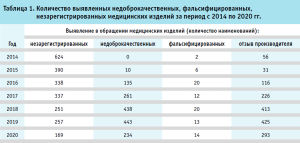
В рамках проведения государственного контроля за обращением медицинских изделий в 2014 г. было выявлено 604 наименования незарегистрированных медицинских изделий. Результаты государственного контроля за обращением медицинских изделий подтвердили необходимость принятия мер, направленных на ужесточение административной и уголовной ответственности за обращение фальсифицированных, недоброкачественных и незарегистрированных медицинских изделий. По инициативе Федеральной службы по надзору в сфере здравоохранения, при поддержке Министерства здравоохранения Российской Федерации, Федеральным законом от 31.12.2014 № 532-ФЗ, вступившим в силу 23.01.2015, были внесены изменения в КоАП РФ и УК РФ, устанавливающие и ужесточающие административные и уголовные наказания за обращение фальсифицированных, недоброкачественных и незарегистрированных медицинских изделий (табл. 2, 3).
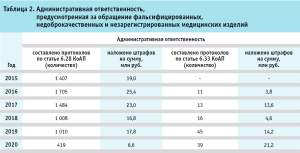
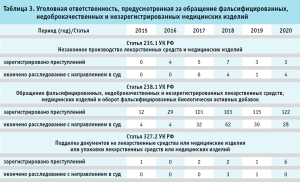
Общая сумма наложенных штрафов по административным нарушениям в сфере обращения медицинских изделий с 2015 г. составила порядка 166 млн рублей.
В рамках государственного контроля за обращением медицинских изделий налажено взаимодействие с правоохранительными органами в целях предупреждения, выявления и пресечения правонарушений в сфере обращения медицинских изделий. Так, в 2015 г. было подписано Соглашение о порядке взаимодействия Федеральной службы по надзору в сфере здравоохранения и Министерства внутренних дел Российской Федерации в части противодействия обороту фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарственных средств и изделий медицинского назначения.
Указанные меры привели к положительным результатам – в 2015 г. снизилось количество выявляемых незарегистрированных медицинских изделий, при этом увеличилось более чем на 700 количество заявлений на государственную регистрацию медицинских изделий и внесение изменений в регистрационную документацию, содержащуюся в регистрационном досье, в том числе по причине изменения адреса места производства (изготовления) медицинского изделия и причине изменения наименования медицинского изделия, совершенствования его свойств и характеристик при неизменности функционального назначения и (или) принципа действия. В 2016 г. сохранилась тенденция увеличения количества поданных заявлений на государственную регистрацию и внесение изменений в регистрационную документацию, содержащуюся в регистрационном досье, и если в 2014 г. было подано порядка 4 тыс. заявлений, то в 2016 г. количество возросло до 7,7 тыс. заявлений.
В ходе осуществления государственного контроля за обращением медицинских изделий Росздравнадзором с 2014 г. фиксируются типичные нарушения обязательных требований, характерные для различных субъектов обращения медицинских изделий (табл. 4).

Нарушения обязательных требований в разной степени могут влиять на качество и безопасность применения медицинского изделия, что, в свою очередь, влияет на безопасность и качество оказания медицинской помощи пациенту.
Результаты демонстрируют наличие типичных нарушений за весь период проведения государственного контроля за обращением медицинских изделий. Структура выявленных нарушений остается неизменной, что подтверждает необходимость внедрения системы менеджмента качества на каждом этапе обращения медицинского изделия.
Подводя итоги работы Федеральной службы по надзору в сфере здравоохранения по государственному контролю за обращением медицинских изделий, следует отметить активную работу Территориальных органов Росздравнадзора по субъектам Российской Федерации, подразделений МВД России различных уровней и других подразделений правоохранительной системы Российской Федерации в борьбе по предотвращению обращения незарегистрированных, недоброкачественных, фальсифицированных медицинских изделий.
