DRUG PROVISION
Formation R&D team as the basis of success of pharmaceutical development of generic medicinal products
1 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0002-3752-7848
2 — Федеральное государственное автономное образовательное учреждение высшего образования «Пермский государственный национальный исследовательский университет», 614990, Российская Федерация, г. Пермь, ул. Букирева, д. 15.
ORCID: orcid.org/0000-0003-4032-597Х
3— Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0002-4958-2078
4 — Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.; Федеральное государственное автономное образовательное учреждение высшего образования «Пермский государственный национальный исследовательский университет», 614990, Российская Федерация, г. Пермь, ул. Букирева, д. 15.
ORCID: orcid.org/0000-0001-5579-394X
5 — Министерство здравоохранения Пермского края, 614000, Российская Федерация, г. Пермь, ул. Ленина, д. 51.
At the stage of transition from national regulation of the circulation of medicines to a unified one within the Eurasian Economic Union, the harmonization of requirements for the pharmaceutical development of medicines determines the need to develop modern approaches not only to the development process, but also to the process of forming a team of specialists who can successfully implement the principles of improved (continuous) ) pharmaceutical development, according to the Quality By Design concept.
A mathematical model is proposed that makes it possible to predict the quantitative composition of the R&D team under the influence of several factors and when large-scale experiments are unacceptable. The calculated data based on the proposed model allow us to conclude that the process of modern high-quality development according to the requirements of the Quality By Design concept in a particular development company will be most effective when the number of drugs in development is a multiple of the coefficient k, which reflects the dependence of the number of employees on the number drugs that are at the stage of pharmaceutical development at the same time. Similarly, the total number of selected groups of drugs of I, II, III ranks of complexity and IV, V ranks of complexity must also satisfy this condition. K, отражающему зависимость количества сотрудников от количества лекарственных препаратов, находящихся на этапе фармацевтической разработки одновременно. Аналогично суммарное количество выделенных групп лекарственных препаратов I, II, III ранга сложности и IV,V рангов сложности также должны удовлетворять этому условию.
The proposed mathematical model for the quantitative selection of R&D team specialists is the basis for the approach to the formation and development of an R&D team for the pharmaceutical development of generic drugs. From the perspective of the quality assurance and regulation system regarding the pharmaceutical development of generic molecules, the following key improvement factors should be analyzed and assessed for the process of high-quality pharmaceutical development: the formation of professional competencies of R&D personnel; regulation of the procedure for interaction between participants in pharmaceutical development, introduction of scientific approaches to the organization of the pharmaceutical development process and adaptation of elements of the structure of the company’s pharmaceutical quality system, taking into account the criticality of existing processes; building a system of continuous training for R&D team members for the successful implementation of modern pharmaceutical development concepts (Quality By Design); and etc.
Keywords: pharmaceutical development, Quality By Design, R&D team, optimization, S – a certain number of developing generic medicinal products
В первой части статьи авторами была предложена математическая модель вычисления оптимального количества сотрудников, которые должны быть задействованы в процессах фармацевтических разработок (ФР) воспроизведенных лекарственных препаратов (ЛП) и определены основные участники R&D-команды. Также был представлен расчет количества сотрудников R&D-команды, которые необходимы для разработки одного воспроизведенного ЛП.
Следующей задачей проводимого исследования, решение которой будет представлено в данной (второй) части статьи, был поиск оптимального числа сотрудников для S-определенного количества разрабатываемых ЛП. Согласно техническим заданиям на ФР в рассматриваемой компании в работе одновременно могут находиться несколько ЛП в различных лекарственных формах.
В таблице 3 представлены расчеты оптимального числа сотрудников для фармацевтической разработки трех воспроизведенных ЛП (где S = 3).
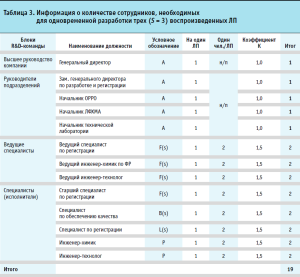
Исходя из данных таблицы 3, общее количество членов R&D-команды, задействованных в разработке трех ЛП, составит 19 сотрудников, из них: семь руководителей подразделений (представлены зависимостью HD (A;B(s)) = 7), шесть ведущих специалистов (LEX(F(s)) = 6), и шесть специалистов (исполнителей) (SP(L(s);P) = 6) соответственно.
Также в таблице 3 указаны числовые коэффициенты зависимости количества сотрудников от количества ЛП, находящихся на этапе ФР одновременно (введен коэффициент К). В дальнейших вычислениях в рамках исследования данное значение округлялось до целого значения. Результаты применения модели для различных значений параметра S (S-определенного количества разрабатываемых воспроизведенных ЛП) приведены в таблице 4.
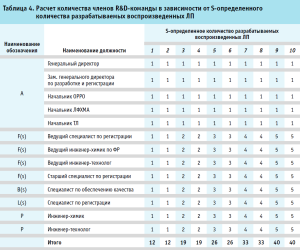
Анализ итоговых значений таблицы 4, а именно расчетное количество сотрудников R&D-команды, позволяет сделать вывод о том, что оптимальное количество сотрудников, задействованных в процессе ФР воспроизведенных ЛП, будет достигнуто только в том случае, если количество принятых к фармацевтической разработке ЛП будет кратно двум. Стоит также отметить, что если на данный момент в разработке находится нечетное количество ЛП, но необходимо их увеличение на несколько единиц, то оптимально увеличивать взятые в разработку ЛП на нечетное количество, чтобы в итоге получить четное количество разрабатываемых ЛП, соответствующее оптимальному количеству членов R&D-команды.
В рамках исследования определено, что разработанную модель возможно дополнить еще одним элементом, а именно включить в структуру такой фактор, как «дополнительные сотрудники R&Dкоманды», учитывающий работу специалистов не в зависимости от количества разрабатываемых воспроизведенных ЛП, а от использованного трудового времени, (выраженного в человеко-часах).
В данной модели оптимизация будет проводиться с учетом временных ограничений и специфики работы компании-разработчика, а зависимость может быть представлена в виде ADS(M(t)) – additional staff (дополнительный персонал), аргумент в данной зависимости – время (t).
Математическая модель в данном случае примет вид:
N(s) = HD(A;B(s)) + LEX(F(s)) +
+ SP(L(s);P) + ADS(M(t)),
где:
HD – руководители подразделений;
LEX – ведущие специалисты;
SP – специалисты (исполнители).
Следующей задачей проводимого исследования было построение математической модели вычисления оптимального количества сотрудников R&D-команды, задействованных при ФР воспроизведенных ЛП различной сложности.
Учитывая вышеперечисленные обозначения и функциональные зависимости, используемые в первой части исследования1, математическая модель вычисления оптимального количества сотрудников R&D-команды, задействованных при разработке воспроизведенных ЛП различного ранга, была представлена в виде:
N(s, t) = HD(A;B(s, t)) +
+ LEX(F(s, t)) + (2) [8]
+ SP(L(s);P).
В предложенной математической модели (2) N (S, t) – оптимальное количество сотрудников.
Учитывая, что количество ЛП, находящихся в ФР, влияет на количество работников, такая связь будет представлена функциональной зависимостью от аргумента S (S-определенное количество разрабатываемых воспроизведенных ЛП). Если сложность разработки ЛП влияет на количество работников, то такая связь в исследовании представлена функциональной зависимостью от аргумента t (где t – ранг сложности фармацевтической разработки ЛП).
Далее в работе были определены ранги сложности принятых к разработке в компании воспроизведенных ЛП с помощью применения инструментов анализа и оценки рисков для качества, а именно с использованием FMEA (Failure Mode and Effects Analysis, анализ видов и последствий отказов) (табл. 5).
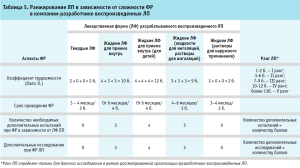
Данные по определению ранга разрабатываемых ЛП, представленные в таблице 5, показывают, что сложность процесса фармацевтической разработки ЛП зависит от ряда факторов, а именно: срока проведения ФР, количества дополнительных испытаний и исследований при ФР в зависимости от выбранной ЛФ ЛП.
Анализ информации в таблицах 5 и 6 с учетом разработанной математической модели (2), позволили вычислить оптимальное количество сотрудников R&D-команды для разработки пяти воспроизведенных ЛП различного ранга. Оптимальное количество в данном случае составило 30 членов R&D-команды организации-разработчика воспроизведенных ЛП (табл. 7).
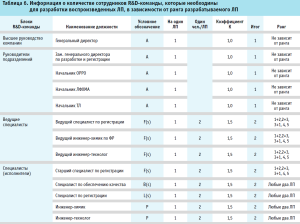
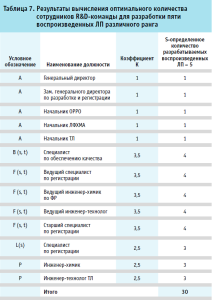
Информация, указанная в таблице 7, позволяет сделать вывод, что коэффициент в столбце «Коэффициент К» в идеальном случае должен быть целым значением, это означает, что все члены R&D-команды максимально загружены и в разработку принято оптимальное количество воспроизведенных ЛП. В случае, если числовой коэффициент К дробный (как в примере, указанном для пяти разрабатываемых ЛП), то с целью повышения эффективности работы персонала рекомендовано добавить еще один планируемый к разработке ЛП.
Результаты проведенного исследования позволяют сделать вывод о том, что для формирования R&D-команды в рассматриваемой организации-разработчике воспроизведенных ЛП, с учетом всех исходных данных, оптимальное количество сотрудников будет достигнуто при следующих условиях:
- В разработке одновременно будет находиться четное количество ЛП различного ранга сложности: I, II, III (при этом общее количество ЛП I, II, III рангов должно быть кратно двум);
- В разработке одновременно будет находиться четное количество ЛП различного ранга сложности: IV, V (при этом общее количество ЛП IV, V рангов должно быть кратно двум).
Максимально оптимизировать работу команды возможно путем соблюдения условий 1 и 2 одновременно (см. выше).
Conclusion.
Предложенная математическая модель количественного подбора специалистов R&D-команды положена в основу подхода по формированию и развитию R&D-команды для ФР воспроизведенных ЛП. При этом количество участников команды не является единственным фактором, оказывающим влияние на результаты процесса ФР воспроизведенных ЛП.
Согласно требованиям регуляторных документов по ФР, входящих как в право ЕАЭС, так и в законодательство других международных интеграционных объединений, процесс фармацевтической разработки ЛП подразумевает непрерывное улучшение качества продукта со стороны разработчика на протяжении всего жизненного цикла ЛС (в случае если отсутствуют иные договоренности между разработчиком/держателем РУ/производителем ЛП, оформленные в соглашениях по качеству).
С позиции системы обеспечения качества и регламентации в части ФР воспроизведенных молекул, анализу и оценке для процесса качественной ФР должны подвергаться такие ключевые факторы улучшений как:
- Формирование профессиональных компетенций персонала R&D-команды на основе специфики профессиональной подготовки специалистов (образования и уровень подготовки, включая кадры высшей квалификации). На сегодняшний день регуляторные документы, входящие в право ЕАЭС в части обращения и разработки ЛП, частично предписывают требования к персоналу для этапа жизненного цикла ЛП, начинающегося непосредственно с производства ЛС, однако этап ФР не регулируется и остается в зоне ответственности высшего руководства компаний-разработчиков ЛП, производителей и держателей РУ [16].
- Регламентация порядка взаимодействия участников ФР, внедрение научных подходов в организацию процесса ФР и адаптация элементов структуры ФСК компании с учетом критичности действующих процессов [17].
- Построение системы непрерывного обучения участников R&D-команды для успешной реализации современных концепций ФР (Quality By Design).
4. Развитие научной основы факторов улучшений процесса ФР воспроизведенных ЛП, связанных с деятельностью R&D-команды на уровне организации-разработчика.
_____________________________________________________________________________
1 В первой части исследования были введены следующие функциональные зависимости: руководители подразделений – HD (A; B(s, t)); ведущие специалисты – LEX (F(s, t)); специалисты (исполнители) – SP (L(s, t); P).
- Фотеева А.В., Ростова Н.Б. Развитие предприятия-производителя лекарственных препаратов в современных условиях: реальность и перспективы // Медицинский альманах. – 2018. – № 5 (56).
- Quality by Design for Generic Drugs / L.X.Yu, R. Lionberger, M.C. Olson [et al.] Pharmaceutical Technology. 2009; 33: 122–127. URL: https://www.researchgate.net/publication/295595510.
- Авторский перевод гармонизированного трехстороннего руководства ICH Q8. Фармацевтическая разработка (ICH Q8 – Pharmaceutical Development) / А.В. Александров, Н.В. Дьшька, В.А. Жулинский, Н.В. Карпенко; [пер. с англ.]. – Киев: Виалек, 2008. – 44 с.
- Рожнова С.А., Цыпкина А.В. Анализ возможности применения принципа QbD к процессу разработки лекарственных средств на отечественных фармацевтических предприятиях // Разработка и регистрация лекарственных средств. – 2019. –№ 8 (4). – С. 20–26. DOI 10.33380/2305-2066-2019-8-4-20-26.
- Смирнов В.А., Горячкин В.В., Шестаков В.Н., Абрамович Р.А Развитие систем переподготовки кадров при внедрении фармацевтической системы качества на предприятиях производства лекарственных средств стран ЕАЭС // Разработка и регистрация лекарственных средств. – 2021. – № 10 (1). – С. 130–135. DOI 10.33380/2305-2066-2021-10-1-130-135.
- Смирнов В.А., Горячкин В.В., Шестаков В.Н., Абрамович Р.А. Методические рекомендации по содействию внедрению фармацевтических систем качества на предприятиях ЕАЭС через управление вовлеченностью производственного персонала // Разработка и регистрация лекарственных средств. – 2021. – № 10 (1). – С. 136–141. DOI: 10.33380/2305-2066-2021-10-1-136-141.
- Шестаков В.Н., Подпружников Ю.В. Анализ нового риск-ориентированного регуляторного подхода к классификации нарушений в сфере GMP (обзор) // Разработка и регистрация лекарственных средств. – 2020. – № 9 (3). – С. 189–202. DOI: 10.33380/2305-2066-2020-9-3-189-202.
- Мешковский А.П., Пятигорская Н.В., Аладышева Ж.И., Береговых В.В., Пятигорский А.М., Николенко Н.С., Маршалова М.М., Беляев В.В. Обязанности держателей регистрационных удостоверений в части соблюдения правил GMP (обзор) // Разработка и регистрация лекарственных средств. – 2020. – № 9 (4). – С. 164–170. DOI: 10.33380/2305-2066-2020-9-4-164-170.
- Смехова И.Е., Шигарова Л.В., Метелева В.Д., Флисюк Е.В. Документирование фармацевтической разработки. Часть 1. Изучение документооборота предприятия // Разработка и регистрация лекарственных средств. – 2021. – № 10 (1). – С. 142–147. DOI: 10.33380/2305-2066-2021-10-1-142-147.
- Ниязов Р.Р., Рождественский Д.А., Васильев А.Н., Гавришина Е.В., Драницына М.А., Куличев Д.А. Регуляторные аспекты регистрации воспроизведенных и гибридных лекарственных препаратов в Евразийском экономическом союзе // Ремедиум. – 2018. – № 7-8. – С. 6–19.
- Фотеева А.В., Баршадская О.С., Ростова Н.Б., Конева Н.А. Регистрация и вывод на рынок орфанных препаратов в рамках Евразийского экономического союза: проблемы и пути их решения // Фармакоэкономика: теория и практика. – 2022. – № 10 (2). – С. 9-12. DOI: 10.30809/phe.2.2022.2.
- Фотеева А.В., Конева Н.А., Белоглазова О.С., Ростова Н.Б. Регулирование вывода орфанных лекарственных препаратов на рынок Евразийского экономического союза как механизм повышения доступности лечения редких заболеваний (обзор) // Разработка и регистрация лекарственных средств. – 2023. – № 12 (2). – С. 198–205. DOI: 10.33380/2305-2066-2023-12-2-198-205.
- Фотеева А.В., Баршадская О.С., Ростова Н.Б. Процедура взаимного признания при регистрации лекарственных препаратов: новые вызовы или возможности // Разработка и регистрация лекарственных средств. – 2022. – № 11(1). – С. 159–164. DOI: 10.33380/2305-2066-2022-11-1-159-164.
- Феофилова А.Е., Фотеева А.В., Ростова Н.Б, Логинова В.В. Риск-ориентированный подход оптимизации процесса фармацевтической разработки лекарственных препаратов // ПУЛЬС. – 2022. – № 24 (4). – С. 36–41. DOI: 10.26787/nydha-2686-6838-2022-24-4-38-43.
- Плотникова Е.Г. Математические методы в решении экономических задач: Учеб. пос. / Е.Г. Плотникова, В.В. Логинова. Пермский государственный национальный исследовательский университет. – Пермь, 2020. – 179 с.
- Феофилова А.Е., Фотеева А.В., Ростова Н.Б. Современные концепции фармацевтической разработки в условиях перехода к единому регулированию сферы обращения лекарственных средств // Разработка и регистрация лекарственных средств. – 2020. – № 9 (4). – С. 171–179. DOI: 10.33380/2305-2066-2020-9-4-171-179.
- Феофилова А.Е., Фотеева А.В., Прозорова Н.А., Ростова Н.Б. Роль организации-разработчика в обеспечении качества лекарственных препаратов в условиях гармонизации подходов к фармацевтической разработке // Вестник Росздравнадзора. – 2020. – № 5(2). – С. 90–98.
