DRUG PROVISION
Formation R&D team as the basis of success of pharmaceutical development of generic medicinal products
1 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0002-3752-7848
2 — Federal State Autonomous Educational Institution of Higher Education “Perm State National Research University”, 15, Bukireva str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0003-4032-597Х
3— Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2 Polevaya str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0002-4958-2078
4 — Federal State Educational Institution of Higher Education “Perm State Pharmaceutical Academy” of the Ministry of Health of the Russian Federation, 2, Polevaya str., Perm, 614990, Russian Federation.; Federal State Autonomous Educational Institution of Higher Education “Perm State National Research University”, 15, Bukireva str., Perm, 614990, Russian Federation.
ORCID: orcid.org/0000-0001-5579-394X
5 — Ministry of Health of the Perm Territory, 51, Lenin str., Perm, 614000, Russian Federation.
At the stage of transition from national regulation of the circulation of medicines to a unified one within the Eurasian Economic Union, the harmonization of requirements for the pharmaceutical development of medicines determines the need to develop modern approaches not only to the development process, but also to the process of forming a team of specialists who can successfully implement the principles of improved (continuous) ) pharmaceutical development, according to the Quality By Design concept.
A mathematical model is proposed that makes it possible to predict the quantitative composition of the R&D team under the influence of several factors and when large-scale experiments are unacceptable. The calculated data based on the proposed model allow us to conclude that the process of modern high-quality development according to the requirements of the Quality By Design concept in a particular development company will be most effective when the number of drugs in development is a multiple of the coefficient k, which reflects the dependence of the number of employees on the number drugs that are at the stage of pharmaceutical development at the same time. Similarly, the total number of selected groups of drugs of I, II, III ranks of complexity and IV, V ranks of complexity must also satisfy this condition. k, отражающему зависимость количества сотрудников от количества лекарственных препаратов, находящихся на этапе фармацевтической разработки одновременно. Аналогично суммарное количество выделенных групп лекарственных препаратов I, II, III ранга сложности и IV,V рангов сложности также должны удовлетворять этому условию.
The proposed mathematical model for the quantitative selection of R&D team specialists is the basis for the approach to the formation and development of an R&D team for the pharmaceutical development of generic drugs. From the perspective of the quality assurance and regulation system regarding the pharmaceutical development of generic molecules, the following key improvement factors should be analyzed and assessed for the process of high-quality pharmaceutical development: the formation of professional competencies of R&D personnel; regulation of the procedure for interaction between participants in pharmaceutical development, introduction of scientific approaches to the organization of the pharmaceutical development process and adaptation of elements of the structure of the company’s pharmaceutical quality system, taking into account the criticality of existing processes; building a system of continuous training for R&D team members for the successful implementation of modern pharmaceutical development concepts (Quality By Design); and etc.
Keywords: pharmaceutical development, Quality By Design, R&D team, optimization, S – a certain number of developing generic medicinal products
Background.
На сегодняшний день организации-разработчики и производители лекарственных препаратов (ЛП) находятся в условиях перехода от национального регулирования к единому в рамках Евразийского экономического союза (ЕАЭС).
С одной стороны, государством осуществляется активная поддержка отечественных производителей, направленная на развитие лекарственной безопасности населения, формирование института обеспечения качества ЛП, создание и совершенствование условий для разработки эффективных и безопасных ЛП. С другой стороны, в ЕАЭС определены новые правила и требования в сфере обращения лекарственных средств (ЛС), влекущие ужесточение требований в части фармацевтической разработки (ФР) и регистрации ЛС. В соответствии с гармонизированными документами в части ФР определена необходимость применения современного подхода в рамках концепции Quality By Design c целью дальнейшей гарантии качества разработанного ЛП на всех этапах жизненного цикла ЛП до прекращения его реализации на рынке. Данная ситуация определяет необходимость адаптации актуальных методов и инструментов ФР, а также профессиональное развитие персонала, задействованного в процессах жизненного цикла ЛП [1, 2].
Учитывая текущую геополитическую ситуацию, приоритетом политики Российской Федерации для реализации государственных программ в сфере лекарственного обеспечения является формирование научного потенциала фармацевтической промышленности – создание и совершенствование условий для разработки замещающих ЛП на основе потенциала высококвалифицированных специалистов отрасли.
В связи с этим для реализации принципов улучшенной (непрерывной) ФР, согласно концепции Quality By Design, с целью создания эффективных и безопасных ЛП с заданными показателями качества, члены R&D-команды, задействованные в процессе ФР, должны присутствовать в организации-разработчике в достаточном количестве (самостоятельно определенном высшим руководством компании-разработчика воспроизведенных ЛП) и качестве (владеют необходимыми профессиональными специализированными компетенциями), в зависимости от занимаемой должности и зоны ответственности, при этом стремящиеся непрерывно повышать свою квалификацию [3].
Учитывая вышесказанное, возрастает необходимость построения подходов к оптимизации процессов ФР (организационные технологии и методические инструменты) для обеспечения эффективной разработки, реализацию которых может обеспечить только профессиональная компетентная исследовательская R&D-команда[2].
Изучение доступных результатов проводимых научных исследований в сфере организации фармацевтической разработки и производства ЛП на современном этапе развития показало, что экспертами обсуждаются и решаются следующие задачи: возможности применения принципа Quality By Design в процессе фармацевтической разработки [4], подготовка и профессиональное развитие кадров для производства ЛП [5], а также развитие их вовлеченности в деятельность в условиях меняющихся требований [6], проблемы соблюдения правил GMP [7, 8], вопросы документированного сопровождения фармацевтической разработки [9], регуляторные аспекты регистрации ЛП [10, 11, 12, 13] и др. При этом остаются открытыми вопросы о составе команды, обеспечивающей решение задач в части ФР на основе современных концепций и требований.
В этой связи цель проводимого исследования – обоснование подхода к формированию и развитию R&D-команды для ФР воспроизведенных ЛП на основе математической модели формализованного описания ее структуры и процесса функционирования.
Материалы и методы
В работе были использованы доступные публикации и источники литературы, нормативные документы и руководства по фармацевтической разработке лекарственных препаратов, отчеты по фармацевтической разработке, а также информация компании о количестве ранжированных ЛП, поступающих в разработку, перечень базовых участников R&D-команды, задействованных в разработке одного ЛП. Достижение поставленных целей осуществлялось на основе общенаучных методов исследования в рамках логического анализа, методов фильтрации и ранжирования рисков, анализа видов и последствий отказов, анализа и интерпретации полученных данных о фармацевтической разработке, алгоритмического математического моделирования.
Результаты и обсуждение
На первом этапе исследования авторами была построена математическая модель вычисления оптимального количества сотрудников, задействованных в процессах ФР воспроизведенных ЛП.
Основные потенциальные участники R&D-команды были определены исследователями исходя из данных по ранее проведенной систематизации процессов жизненного цикла разрабатываемого ЛП и оценке их критичности на уровне организации-разработчика, а также с учетом требований современной концепции фармацевтической разработки ЛП Quality By Design с помощью применения инструментов и методов анализа и оценки рисков (с использованием модифицированного метода фильтрации и ранжирования рисков, адаптированного под цели ранжирования) (табл. 1) [14].
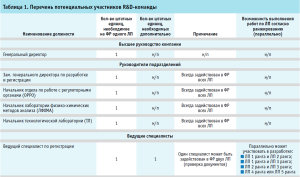
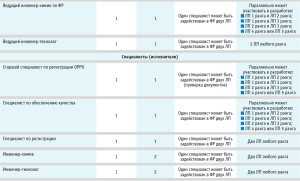
Все возможные участники R&D-команды были разделены на следующие группы (табл. 1):
- высшее руководство компании (CEO – Chief Executive Officer): генеральный директор компании-разработчика ЛП;
- руководители подразделений (HD – heads of department): заместитель генерального директора по ФР и регистрации, начальник отдела по работе с регуляторными органами (ОРРО), начальник лаборатории физико-химических методов анализа (ЛФХМА), начальник технологической лаборатории (ТЛ);
- ведущие специалисты (LEX – leading experts): ведущий специалист по регистрации ОРРО, ведущий инженер-химик по разработке ЛФХМА; ведущий инженер-технолог ТЛ;
- специалисты (исполнители) (SP – specialist performers): старший специалист по регистрации ОРРО, специалист по регистрации ОРРО, инженер-химик ЛФХМА, инженер-технолог ТЛ, специалист по обеспечению качества.
В рамках проведенного исследования были введены следующие функциональные зависимости:
- руководители подразделений – HD (A; B(s, t));
- ведущие специалисты – LEX (F(s, t));
-специалисты (исполнители) – SP (L(s, t); P).
Очевидно, что количество ЛП, находящихся в разработке, влияет на количество работников, задействованных в процессах ФР, и такая связь была представлена функциональной зависимостью от аргумента S (S – количество ЛП). А сложность разработки ЛП влияет на количество работников, и такая связь была представлена функциональной зависимостью от аргумента t (t – ранг сложности разработки ЛП).
Информация о сотрудниках, штатные единицы которых зависят от ранга сложности, представлены в таблице 2.
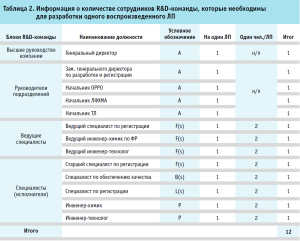
Учитывая функциональные зависимости, представленные в таблице 2, была составлена математическая модель вычисления оптимального количества сотрудников, задействованных в фармацевтической разработке ЛП:
N(s) = HD(A;B(s)) + LEX(F(s)) + SP(L(s);P). (1)
В предложенной математической модели (1) N(s) обозначает оптимальное количество сотрудников. Принимая во внимание все указанные выше зависимости, для полноценной ФР, включая подготовку документов, регистрирующих процессы и материалы регистрационного досье одного ЛП, необходимо 12 сотрудников R&D-команды [15].*
______________________________________________________________
* Окончание статьи будет опубликовано в следующем номере.
