CIRCULATION OF MEDICINES
Federal Government Information System of Track and Trace System of Medicines – a digital tool in the field of control over the circulation of medicines
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
2 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
The article provides an overview of the work of Roszdravnadzor on the implementation of an information system for monitoring the movement of medicines in the Russian Federation, registration of subjects of circulation of medicines in the system, as well as the use of monitoring system data in the control (supervisory) activities of the department.
Keywords: information Track and Trace System of Medicines, MDLP FGIS, introduction of medicines into civil circulation, means of identification, counteraction to illicit drug trafficking, drug provision monitoring
препаратов, средства идентификации, противодействие незаконному обороту лекарственных средств, мониторинг лекарственного обеспечения
Background.
В целях обеспечения эффективного контроля качества лекарственных препаратов, находящихся в обращении, и борьбы с их фальсификацией пунктом 5 перечня поручений Президента Российской Федерации по итогам совещания с членами Правительства Российской Федерации от 04.02.2015 № Пр-285 было поручено разработать и внедрить автоматизированную систему мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки и идентификации упаковок лекарственных препаратов. Федеральная государственная информационная система мониторинга движения лекарственных препаратов для медицинского применения (ФГИС МДЛП) была создана в 2017 году.
В соответствии с постановлением Правительства Российской Федерации от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» с 1 февраля 2017 года по 31 декабря 2019 года на территории Российской Федерации проводился эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения. После завершения эксперимента, начиная с 1 января 2020 года, в соответствии с постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (пункт 1.1) все юридические лица и индивидуальные предприниматели – субъекты обращения лекарственных средств – стали осуществлять регистрацию в ФГИС МДЛП.
На сегодняшний день уже накоплен достаточный опыт применения ФГИС МДЛП, чтобы четко определить основные преимущества системы:
1) для государства:
- предотвращение поступления в оборот фальсифицированных и контрафактных лекарственных препаратов и возможность одномоментного изъятия из оборота на всей территории Российской Федерации в автоматизированном режиме недоброкачественных лекарственных препаратов на любом из этапов их обращения от производителя до конечного потребителя;
- контроль адресности движения препаратов, расходов на их приобретение;
- мониторинг ценообразования на лекарственные препараты из перечня жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП);
- профилактика неэффективных расходов и экономия бюджетных средств за счет невозможности реализации схем «повторного вброса» лекарственных препаратов;
- оперативное планирование и управление запасами и резервами препаратов на всех уровнях, включая стратегический;
2) для граждан:
- возможность с помощью персонального мобильного устройства лично проверить легальность приобретаемого (получаемого) лекарственного препарата;
3) для бизнеса:
- снижение издержек за счет более эффективного управления логистикой;
- уменьшение упущенной выгоды, обусловленной контрафактной и фальсифицированной продукцией;
- соответствие требованиям для поставок продукции на международные рынки.
Обязательная маркировка в Российской Федерации – система полной прослеживаемости движения лекарственных препаратов
В Российской Федерации внедрена система полной прослеживаемости движения лекарственных препаратов.
В соответствии с Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» с 1 июля 2020 года введена обязательная маркировка для всех лекарственных препаратов для медицинского применения. Все субъекты обращения лекарственных средств обязаны с этой даты вносить сведения о маркированных лекарственных препаратах и обо всех операциях с ними в ФГИС МДЛП1.
Таким образом, с 1 июля 2020 года обязанностью производителей лекарственных средств, как субъектов обращения лекарственных средств, стало нанесение на каждую упаковку лекарственного препарата неповторяемого индивидуального DataMatrix-кода, содержащего уникальный индивидуальный серийный номер для каждой отдельной упаковки лекарственного препарата (рис. 1). Также производитель обязан осуществлять первичное внесение данных в ФГИС МДЛП.
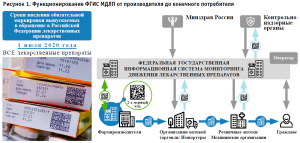
Субъекты обращения лекарственных средств несут ответственность в соответствии с законодательством Российской Федерации за производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения или внесение в нее недостоверных данных в соответствии со статьей 6.34 Кодекса Российской Федерации об административных правонарушениях.
Система мониторинга в автоматизированном режиме отслеживает движение по товаропроводящей цепочке каждой отдельной упаковки вплоть до вывода из оборота конкретной аптечной или медицинской организацией (продажа, выдача в лечебное отделение, выдача пациенту).
Субъекты обращения лекарственных средств, осуществляющие медицинскую деятельность и вывод из оборота лекарственных препаратов при оказании медицинской помощи, а также субъекты обращения лекарственных средств, отпускающие лекарственные препараты бесплатно по рецепту, представляют информацию в систему мониторинга о выводе из оборота лекарственных препаратов с использованием регистраторов выбытия, представляемых оператором системы мониторинга на безвозмездной основе.
Субъекты обращения лекарственных средств, осуществляющие розничную торговлю лекарственными препаратами и отпуск лекарственных препаратов со скидкой по рецепту на лекарственные препараты, маркированные средствами идентификации, представляют сведения о выводе из оборота лекарственных препаратов с использованием контрольно-кассовой техники.
По состоянию на июнь 2022 года во ФГИС МДЛП зарегистрировано 92 856 участников (432 иностранных), более 206 тысяч мест осуществления деятельности (производители лекарственных средств, оптовые, аптечные и медицинские организации), описано 39 429 наименований лекарственных препаратов.
По сведениям автоматизированной информационной системы (АИС) Росздравнадзора, процент подлежащих маркировке лекарственных препаратов, вводимых в гражданский оборот, на текущий момент составляет 99,95% от общего количества лекарственных средств, информация о которых внесена в автоматизированную информационную систему Росздравнадзора. В связи с существовавшей возможностью ввода в оборот немаркированных лекарственных препаратов до 31 декабря 2020 года, в настоящее время в гражданском обороте на территории Российской Федерации имеются и немаркированные лекарственные препараты, их доля в гражданском обороте не более 0,05%.
Росздравнадзором проведена организационно-методическая работа по регистрации субъектов обращения лекарственных средств в системе мониторинга движения лекарственных препаратов. В системе зарегистрировано 90% организаций, имеющих лицензию на фармацевтическую деятельность (оптовая торговля); 91% организаций, имеющих лицензию на фармацевтическую деятельность (розничная торговля) и 73% организаций, имеющих лицензию на медицинскую деятельность (в т. ч. 99% государственных, муниципальных и казенных медицинских организаций).
Регистрация в ФГИС МДЛП не требуется:
- медицинским организациям, осуществляющим работы и услуги без использования лекарственных препаратов (лечебная физкультура, мануальная терапия, медицинские осмотры и др.);
- фармацевтическим организациям, реализующим только фармацевтические субстанции, медицинские изделия;
- фармацевтическим организациям, не осуществляющим деятельность по причине реорганизации.
Нормативное правовое регулирование работы ФГИС МДЛП
Распоряжением Правительства Российской Федерации от 28.04.2018 № 791-р утверждена Модель функционирования системы маркировки товаров средствами идентификации, которой определены базовые принципы и организационная модель функционирования, в том числе криптозащита кода маркировки, централизованное формирование кода маркировки оператором системы и единоразовое взимание платы за единицу кода маркировки при его генерации, что не было предусмотрено на начальном этапе проведения эксперимента.
Минпромторг России определен органом, осуществляющим функции заказчика-координатора маркировки различных групп товаров.
Нормативное правовое регулирование работы ФГИС МДЛП осуществляется на основании следующих документов:
- Распоряжение Правительства Российской Федерации от 28.12.2018 № 2963-р «Об утверждении Концепции создания и функционирования в Российской Федерации системы маркировки товаров средствами идентификации и прослеживаемости товаров».
- Распоряжение Правительства Российской Федерации от 18.12.2018 №2828-р «Об определении ООО “Оператор-ЦРПТ” организацией, уполномоченной на осуществление функций оператора системы мониторинга движения лекарственных препаратов для медицинского применения» с 1 января 2019 года.
- Распоряжение Правительства Российской Федерации от 08.05.2019 № 899-р «Об условиях соглашения о государственно-частном партнерстве, заключаемого в целях создания, эксплуатации и техобслуживания объекта, предназначенного для обеспечения маркировки и прослеживаемости товаров». 7 июля 2019 года в рамках Петербургского международного экономического форума было подписано соглашение о государственно-частном партнерстве. Публичным партнером и координатором проекта со стороны государства выступил Минпромторг России, частным – ООО «Оператор-ЦРПТ».
- Постановление Правительства Российской Федерации от 08.05.2019 № 577 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке ее взимания». Постановлением определено, что плата за предоставление кодов маркировки для лекарственных препаратов для медицинского применения, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, предельная отпускная цена производителя которых не превышает 20 рублей, не взимается.
В целях исполнения Федерального закона от 28.12.2017 № 425-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» разработан и утвержден ряд постановлений Правительства Российской Федерации.
Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 утверждено Положение о системе мониторинга движения лекарственных препаратов для медицинского применения, в котором учтены основные принципы функционирования системы маркировки, установленные распоряжением Правительства Российской Федерации от 28.04.2018 № 791-р, в том числе по криптозащите кода маркировки и централизованному формированию кода маркировки оператором системы.
Положением также определяются:
- порядок нанесения средства идентификации, требования к его структуре и формату, его характеристики;
- правила создания, ввода в эксплуатацию, эксплуатации и вывода из эксплуатации системы мониторинга;
- порядок взаимодействия системы мониторинга с другими государственными информационными системами и информационными системами юридических лиц и индивидуальных предпринимателей, осуществляющих производство, хранение, ввоз в Россию, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов;
- порядок внесения в систему мониторинга и состав информации о лекарственных препаратах;
- порядок предоставления содержащейся в системе мониторинга информации.
Постановлением Правительства Российской Федерации от 14.12.2018 № 1557 установлены особенности внедрения системы мониторинга, включая сроки ее внедрения, в отношении лекарств семи высокозатратных нозологий.
Постановлением Правительства Российской Федерации от 14.12.2018 № 1558 установлен порядок размещения общедоступной информации, содержащейся в системе мониторинга, в сети Интернет (в том числе в формате открытых данных). Общедоступная информация размещается на сайте системы мониторинга ее оператором. Полномочия по утверждению состава общедоступной информации, требований к периодичности размещения и сроков обновления набора данных закреплены за Минздравом России.
15 мая 2020 года Правительством Российской Федерации приняты постановления № 687 «О внесении изменений в пункт 5 Положения о лицензировании фармацевтической деятельности» и № 688 «О внесении изменения в пункт 5 Положения о лицензировании медицинской деятельности», которые внесли изменения в лицензионные требования в части соблюдения лицензиатом обеспечения внесения информации о лекарственных препаратах для медицинского применения в систему мониторинга движения лекарственных препаратов для медицинского применения. Указанные изменения лицензионных условий вступили в силу 1 июля 2020 года2.
Работа Межведомственной комиссии Росздравнадзора по ввозу на территорию Российской Федерации и вводу в гражданский оборот лекарственных препаратов в период пандемии COVID-19
В период пандемии коронавирусной инфекции имели место случаи неготовности как российских, так и зарубежных производителей наносить маркировку на всю номенклатуру выпускаемых ими лекарственных препаратов. В связи с этим Правительством Российской Федерации было утверждено постановление от 30.06.2020 № 955 «Об особенностях ввода в гражданский оборот лекарственных препаратов для медицинского применения». При Росздравнадзоре была создана Межведомственная комиссия, которая принимала решения о выдаче согласований на ввоз в Российскую Федерацию в целях ввода в гражданский оборот зарубежных лекарственных препаратов, произведенных до 1 октября 2020 года, а также решения о возможности ввода в гражданский оборот лекарственных препаратов, изготовленных российскими производителями с 1 июля 2020 года до 1 октября 2020 года без нанесения средств идентификации. Соответствующий реестр согласований был размещен на сайте Росздравнадзора.
За период работы Межведомственной комиссии при Росздравнадзоре с 01.07.2020 по 31.12.2020 получено 7045 заявлений на согласование ввоза на территорию Российской Федерации, ввода в гражданский оборот лекарственного препарата от 216 юридических лиц, проведено 68 заседаний, выдано 3749 согласований.
Упрощение механизмов работы с системой мониторинга лекарственных препаратов. Введение уведомительного режима работы
В сентябре 2020 года, в связи с увеличением оборота маркированных лекарственных препаратов для медицинского применения в товаропроводящей цепи, от участников рынка стали поступать обращения о сбоях в системе маркировки: отсутствие доступа в систему, длительное время загрузки отчетности в систему, повторная загрузка отчетов в систему, отсутствие уведомлений об успешно проведенных операциях и т.д. Правительство Российской Федерации упростило порядок работы с системой мониторинга лекарственных препаратов3. Изменения касались всех лекарственных препаратов как произведенных в стране, так и ввозимых в Российскую Федерацию, за исключением лекарственных препаратов высокозатратных нозологий. В документе определены упрощенные механизмы и уведомительный характер при работе с системой. До 1 июля 2021 года были введены упрощенные механизмы «обратной приемки лекарств» при их ввозе в Россию и обороте внутри страны (схема 702 и 703).
Для аптечных и медицинских организаций упрощенный режим при приемке лекарственных препаратов еще действует.
В настоящее время в связи с мерами, предпринятыми в соответствии с постановлением Правительства Российской Федерации от 02.11.2020 № 1779 «О внесении изменений в Положение о системе мониторинга движения лекарственных препаратов для медицинского применения», а также расширением технических возможностей, используемых для функционирования системы мониторинга, проведенными ООО «Оператор-ЦРПТ», система работает в штатном режиме, лекарственные препараты передаются по товаропроводящей цепочке.
Оператором были разработаны методические документы по разъяснению положений постановления Правительства Российской Федерации от 02.11.2020 № 1779, которые размещены на сайте национальной системы цифровой маркировки «Честный знак», а также на сайте Росздравнадзора в разделе «Система маркировки лекарственных препаратов»4 / «Сборник методических документов для работы в ФГИС МДЛП»:
- методические рекомендации по работе участников оборота лекарственных препаратов в период введения уведомительного режима работы ФГИС МДЛП;
- схема работы аптеки на период действия уведомительного режима;
- справка по использованию схемы 702.
Приложения «Честный знак» и «Фарма.Просто»
Оператором системы мониторинга ООО «Оператор-ЦРПТ» разработано и размещено в публичном доступе бесплатное мобильное приложение «Честный знак» (рис. 2), с помощью которого граждане могут лично проверять легальность приобретаемого лекарственного препарата, а также при необходимости сообщить о выявленном нарушении.

Также оператором разработано бесплатное решение для небольших организаций, работающих с лекарственными препаратами «Фарма.Просто». Информация о «Фарма.Просто», регистрация в решении, а также работа в нем размещены на сайте оператора системы «Честный знак».
С помощью приложения «Фарма.Просто» информация о выведенных из оборота упаковках лекарственного препарата может быть также передана сотрудниками обособленных подразделений медицинской организации. В этом случае сотруднику обособленного подразделения медицинской организации необходимо выполнить сканирование кодов DataMatrix, нанесенных на потребительскую упаковку лекарственного препарата, и сохранить данные, используя функционал приложения «Фарма.Просто». В дальнейшем, для успешной передачи данных в головную медицинскую организацию о выведенных из оборота упаковках лекарственного препарата, необходимо выполнить синхронизацию сохраненных данных в мобильном приложении «Фарма.Просто» с личным кабинетом головной медицинской организации при помощи мобильного Интернета или по приезду в головную медицинскую организацию.
Взаимодействие ФГИС МДЛП и АИС Росздравнадзора
В соответствии с постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» Федеральной службе по надзору в сфере здравоохранения и территориальным органам Росздравнадзора через личный кабинет контролирующего органа обеспечивается доступ к информации, содержащейся в системе мониторинга (рис. 3), в целях:
а) осуществления контроля соблюдения медицинскими работниками, руководителями медицинских организаций, фармацевтическими работниками и руководителями аптечных организаций ограничений, применяемых к ним при осуществлении профессиональной деятельности в соответствии с законодательством Российской Федерации;
б) осуществления федерального государственного контроля (надзора) в сфере обращения лекарственных средств;
в) проведения мониторинга ассортимента и цен на жизненно необходимые и важнейшие лекарственные препараты;
г) осуществления в установленном порядке проверки деятельности медицинских и аптечных организаций, организаций оптовой торговли лекарственными средствами, индивидуальных предпринимателей, осуществляющих деятельность в сфере здравоохранения.
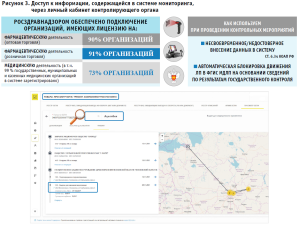
АИС Росздравнадзора функционирует во взаимодействии с ФГИС МДЛП. Из системы мониторинга в целях подтверждения достоверности сведений, представляемых субъектами обращения лекарственных средств в Росздравнадзор, перед вводом лекарственных препаратов в гражданский оборот, в АИС Росздравнадзора передаются сведения об указанных лекарственных препаратах, а после передачи информации субъектами обращения лекарственных средств о вводимых в гражданский оборот лекарственных препаратов указанная информация передается во ФГИС МДЛП.
Росздравнадзором с 10 декабря 2020 года введен в эксплуатацию дополнительный сервис в АИС Росздравнадзора, который, в случае отсутствия сведений или наличия неверных сведений с точки зрения заявителя о лекарственном препарате, вводимом в гражданский оборот, позволяет формировать онлайн-запрос во ФГИС МДЛП и получать актуальные сведения о препарате, подлежащем вводу в гражданский оборот. Такой подход позволил четко разграничить зоны ответственности, минимизировать время по установлению причины отсутствия сведений о лекарственном препарате во ФГИС МДЛП.
В целях обеспечения федерального государственного контроля (надзора) в сфере обращения лекарственных средств из системы мониторинга в АИС Росздравнадзора передаются сведения об уничтожении лекарственных препаратов.
При выявлении несоответствия требований к качеству в рамках федерального государственного контроля (надзора) в сфере обращения лекарственных средств осуществляется блокировка принятия системой мониторинга сведений о вводе в оборот маркированных лекарственных препаратов, об обороте или о выводе из оборота маркированных лекарственных препаратов в автоматическом режиме.
Благодаря взаимодействию ФГИС МДЛП и АИС Росздравнадзора в 2021 году в системе мониторинга было заблокировано движение семи партий семи серий пяти торговых наименований маркированных лекарственных препаратов, в 2022 году – трех партий двух серий двух торговых наименований.
Проведение контрольных мероприятий территориальными органами Росздравнадзора с использованием ФГИС МДЛП
Выявление случаев повторной продажи. Территориальными органами Росздравнадзора в рамках проведенных контрольных мероприятий в 2021 году с использованием системы мониторинга движения лекарственных препаратов выявлены случаи повторной продажи 14 торговых наименований лекарственных препаратов, поставленных в медицинские организации.
В апреле 2022 года ГСУ ГУ МВД России по г. Москве во взаимодействии с сотрудниками Управления «П» 4 Службы ФСБ России и Росздравнадзором пресечена деятельность организованной группы, участники которой подозреваются в краже лекарственных препаратов, предназначенных для лечения онкологических больных. Предварительно установлено, что злоумышленники из числа медицинских работников, фальсифицируя отчетную документацию, с мая 2021 года по апрель 2022 года похищали лекарственные препараты. Стоимость одной дозы некоторых из них превышает 340 тыс. рублей. В дальнейшем лекарственные препараты реализовывались через аптечные организации. В ходе 25 обысков изъято свыше 2 тыс. упаковок лекарственных препаратов. Следователем ГСУ ГУ МВД России по г. Москве возбуждено уголовное дело по признакам преступления, ответственность за которое предусмотрена частью третьей статьи 158 УК РФ.
Контроль за фактическими остатками. Следует отметить большой вклад, который вносит система мониторинга в процесс контроля за лекарственным обеспечением населения. ФГИС МДЛП позволяет в рамках федеральных инцидентов по вопросам обеспечения противоопухолевыми лекарственными препаратами, препаратами для лечения сердечно-сосудистых заболеваний и вакцинами для профилактики коронавирусной инфекции проводить постоянный мониторинг наличия данных лекарственных препаратов в субъектах Российской Федерации, получать информацию об имеющихся остатках препаратов в целях принятия оперативного решения по поставкам лекарственных препаратов в регионы.
Росздравнадзор проводит работу по контролю за фактическими остатками лекарственных препаратов и сведениями в ФГИС МДЛП.
В настоящее время из «Отчета по вакцине от COVID-19», размещенного в ФГИС МДЛП, можно получить подробную агрегированную информацию в разрезе субъектов Российской Федерации, а также торговых наименований вакцин против коронавирусной инфекции и компонентов вакцины Гам-КОВИД-Вак, по остаткам вакцин на каждом этапе товаропроводящей цепи от производителя (эмитировано кодов маркировки, промаркировано упаковок) до выбытия вакцины в медицинских организациях.
Отслеживание сроков годности. Функционал ФГИС МДЛП также позволяет отслеживать сроки годности вакцин – вакцины с истекшим / истекающим сроком годности за определенный период.
По результатам контроля выдано 2231 предостережение в 82 субъектах Российской Федерации, составлено 183 протокола по статье 6.34 КоАП РФ в 30 субъектах Российской Федерации.
Профилактика дефектуры. Важная задача бесперебойного снабжения лекарственными препаратами – профилактика дефектуры.
На основании сведений, представляемых субъектами обращения лекарственных средств в Росздравнадзор, во исполнение требований частей 1, 2 статьи 52.1 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» перед вводом в гражданский оборот лекарственных препаратов можно прогнозировать количество лекарственных препаратов, которое поступит в медицинские и аптечные организации, а из системы мониторинга в агрегированном виде выгружать отчеты об остатках и выбытии лекарственных препаратов на любом из этапов товаропроводящей цепи. По мере накопления информации о выбытии маркированных лекарственных препаратов в конечном звене, возможно получить сведения о потребности в разрезе торговых наименований лекарственных препаратов.
Совместное использование сведений из АИС Росздравнадзора о вводе в гражданский оборот и из ФГИС МДЛП позволяет мониторировать, прогнозировать и профилактировать дефектуру лекарственных препаратов в медицинских и аптечных организациях.
Контроль уровня цен на лекарственные препараты, включенные в перечень ЖНВЛП. В соответствии с Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» государственному регулированию подлежат цены на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов (далее – ЖНВЛП), утверждаемый в установленном порядке Правительством Российской Федерации.
Государственное регулирование цен на ЖНВЛП осуществляется посредством государственной регистрации предельных отпускных цен производителей на ЖНВЛП и ведения Государственного реестра предельных отпускных цен производителей на ЖНВЛП, осуществляемых Минздравом России, а также установления предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных средств на ЖНВЛП, осуществляемого уполномоченными органами исполнительной власти субъектов Российской Федерации.
В соответствии с действующим законодательством Российской Федерации не допускается реализация ЖНВЛП по ценам, уровень которых (без учета налога на добавленную стоимость) превышает сумму фактической отпускной цены производителя лекарственных средств, не превышающей зарегистрированной или перерегистрированной предельной отпускной цены производителя (на дату реализации лекарственного препарата производителем), а также размера оптовой надбавки и (или) размера розничной надбавки, не превышающих соответственно размера предельной оптовой надбавки и (или) размера предельной розничной надбавки, установленных в субъекте Российской Федерации.
Осуществление регионального государственного контроля за применением цен на ЖНВЛП относится к компетенции органов исполнительной власти субъектов Российской Федерации.
В соответствии с постановлением Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» на Росздравнадзор возложена функция мониторинга цен и ассортимента ЖНВЛП в стационарных лечебно-профилактических учреждениях и аптечных организациях.
Порядок проведения мониторинга определен приказом Минздравсоцразвития России от 27.05.2009 № 277н «Об организации и осуществлении мониторинга ассортимента и цен на жизненно необходимые и важнейшие лекарственные препараты». Ежемесячно для каждого субъекта Российской Федерации осуществляется отбор товарных позиций ЖНВЛП с учетом дозировки, формы выпуска и т.п., а также предоставляется информация по ценам, зафиксированная в данных мониторинга за отчетный месяц, месяц, предшествующий отчетному, и базовый месяц, с которым проводится сравнение данных за отчетный период.
В настоящее время осуществляется переход от ручного к автоматическому мониторингу через систему ФГИС МДЛП, что позволяет выводить средневзвешенные цены в розничном сегменте и госпитальном сегменте в разрезе субъектов Российской Федерации, временных периодов, с дополнительной информацией о серии, торговом наименовании, лекарственной форме, принадлежности к ЖНВЛП и проч. Соответствующие отчеты разрабатываются ООО «Оператор-ЦРПТ».
Conclusion.
Сегодня контроль – одна из основных функций системы управления. На основе данных контроля осуществляется адаптация системы к новым вызовам, обусловленным изменением геополитической, экономической ситуации, трансформацией системы здравоохранения в целом. Применение технологий и специализированных средств автоматизации и регламентации процессов способствует эффективному управлению и своевременному принятию правильных управленческих решений. Использование электронных информационных систем позволит избежать многих ошибок, повысить эффективность проведения контрольных (надзорных) мероприятий и, как следствие, обеспечить безопасность пациента при оказании медицинской помощи.
_______________________________________________________________________
1 Исключениями являются лекарственные препараты для медицинского применения, производимые для проведения клинических исследований и экспорта. Также маркировке средствами идентификации в соответствии с частью 4 статьи 67 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» не подлежат радиофармацевтические лекарственные препараты, пиявки медицинские и газы медицинские.
2 С 1 июля 2020 года субъекты обращения лекарственных средств несут ответственность в соответствии с законодательством Российской Федерации за производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения или внесение в нее недостоверных данных в соответствии со статьей 6.34 Кодекса Российской Федерации об административных правонарушениях.
3 Постановление Правительства Российской Федерации от 02.11.2020 № 1779 «О внесении изменений в Положение о системе мониторинга движения лекарственных препаратов для медицинского применения».
4 URL: https://roszdravnadzor.gov.ru/marking?ysclid=l4e4j9gu2d655648901.
