PROVIDING MEDICAL ORGANIZATIONS WITH QUALIFIED PERSONNEL
Analysis of the conditions and development of ways to improve the system of training of pharmaceutical and medical workers aimed at developing the potential of compounding pharmacies in the Russian Federation
1 — Ministry of Health of the Russian Federation, 3, Rakhmanovsky lane, City Service Post Office-4, Moscow, 127994, Russian Federation.
2 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
3 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
4 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russia.
ORCID: https://orcid.org/0000-0003-4609-0155
5 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0001-5061-0729
6 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0003-0256-6692
Improving regulation of the activities of compounding pharmacies creates conditions for increasing demand for extemporaneous medicines and determines the need to develop the competencies of pharmaceutical workers in the field of medicine manufacturing technologies, the quality assurance system of pharmacy organizations and quality control of manufactured medicines. At the same time, the development of demand will be qualitatively influenced by the specifics of the implementation of professional educational programs for medical workers, which should be aimed at increasing the level of training in the use and prescription of extemporaneous medicines in accordance with current clinical guidelines and standards for the provision of medical care.
The article presents an overview and description of the main documents regulating the system of professional education of pharmaceutical and medical workers, as well as comprehensive proposals that can improve the quality of training of specialists in the circulation of extemporaneous medicines.
Keywords: pharmaceutical workers, medical workers, extemporaneous medicines, production and distribution of medicines, compounding pharmacies, personalized medicine
Background.
Успешное развитие сегмента промышленного производства лекарственных препаратов (далее – ЛП) и смещение функционала фармацевтической деятельности на отпуск готовых лекарственных форм (далее – зарегистрированные ЛП, ГЛФ), а также дополнительное нормативное правовое и экономическое давление на сегмент ЛП, изготавливаемых аптечными организациями (далее – экстемпоральные лекарственные препараты, ЭЛП), напрямую повлияли на структуру кадрового потенциала фармацевтической отрасли. Одним из следствий отсутствия приоритета в области обращения ЭЛП и соответствующих основ гармонизированной политики является возникший дефицит провизоров-аналитиков, провизоров-технологов, провизоров-организаторов, а также дальнейшее усугубление взаимосвязанных причин: условий труда, уровня заработной платы, количества бюджетных мест в образовательных учреждениях высшего и среднего образования, особенностей реализации дополнительных профессиональных программ и повышения квалификации, допуска к осуществлению фармацевтической деятельности.
Сложившийся пробел в области индивидуального назначения, изготовления и отпуска ЛП особенно актуален в текущей обстановке, когда возникают риски дефицита или дефектуры ЛП. Так, в мировых системах здравоохранения существенным образом возрастают затраты на обеспечение высоко затратных нозологий, редких (орфанных) заболеваний, дорогостоящих видов лекарственной терапии, что при сохранении прежнего порядка формирования бюджетов на лекарственное обеспечение вынужденно требует перераспределения средств из бюджетов, направленных на обеспечение прочих групп пациентов, прежде всего из сегментов социально значимых заболеваний. Рационализация данного перераспределения является прямой компетенцией и задачей специалистов в области организации здравоохранения, управления фармацевтическим делом, которые занимаются фармакоэкономическим обоснованием как при допуске соответствующих ЛП на рынок, так и при их включении в государственные программы с последующим внедрением в клиническую практику1.
Как показывают результаты мониторинга производственных аптек Российской Федерации2, в течение последних десятилетий их количество стремительно сокращалось (36% прекратили ведение деятельности по изготовлению ЛП в период с 2015 по 2019 гг.) и специалисты переориентировались на промышленные предприятия по производству лекарственных средств, а также аптечные организации, осуществляющие розничную торговлю ГЛФ, вследствие чего текущие образовательные стандарты и программы в большей части направлены на обеспечение потребностей фармацевтической промышленности и организаций, осуществляющих торговую деятельность. Однако на сегодняшний день современные технологические решения позволяют предложить медицинскому сообществу и медицинским организациям (далее – МО) эффективную модель интеграции с современной аптечной инфраструктурой, которая способна обеспечить как индивидуальное изготовление ЛП, так и внутриаптечную фасовку зарегистрированных ЛП с соблюдением высокого уровня их качества и безопасности3,4. Для отечественной системы здравоохранения особую актуальность и востребованность имеют направления развития деятельности производственных аптек, в отношении которых предстоит как совершенствование профессиональных образовательных программ фармацевтического образования, так и развитие соответствующей нормативной правовой базы, обеспечение изготовления и повышение доступности следующих видов ЛП (включая, но не ограничиваясь):
- «традиционный ассортимент» ЭЛП;
- ЛП, применяющиеся при оказании педиатрической медицинской помощи;
- противоопухолевые ЛП и иммуномодуляторы, в том числе применяющиеся при оказании медицинской помощи взрослому и детскому населению по профилю «Онкология»;
- внутриаптечная (индивидуальная) фасовка зарегистрированных ЛП из крупных (балк) упаковок ЛП, которая позволяет обеспечить переход к учету курсовых доз, в том числе в рамках амбулаторного отпуска и льготного лекарственного обеспечения;
- ЛП, применяющиеся для лечения редких (орфанных) заболеваний.
Данные векторы развития деятельности по изготовлению ЛП и материально-технической базы производственных аптек способны предоставить новые возможности для клинической практики за счет вариативности состава, доступности широкого диапазона дозировок, лекарственных форм, возможного снижения нежелательных реакций и побочных действий, управления длительностью курса лекарственной терапии. Также появляются дополнительные инструменты для оперативного устранения дефектуры или дефицита ЛП, для оптимизации затрат бюджетов всех уровней, включая средства граждан на зарегистрированные ЛП, для обеспечения перехода на персонализированные (индивидуальные) курсы лечения, повышения качества оказываемой медицинской и фармацевтической помощи.
Развитие кадрового потенциала в фармации как аптечной, так и промышленной, должно основываться на системном подходе, обеспечении баланса между потребностью субъектов хозяйственной деятельности, количеством и качеством подготовленных специалистов, успешно освоивших соответствующие образовательные программы. Таким образом, с целью всестороннего понимания сложившихся подходов в реализации профессиональных образовательных программ фармацевтического и медицинского образования, выявления сложившихся препятствий и барьеров при развитии деятельности производственных аптек, требуется последовательный анализ действующей нормативной базы, понимание предпосылок, логики и последовательности реализации государственной политики и правового регулирования в сфере здравоохранения. Говоря о необходимости совершенствования образовательных программ подготовки фармацевтических работников в части обращения ЭЛП, требуется принятие решений по ряду нормативных правовых документов, которые должны быть ориентированы на воссоздание спроса на индивидуально изготавливаемые ЛП со стороны системы здравоохранения. Такие решения должны быть направлены на устранение сложившегося высокого уровня дефицита фармацевтических работников в производственных аптеках, прежде всего провизоров-аналитиков и провизоров-технологов, увеличение количества бюджетных мест, финансируемых за счет бюджетных ассигнований федерального бюджета, бюджетов субъектов Российской Федерации и (или) местных бюджетов по образовательным программам ординатуры. Одновременно внедрение в деятельность аптечных организаций и образовательные программы гармонизированной системы надлежащих аптечных практик должно преследовать одну из главных целей – формирование устойчивой цепочки взаимодействия «врач-пациент-провизор (фармацевт)» при оказании медицинской и фармацевтической помощи.
Имплементация экстемпоральных лекарственных препаратов в систему лекарственного обеспечения Российской Федерации и кадровую подготовку медицинских работников
В соответствии со ст. 37 Федерального закона от 21 ноября 2011 г. № 323-ФЗ (далее – ФЗ-323)5 медицинская помощь организуется и оказывается на основании клинических рекомендаций с учетом стандартов медицинской помощи, при этом, согласно п. 15 ст. 37 ФЗ-323, назначение и применение ЛП, не входящих в соответствующий стандарт медицинской помощи или не предусмотренных соответствующей клинической рекомендацией, допускается в случае наличия медицинских показаний (индивидуальной непереносимости, по жизненным показаниям) по решению врачебной комиссии. Одновременно п. 2 ст. 80 ФЗ-323 установлено, что при оказании в рамках Программы государственных гарантий гражданам бесплатной медицинской помощи в стационарных условиях, условиях дневного стационара и при посещениях на дому осуществляется обеспечение граждан ЛП, включенными в Перечень жизненно необходимых и важнейших лекарственных препаратов. Наряду с этим, юридически закрепленное определение дефиниции «по жизненным показаниям» отсутствует в действующем законодательстве.
Порядок и сроки разработки клинических рекомендаций утверждены приказом Минздрава России от 28 февраля 2019 г. № 103н6, согласно которому в клинические рекомендации включаются ЛП, имеющие государственную регистрацию. Вместе с тем контент-анализ клинических рекомендаций демонстрирует отсутствие в них указания дозировок ЛП или указания на применимость конкретных международных непатентованных наименований, используемых при назначении лекарственной терапии. В приложении A3 каждой клинической рекомендации должны приводиться справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз ЛП в соответствии с инструкцией по медицинскому применению ЛП. Положениями Порядка разработки стандартов медицинской помощи, введенного приказом Минздрава России от 22 февраля 2022 г. № 103н7, установлено, что основная часть стандарта медицинской помощи включает в себя усредненные показатели частоты предоставления и кратности применения зарегистрированных на территории РФ лекарственных препаратов (с указанием средних доз) в соответствии с инструкцией по применению ЛП и фармакотерапевтической группой по анатомо-терапевтическо-химической классификации, рекомендованной ВОЗ, за исключением случаев оказания медицинской помощи детям, где допускается включение зарегистрированного на территории РФ лекарственного препарата, применяемого в соответствии с показателями (характеристиками) ЛП, не указанными в инструкции по его применению, в случае соответствия такого ЛП требованиям, установленным Правительством РФ. Обозначенные требования представлены в виде Перечня заболеваний или состояний (групп заболеваний или состояний), при которых допускается применение ЛП в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению, утвержденного распоряжением Правительства РФ от 16 мая 2022 г. № 1180-р8. Кроме того, ст. 141 ФЗ-323 допускает включение в стандарты медицинской помощи детям и клинические рекомендации зарегистрированного на территории РФ лекарственного препарата, применяемого в соответствии с показателями (характеристиками) ЛП, не указанными в инструкции по его применению, а в случае соответствия такого лекарственного препарата требованиям, установленным Правительством РФ. Таким образом, с точки зрения действующей нормативной правовой базы, назначение ЭЛП должно оформляться решением врачебной комиссии, что создает определенные дополнительные технические затруднения, прежде всего для медицинских работников.
Текущая конструкция ст. 37 ФЗ-323 напрямую коррелирует с действующей системой высшего образования и подготовки медицинских работников в Российской Федерации. Приказом Минобрнауки России от 12 августа 2020 г. № 9889, утвержден федеральный государственный образовательный стандарт (далее – ФГОС) высшего образования – специалитет по специальности 31.05.01 «Лечебное дело», являющийся базовым уровнем образования в системе подготовки врачей. При этом программа специалитета должна устанавливать общепрофессиональные компетенции, в том числе способность врача назначать лечение и осуществлять контроль его эффективности и безопасности. Одновременно каждый врач должен приобрести профессиональнее компетенции, устанавливаемые профессиональными стандартами. Выпускникам, успешно освоившим программу специалитета по направлению 31.05.01 «Лечебное дело», присваивается квалификация «Врач-лечебник (врач-терапевт участковый)». Профессиональные компетенции к указанной квалификации описаны в Профессиональном стандарте, утвержденном приказом Минтруда России от 21 марта 2017 г. № 293н10, где в рамках трудовой функции назначения лечения и контроля его эффективности и безопасности действия врач должен уметь разрабатывать план лечения заболевания или состояния с учетом диагноза, возраста и клинической картины в соответствии с действующими порядками оказания медицинской помощи, клиническими рекомендациями (протоколами лечения) по вопросам оказания медицинской помощи с учетом стандартов медицинской помощи. Описанное демонстрирует причинно-следственную связь между формулировками ст. 37 ФЗ-323 и подзаконными актами, регулирующими подготовку медицинских работников к их профессиональной деятельности. Клинические рекомендации и стандарты оказания медицинской помощи не включают в себя ЭЛП, поскольку в них могут входить только зарегистрированные ЛП.
Таким образом, возможность применения и назначения ЭЛП должна присутствовать в нормативных правовых актах, которыми руководствуются медицинские работники при оказании медицинской помощи и определяются их образовательные траектории. Современные образовательные программы врачебных специальностей должны быть направлены на приобретение необходимых компетенций по разработке индивидуальных планов лечения заболеваний или состояний с учетом диагноза, возраста и клинической картины пациента.
Вышеуказанный тезис можно подтвердить на примере изменения формулировок и положений клинических рекомендаций. Федеральные клинические рекомендации по ведению больных атопическим дерматитом, изданные в 2015 г.11, включали в себя: «Экстемпоральные мази, пасты, примочки, имеющие в своем составе салициловую кислоту, вазелин, вазелиновое масло, метилурацил, ланолин, нафталан, ихтиол, дерматол, цинк, крахмал, висмут, тальк, борную кислоту, йод, масло оливковое, обладают комплексным противовоспалительным, кератолитическим, кератопластическим, дезинфицирующим, высушивающим действием». В аналогичных действующих клинических рекомендациях12 упоминания о применимости ЭЛП отсутствуют. Кроме того, рабочие программы дисциплин «Фармакология» и «Клиническая фармакология» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, ФГАОУ ВО ПЕРВЫЙ МГМУ им. И.М. Сеченова Минздрава России, ФГБОУ ВО ПСПБГМУ им. И.П. Павлова Мин здрава России – ведущих медицинских вузов Российской Федерации также не содержат упоминаний об ЭЛП.
Для развития спроса на ЭЛП со стороны врачебного сообщества, интеграции ЭЛП в систему лекарственного обеспечения и создания основ для их включения в систему подготовки медицинских работников предлагается реализация последовательных действий:
- Уточнить положения ст. 14, 37, 80, 81 и 83 ФЗ-323 в части расширения возможностей применения ЭЛП и включения их в клинические рекомендации, а также положения о структуре тарифа базовой программы обязательного медицинского страхования, дополнив их нормами об использовании медицинскими организациями услуг (работ) по изготовлению ЛП и внутриаптечной фасовке зарегистрированных ЛП аптечными организациями, имеющими лицензию на фармацевтическую деятельность с правом изготовления ЛП (п. 7. ст. 35 Федерального закона от 29 ноября 2010 г. № 326ФЗ «Об обязательном медицинском страховании в Российской Федерации» (далее – ФЗ-326))13.
- Пересмотреть подходы к формированию клинических рекомендаций и доработать их положениями о применимости ЭЛП по профилям оказания медицинской помощи.
- С целью повышения профессионального уровня, знаний, навыков и расширения квалификации медицинских работников рассмотреть возможность расширения и (или) включения в образовательные программы высшего медицинского образования (например, через ФГОС по специалитету 31.05.01. «Лечебное дело», 31.05.02. «Педиатрия» и другие) и программы ординатуры дополнительных дисциплин о методах персонализированной медицины и назначении индивидуальной лекарственной терапии (исходя из курсовых потребностей), включая зачетные единицы по приобретению навыков назначения, выписывания рецептов на ЛП, в том числе в форме электронного документа, и применения ЭЛП в клинической практике.
- Рассмотреть возможность разработки и реализации в рамках системы непрерывного образования дополнительных профессиональных программ для медицинских работников по вопросам порядка назначения врачами, выписывания рецептов на ЭЛП, в том числе в форме электронного документа, и их применения в клинической практике.
- При разработке дополнительных профессиональных программ для медицинских работников предусмотреть возможность одновременного освоения нескольких образовательных программ по профилям оказания медицинской помощи – базовую и вариативную часть.
Особенности реализации профессиональных образовательных программ фармацевтического образования в области изготовления и отпуска лекарственных препаратов
Основную роль в сокращении количества производственных аптек сыграла ст. 56 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» (далее – ФЗ-61)14, которая ввела ограничение на изготовление зарегистрированных ЛП. На сегодняшний день в Российской Федерации реальная доля производственных аптек оценивается в размере менее 0,5% к общему количеству аптечных организаций15, по некоторым оценкам она может достигать до 3%.
Немаловажным является то, что согласно ст. 29 ФЗ-323 фармацевтические организации являются частью системы здравоохранения, однако аптечные организации в соответствии с Общероссийским классификатором видов экономической деятельности (далее – ОКВЭД2)16, в том числе и производственные аптеки, относятся к коду 47.73 – Торговля розничная лекарственными средствами в специализированных магазинах (аптеках). При этом деятельность в области здравоохранения и социальных услуг находится в разделе Q (основной код 86) ОКВЭД2. В данном случае возникает правовая коллизия, поскольку ФЗ-323 относит аптечные организации к системе здравоохранения.
Отнесение производственных аптек к торговым специализированным магазинам усугубляет тренд на ориентацию образовательных программ в сторону торговли, а не квалифицированной фармацевтической деятельности.
- Разграничение осуществляемых трудовых функций между квалификациями «Провизор» и «Фармацевт». Право на осуществление фармацевтической деятельности в РФ имеют лица, получившие фармацевтическое образование в российских организациях, осуществляющих образовательную деятельность, и прошедшие аккредитацию специалиста. В соответствии со ст. 69 ФЗ-323 под аккредитацией специалиста подразумевается процедура определения соответствия лица, получившего фармацевтическое образование, требованиям к фармацевтической деятельности. Аккредитация специалиста проводится аккредитационной комиссией по окончании освоения им профессиональных образовательных программ фармацевтического образования не реже одного раза в пять лет. Положение об аккредитации специалистов установлено приказом Минздрава России от 28 октября 2022 г. № 709н17. Исходя из текста приказа, выделяется три вида аккредитации:
- первичная аккредитация – после окончания высшего учебного заведения или среднего учебного заведения;
- периодическая аккредитация – каждые пять лет;
- первичная специализированная аккредитация – после окончания ординатуры, магистратуры, профессиональной переподготовки.
Положение о лицензировании фармацевтической деятельности18 устанавливает требование о наличии у соискателя лицензии фармацевтических работников, имеющих высшее или среднее фармацевтическое образование, а также сертификат специалиста или пройденную аккредитацию специалиста.
Приказом Минздрава России от 2 мая 2023 г. № 205н19 утверждена номенклатура должностей специалистов с высшим профессиональным (фармацевтическим) образованием (далее – ВПО):
- провизор;
- провизор-аналитик;
- провизор-технолог (сохраняется до 1 декабря 2025 года).
А также номенклатура должностей специалистов со средним профессиональным (фармацевтическим) образованием:
- фармацевт.
Квалификационные требования к специалистам с высшим медицинским и фармацевтическим образованием, уровню профессионального образования, дополнительного профессионального образования для замещения должностей по специальностям обозначены в приказе Минздрава России от 2 мая 2023 г. № 206н20, при этом провизор может занимать:
- По окончании программ специалитета 33.05.01 «Фармация», должности: провизор (должность, замещаемая после 1 января 2016 г.).
- По окончании ординатуры по специальности 33.08.01 «Фармацевтическая технология» (сохраняется до 31 декабря 2025 года), должности: провизор-технолог; заведующий (начальник) структурного подразделения (отдела) аптечной организации.
- По окончании ординатуры по специальности 33.08.02 «Управление и экономика фармации», должности: директор (заведующий, начальник) аптечной организации; заместитель директора (заведующего, начальника) аптечной организации; заведующий (начальник) структурного подразделения (отдела) аптечной организации, провизор, провизор-технолог.
- По окончании ординатуры по специальности 33.08.03 «Фармацевтическая химия и фармакогнозия», должности: провизор-аналитик; заведующий (начальник) структурного подразделения (отдела) аптечной организации; провизор; провизор-технолог.
Приказом Минздрава России от 2 мая 2023 г. № 206н выделяются и другие квалификационные требования к должностям специалистов с высшим (немедицинским) образованием [упущено «нефармацевтическим»], по которым провизоры могут претендовать на замещение должностей с условием прохождения программ повышения квалификации или программ профессиональной переподготовки.
Специалисты со средним профессиональным (фармацевтическим) образованием (далее – СПО) могут занимать должность «фармацевт», исходя из положений Квалификационных требований к медицинским и фармацевтическим работникам со средним медицинским и фармацевтическим образованием21, а также в соответствии с приказом Минздрава России от 2 мая 2023 г. № 205н.
В части деятельности производственных аптек ФГОС ВПО 33.05.01 «Фармация»22 и ФГОС СПО 33.02.01 «Фармация»23 предусматривают:
для специалистов с высшим фармацевтическим образованием – наличие общепрофессиональной компетенции, выражающейся в способности к использованию основных биологических, физикохимических, химических, математических методов для разработки, исследований и экспертизы лекарственных средств, изготовления ЛП (ОПК-1);
для специалистов со средним профессиональным (фармацевтическим) образованием – готовность к изготовлению ЛП в условиях аптечных организаций и ветеринарных аптечных организаций (ПК 2.1. Изготовление лекарственных форм по рецептам и требованиям медицинских организаций; ПК 2.2. Изготовление внутриаптечной заготовки и фасовка лекарственных средств для последующей реализации; ПК 2.3. Владение обязательными видами внутриаптечного контроля лекарственных средств).
В такой же итерации указанные профессиональные компетенции изложены в профессиональных стандартах «Фармацевт»24,25.
Исходя из чего следует, что при наличии первичной аккредитации – после окончания высшего учебного заведения или среднего учебного заведения:
- все фармацевтические работники могут осуществлять фармацевтическую деятельность по изготовлению ЛП;
- отсутствует какой-либо стимул проходить обучение в ординатуре по направлению «Фармацевтическая технология» ввиду того, что должность «провизор-технолог» установлена на уровне с должностью «провизор», а прохождение программы в том числе используется фармацевтическими работниками как аналог программы 33.08.02 «Управление и экономика фармации». При этом текущий приоритет по возрождению деятельности производственных аптек заключается в наличии достаточного количества специалистов, обладающих компетенциями именно в аптечной технологии изготовления ЛП, а выделение специализации 33.08.01 «Фармацевтическая технология» в полной мере соответствует тенденциям развития как текущей, так и современной аптечной инфраструктуры в области изготовления ЛП.
Необходимо сформировать структурное и последовательное разграничение трудовых действий (функций), знаний, навыков и компетенций, которые соответствовали бы фактическому освоению дисциплин с соответствующим количеством зачетных единиц. С точки зрения корректировки требований к квалификации фармацевтических работников, влияние на востребованность и спрос выпускников по образовательным программам ВПО 33.05.01 «Фармация» возможно за счет замещения вакантных должностей заведующих и заместителей заведующих аптечных организаций и (или) структурных подразделений в случае отсутствия в штате специалистов с высшим образованием (провизоров) и при условии обязательного прохождения программы переподготовки и повышения квалификации в рамках дополнительного профессионального образования (33.08.02 «Управление и экономика фармации»). Также целесообразным является рассмотрение вопроса о возвращении ранее действующих сроков подготовки фармацевтических работников по программам среднего профессионального образования – 3–4 года (соответственно лицам, завершившим освоение образовательных программ основного общего образования и среднего общего образования), сделав особый акцент на увеличении количества часов подготовки по прикладным дисциплинам в области изготовления, контроля качества и отпуска ЭЛП.
- Анализ реализации профессиональных образовательных программ ординатуры фармацевтического образования. В соответствии со ст. 82 Федерального закона от 29 декабря 2012 г. № 273-ФЗ (далее – ФЗ-273)26 предусмотрена подготовка фармацевтических работников по программам ординатуры, которая обеспечивает приобретение обучающимися необходимого для осуществления профессиональной деятельности уровня знаний, умений и навыков, а также квалификации, позволяющей занимать определенные должности. Обучение по программам ординатуры осуществляется в соответствии с федеральными государственными образовательными стандартами, утвержденными федеральным органом исполнительной власти, осуществляющим функции по выработке и реализации государственной политики и нормативно-правовому регулированию в сфере высшего образования, по согласованию с федеральным органом исполнительной власти, осуществляющим функции по выработке и реализации государственной политики и нормативно-правовому регулированию в сфере здравоохранения. При этом, в соответствии с ФГОС ВПО 33.05.01 «Фармация», профессиональные компетенции определяются образовательной организацией самостоятельно на основе профессиональных стандартов, соответствующих профессиональной деятельности выпускников. Исходя из анализа рабочих программ специалитета по направлению «Фармация» образовательных учреждений27,28, по окончанию обучения провизоры осваивают необходимые знания и приобретают профессиональные компетенции в объеме, необходимом для осуществления фармацевтической деятельности по всем ее направлениям.
Как отмечалось ранее, для осуществления трудовых функций и замещения определенных должностей в производственной аптеке провизору необходимо дополнительно пройти обучение по образовательным программам ординатуры, продолжительность которых составляет два года, по следующим направлениям:
- Для получения квалификации «провизор-технолог» и осуществления контрольных функций за изготовлением ЛП необходимо пройти программу 33.08.01 «Фармацевтическая технология» (требования к опыту работы не устанавливаются).
- Чтобы провизор имел право занимать руководящую должность (заведующий аптечной организацией, заведующий (начальник) структурного подразделения (отдела) аптечной организации и т.п.), в том числе производственной аптекой, потребуется освоить программу ординатуры по специальности 33.08.02 «Управление и экономика фармации» (требования к опыту работы – не менее двух лет).
- Для получения квалификации «провизор-аналитик» и осуществления деятельности в области контроля качества изготовленных ЛП необходимо пройти программу 33.08.03 «Фармацевтическая химия и фармакогнозия» (требования к опыту работы не устанавливаются).
Одновременно программы подготовки провизоров по направлению ординатуры 33.08.01 «Фармацевтическая технология»29,30,31 наполовину состоят из промышленной технологии лекарственных средств, а программы подготовки провизоров по направлению 33.08.03 «Фармацевтическая химия и фармакогнозия»32,33,34 в том же объеме изучают классический фармацевтический анализ, все программы на четверть состоят из предметов общего профиля. В программах на изучение технологии лекарственных форм и контроля качества лекарственных средств отводится по 800–1000 часов – столько же, сколько по совокупности указанных направлений, содержится в дипломе каждого провизора, успешно освоившего программу ВПО 33.05.01 «Фармация». Более 80% наполнения обозначенных программ изучается студентами при получении высшего фармацевтического образования специалитета по направлению «Фармация». Свыше половины программ ординатуры отдано на самостоятельное изучение.
Помимо длительности данных образовательных программ дополнительно обращает на себя внимание факт высокой стоимости в рамках договоров об оказании платных образовательных услуг, которая достигает 950 тыс. рублей35,36,37. Количество квот приема на целевое обучение за счет бюджетных ассигнований федерального бюджета для данных специальностей относительно всех квот для медицинских и фармацевтических кадров высшей квалификации по программам ординатуры за последние годы приблизилось к критически минимальным значениям, что вынуждает молодых специалистов оплачивать обучение самостоятельно или отказываться от работы в аптечных организациях, что приводит к оттоку провизоров и потенциальных провизоров-аналитиков, провизоров-технологов на фармацевтические заводы. Некоторые контрольные цифры приема (бюджетные места) на 2023/24 учебный год приведены в таблице38,39.
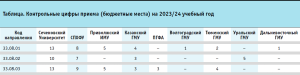
Кроме того, действующая нормативная правовая база в области изготовления ЛП, а также материально-техническая база аптечных организаций, должны позволять имплементировать знания, которые получают выпускники ординатуры (связанные в первую очередь с принципами системы обеспечения и управления качеством аптечных организаций). В условиях перехода нормативного правового регулирования производственных аптек на систему надлежащих практик, в частности надлежащей практики изготовления лекарственных препаратов (по аналогии с развитыми системами здравоохранения), обучающиеся должны получать новые компетенции в рамках программы специалитета. Вышеизложенное также справедливо для выпускников по программам ординатуры 33.08.02 «Управление и экономика фармации». Действующую систему подготовки фармацевтических работников можно представить в соответствии с рисунком.
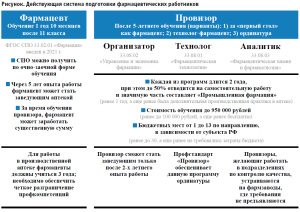
Необходимо рассмотреть возможность создания и внедрения механизма «раннего (ускоренного) допуска» к осуществлению фармацевтической деятельности по соответствующим должностям фармацевтических работников (заведующий, заместитель заведующего, провизор-аналитик, провизор-технолог) после получения диплома специалиста и прохождения аккредитации – курс стажировки (практики), реализуемой в рамках программ дополнительного профессионального образования в очной форме или новых форм обучения (от 144 и не более 250 часов), а также оптимизации программ ординатуры в части сроков и стоимости обучения.
Данные меры особенно актуальны для восполнения дефицита провизоров-аналитиков. Такой механизм позволяет воссоздать ранее существовавшую практику при трудоустройстве в производственные аптеки – «провизор-аналитик, впервые назначенный на должность, обязан пройти курс стажировки в территориальной контрольно-аналитической лаборатории, а назначенный на должность для выполнения контроля качества лекарственных средств, изготовляемых в гомеопатической аптеке – на факультетах повышения квалификации провизоров, имеющих образовательную лицензию»40. Внедрение данной меры также позволит развивать взаимосвязь производственных аптек с аккредитованными контрольно-аналитическими лабораториями и центрами контроля качества лекарственных средств, в особенности в части обмена опытом по вопросам контроля качества и экспресс-методам анализа ЛП. При этом для целей прохождения практики провизоры должны иметь возможность устраиваться на должности «провизораналитик стажер», «провизор-технолог стажер», что связано с вопросом актуализации и утверждения корректной номенклатуры должностей медицинских и фармацевтических работников.
- Меры, направленные на совершенствование системы непрерывного медицинского и фармацевтического образования. Важным для целей настоящего исследования является вопрос эффективности системы непрерывного медицинского и фармацевтического образования (далее – НМиФО) и процедуры периодической аккредитации специалистов. В 2022 году периодическую аккредитацию прошли более 22,5 тыс. фармацевтических работников, из которых около 12,5 тыс. – провизоры. С 1 января 2023 года действуют обновленные правила аккредитации, в рамках которых на текущий момент периодическую аккредитацию прошли более 14,3 тыс. фармацевтических работников41. Минздрав России упростил механизмы подачи документов для прохождения всех типов аккредитаций. При этом результаты проведенного опроса42 247 сотрудников аптечных организаций показывают, что сокращение количества ежегодно набираемых зачетных единиц в объеме до 144 часов поддерживают 74% фармацевтических работников. 1% респондентов отметили, что готовы учиться больше, остальные же считают, что и 144 часа – много, предложив уменьшить их до 100.
Система непрерывного медицинского и фармацевтического образования требует дальнейшего развития с точки зрения выравнивания требований к специалистам фармацевтической отрасли. Необходима выработка единой государственной политики в области нормативного правового регулирования и методической поддержки развития фармацевтической помощи и фармацевтических услуг, в частности услуг (работ) по изготовлению ЛП и внутриаптечной фасовке зарегистрированных ЛП производственными аптеками. Различия в требованиях для предприятий фармацевтической промышленности и производственных аптек с точки зрения системы НМиФО является одним из факторов при принятии решения квалифицированными специалистами о векторе развития своей профессиональной деятельности, в частности, провизоры-аналитики часто переходят к осуществлению трудовой деятельности на фармацевтические предприятия по причине отсутствия требований участия в системе НМиФО.
С учетом вступления в силу приказа Минздрава России от 28 октября 2022 г. № 709н, целесообразным является оптимизация сроков прохождения программ переподготовки и повышения квалификации в рамках дополнительного профессионального образования (33.08.01 «Фармацевтическая технология» 33.08.02 «Управление и экономика фармации» 33.08.03 «Фармацевтическая химия и фармакогнозия»), а также количества ежегодно набираемых зачетных единиц в рамках процедуры периодической аккредитации специалистов. При этом, в соответствии с приказом Минобрнауки России от 1 июля 2013 г. № 499 «Об утверждении Порядка организации и осуществления образовательной деятельности по дополнительным профессиональным программам», необходимо установить: минимально допустимый срок освоения программ повышения квалификации не может быть менее 16 часов, а срок освоения программ профессиональной переподготовки – более 250 часов43. Альтернативным предложением может рассматриваться замена или замещение части образовательных часов на стажировки (практики) в очной форме.
Conclusion.
Текущие задачи по совершенствованию нормативного правового регулирования деятельности производственных аптек с одной стороны ориентированы на создание условий для повышения спроса, физической, территориальной доступности экстемпоральных лекарственных препаратов, а с другой – определяют необходимость развития компетенций фармацевтических работников в области аптечных технологий изготовления лекарственных препаратов, системы обеспечения качества аптечных организаций и контроля качества изготавливаемых лекарственных препаратов.
В сложившейся ситуации необходимо обеспечить соответствующие меры и стимулы для всех участников системы профессионального фармацевтического и медицинского образования, в частности:
- для специалистов: оптимизировать сроки подготовки и стоимость платных образовательных услуг; обеспечить дополнительные стимулы (по аналогии с медицинскими работниками) при условии трудоустройства в производственные аптеки;
- для образовательных учреждений: обеспечить увеличение количества бюджетных мест, оптимизировать сроки и стоимость обучения по образовательным программам ординатуры, а также стимулировать приток доходов из внебюджетных источников;
- для аптечных организаций: внедрить субсидируемые механизмы на компенсацию затрат аптечных организаций при заключении договоров с образовательными учреждениями на целевое обучение и повышение квалификации фармацевтических работников; рассмотреть возможность создания налоговых преференций по снижению тарифов страховых взносов для производственных аптек.
Также важное значение будет иметь реализация дополнительных мер государственной поддержки фармацевтических работников:
- возможность субсидирования контрактов, заключенных между аптечными организациями, образовательными учреждениями и обучающимся, на подготовку специалистов по программам ординатуры, их переподготовку и повышение квалификации в рамках программ дополнительного профессионального образования;
- возможность снижения тарифов страховых взносов для аптечных организаций, имеющих лицензию на фармацевтическую деятельность с правом изготовления ЛП;
- решение вопроса об отнесении фармацевтической деятельности по изготовлению и отпуску ЛП к вредному классу (подклассу) условий труда, с учетом рисков работы с высокоактивными веществами и наличии ионизирующего излучения при изготовлении радиофармацевтических ЛП;
- решение вопроса о распространении практики программ «льготной ипотеки» на молодых специалистов по всей номенклатуре медицинских и фармацевтических работников.
Текущие программы подготовки фармацевтических и медицинских работников требуют повышения профессиональных знаний, компетенций и квалификации по вопросам организации персонализированной медицины в каждом из профилей оказания медицинской помощи, порядка назначения и выписывания индивидуальной лекарственной терапии (рецептов на ЛП), в том числе в форме электронного документа, применения экстемпоральных лекарственных препаратов в клинической практике. Не менее значимыми являются инициативы и предложенные меры государственной поддержки фармацевтических работников, которые могли бы способствовать развитию необходимых компетенций в области аптечных технологий изготовления лекарственных препаратов, системы обеспечения качества аптечных организаций и контроля качества изготавливаемых лекарственных препаратов.
Предложения подготовлены в целях содействия в реализации положений Федерального закона от 5 декабря 2022 г. № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств»44 в части изготовления лекарственных препаратов, направленного на возрождение аптечного производства.
______________________________________________________________________
1 Юрочкин Д.С., Голант З.М., Наркевич И.А. Развитие рынка лекарственных средств, применяемых для лечения редких (орфанных) заболеваний //Ремедиум. Журнал о российском рынке лекарств и медицинской технике. – 2019. – № 9. – С. 6–12. DOI: https://doi.org/10.21518/1561-5936-2019-9-6-12. – EDN LEGDNS.
2 Фисенко В.С., Фаррахов А.З., Соломатина Т.В., Алехин А.В., Юрочкин Д.С., Эрдни-Гаряев С.Э., Мамедов Д.Д., Голант З.М. Мониторинг производственных аптек в Российской Федерации // Вестник Росздравнадзора. – 2023. – № 3. – С. 22–33. – EDN XZJIJT.
3 Основы формирования единой гармонизированной системы нормативного правового регулирования в области обращения лекарственных препаратов, изготавливаемых аптечными организациями: Монография / И.А. Наркевич, В.С. Фисенко, З.М. Голант, Д.С. Юрочкин, Д.Д. Мамедов, С.Э. Эрдни-Гаряев, А.А. Лешкевич. – СПб.: Медиапапир, 2023. – 292 с. – ISBN 978-5-00110-344-8 – EDN PZEVDF.
4 Мамедов Д.Д., Юрочкин Д.С., Лешкевич А.А., Эрдни-Гаряев С.Э., Голант З.М., Наркевич И.А. Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт североамериканского фармацевтического рынка // ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. – 2023. – № 16 (1). – С. 80–86. DOI https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.155. – EDN UNVJIC.
5 Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://docs.cntd.ru/document/902312609 (дата обращения: 15.07.2023).
6 Приказ Минздрава России от 28 февраля 2019 г. № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации». URL: https://docs.cntd.ru/document/553937038 (дата обращения: 15.07.2023).
7 Приказ Минздрава России от 22 февраля 2022 г. № 103н «Об утверждении порядка разработки стандартов медицинской помощи». URL: https://docs.cntd.ru/document/350030483 (дата обращения: 15.07.2023).
8 Распоряжение Правительства РФ от 16 мая 2022 г. № 1180-р «О перечне заболеваний или состояний (групп заболеваний или состояний), при которых допускается применение лекарственного препарата в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению». URL: https://base.garant.ru/404700683/ (дата обращения: 15.07.2023).
9 Приказ Минобрнауки России от 12 августа 2020 г. № 988 «Об утверждении федерального государственного образовательного стандарта высшего образования – специалитет по специальности 31.05.01 Лечебное дело». URL: https://base.garant.ru/74566342/ (дата обращения: 15.07.2023).
10 Приказ Минтруда России от 21 марта 2017 г. № 293н «Об утверждении профессионального стандарта «Врач-лечебник (врач-терапевт участковый)». URL: https://cr.minzdrav.gov.ru/schema/265_2 (дата обращения: 15.07.2023).
11 Федеральные клинические рекомендации по ведению больных атопическим дерматитом. URL: https://www.ismos.ru/guidelines/doc/atopicheskij_dermatit.pdf (дата обращения: 15.07.2023).
12 Клинические рекомендации «Атопический дерматит». URL: https://cr.minzdrav.gov.ru/schema/265_2 (дата обращения: 15.07.2023).
13 Федеральный закон от 29 ноября 2010 г. № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации». URL: https://docs.cntd.ru/document/902247618 (дата обращения: 15.07.2023).
14 Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств». URL: https://docs.cntd.ru/document/902209774 (дата обращения: 15.07.2023).
15 Основы формирования единой гармонизированной системы нормативного правового регулирования в области обращения лекарственных препаратов, изготавливаемых аптечными организациями: Монография / И.А. Наркевич, В.С. Фисенко, З.М. Голант, Д.С. Юрочкин, Д.Д. Мамедов, С.Э. Эрдни-Гаряев, А.А. Лешкевич. – СПб.: Медиапапир, 2023. – 292 с. – ISBN 978-5-00110-344-8 – EDN PZEVDF.
16 Приказ Росстандарта от 31 января 2014 г. № 14-ст «О принятии и введении в действие Общероссийского классификатора видов экономической деятельности (ОКВЭД2) ОК 029-2014 (КДЕС Ред.2) и Общероссийского классификатора продукции по видам экономической деятельности (ОКПД2) ОК 034-2014 (КПЕС 2008)». URL: https://docs.cntd.ru/document/499092012 (дата обращения: 15.07.2023).
17 Приказ Минздрава России от 28 октября 2022 г. № 709н «Об утверждении Положения об аккредитации специалистов». URL: https://docs.cntd.ru/document/352337177 (дата обращения: 15.07.2023).
18 Постановление Правительства РФ от 31 марта 2022 г. № 547 «Об утверждении Положения о лицензировании фармацевтической деятельности». URL: https://docs.cntd.ru/document/350167126 (дата обращения: 15.07.2023).
19 Приказ Минздрава России от 2 мая 2023 г. № 205н «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников». URL: http://publication.pravo.gov.ru/document/0001202306010052 (дата обращения 15.07.2023).
20 Приказ Минздрава России от 2 мая 2023 г. № 206н «Об утверждении Квалификационных требований к медицинским и фармацевтическим работникам с высшим образованием по направлению подготовки «Здравоохранение и медицинские науки». URL: https://www.consultant.ru/law/hotdocs/80472.html (дата обращения 15.07.2023).
21 Приказ Минздрава России от 10 февраля 2016 г. № 83н «Об утверждении Квалификационных требований к медицинским и фармацевтическим работникам со средним медицинским и фармацевтическим образованием». URL: https://docs.cntd.ru/document/420339191 (дата обращения 15.07.2023).
22 Приказ Минобрнауки России от 27 марта 2018 г. № 219 «Об утверждении федерального государственного образовательного стандарта высшего образования – специалитет по специальности 33.05.01 Фармация». URL: https://docs.cntd.ru/document/542621852 (дата обращения: 15.07.2023).
23 Приказ Минздрава России от 13 июля 2021 г. № 449 «Об утверждении федерального государственного образовательного стандарта среднего профессионального образования по специальности 33.02.01 Фармация». URL: https://dokipedia.ru/document/5351285 (дата обращения: 15.07.2023).
24 Приказ Минтруда России от 31 мая 2021 г. № 349н «Об утверждении профессионального стандарта «Фармацевт». URL: https://docs.cntd.ru/document/607123199 (дата обращения: 15.07.2023).
25 Приказ Минтруда России от 9 марта 2016 г. № 91н «Об утверждении профессионального стандарта «Провизор». URL: https://docs.cntd.ru/document/420346038 (дата обращения: 15.07.2023).
26 Федеральный закон от 29 декабря 2012 г. № 273-ФЗ «Об образовании в Российской Федерации». URL: https://docs.cntd.ru/document/902389617 (дата обращения: 15.07.2023).
27 Фармация. URL: http://doc.spcpu.ru/sveden/education/programs/farmaciya-33.05.01.html (дата обращения 15.07.2023).
28 Фармация. URL: https://www.sechenov.ru/univers/structure/institute/institut-farmatsii/od-iftm/napravleniya-podgotovki/farmatsiya/ (дата обращения 15.07.2023).
29 Фармацевтическая технология. URL: http://doc.spcpu.ru/sveden/education/programs/farmacevticheskaya-tehnologiya-33.08.01.html (дата обращения 15.07.2023).
30 Фармацевтическая технология. URL: https://clouds.ssmu.ru/f/35bba6aff66f41728429/ (дата обращения 15.07.2023).
31 Фармацевтическая технология. URL: https://www.sechenov.ru/upload/iblock/75d/3ss2df92a5oueeqysty8xhim4t59dp2p/Farmatsevticheskaya-tekhnologiya-2646-UP.pdf (дата обращения 15.07.2023).
32 Фармацевтическая технология. URL: http://doc.spcpu.ru/sveden/education/programs/farmacevticheskaya-tehnologiya-33.08.01.html (дата обращения 15.07.2023).
33 Фармацевтическая технология. URL: https://clouds.ssmu.ru/f/35bba6aff66f41728429/ (дата обращения 15.07.2023).
34 Фармацевтическая технология. URL: https://www.sechenov.ru/upload/iblock/75d/3ss2df92a5oueeqysty8xhim4t59dp2p/Farmatsevticheskaya-tekhnologiya-2646-UP.pdf (дата обращения 15.07.2023).
35 Стоимость обучения в СПХФУ. URL: https://abiturient.pharminnotech.com/поступление/стоимость-обучения (дата обращения 15.07.2023).
36 Стоимость обучения. URL: https://www.sechenov.ru/admissions/stoimost-obucheniya/ (дата обращения 15.07.2023).
37 Ординатура. URL: https://abiturient.ssmu.ru/residency/(дата обращения 15.07.2023).
38 Распоряжение Правительства РФ от 17 ноября 2022 г. № 3502-р «Об установлении на 2023 год квоты приема на целевое обучение по образовательным программам высшего образования за счет бюджетных ассигнований федерального бюджета». URL: https://www.consultant.ru/document/cons_doc_LAW_431701/ (дата обращения 15.07.2023).
39 Приказ Минздрава России от 31 мая 2022 г. № 366 «Об установлении квоты приема на целевое обучение для получения высшего образования за счет бюджетных ассигнований федерального бюджета в федеральных государственных образовательных и научных организациях, находящихся в ведении Министерства здравоохранения Российской Федерации, осуществляющих образовательную деятельность по программам подготовки кадров высшей квалификации – программам ординатуры, на 2022/23 учебный год». URL: https://nczd.ru/wp-content/uploads/2022/06/prikaz-366-mzrf.pdf (дата обращения 15.07.2023).
40 Приказ Минздрава России от 16 июля 1997 г. № 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)». URL: https://docs.cntd.ru/document/902062371 (дата обращения: 15.07.2023).
41 ФАЦ раскрыл самые частые причины недопуска к аккредитации мед- и фармспециалистов. URL: https://medvestnik.ru/content/news/FAC-raskryl-samye-chastye-prichiny-nedopuska-k-akkreditacii-med-i-farmspecialistov.html (дата обращения: 15.07.2023)
42 Первостольники рассказали, как они оценивают систему непрерывного обучения. URL: https://pharmvestnik.ru/content/articles/Pervostolniki-rasskazali-kak-oni-ocenivaut-sistemu-nepreryvnogo-obucheniya.html (дата обращения: 15.07.2023).
43 Приказ Минобрнауки России от 1 июля 2013 г. № 499 «Об утверждении Порядка организации и осуществления образовательной деятельности по дополнительным профессиональным программам». URL: http://www.consultant.ru/document/cons_doc_LAW_151143/ (дата обращения: 15.07.2023).
44 Федеральный закон от 5 декабря 2022 г. № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств». URL: http://publication.pravo.gov.ru/Document/View/0001202212050043 (дата обращения: 15.07.2023).
