PHARMACOVIGILANCE
Analysis of the consumption of antibacterial drugs in the outpatient and hospital segments using the system for monitoring of medicines movement
1 — Territorial body of the Federal Service for Supervision of Healthcare in the Karachay-Cherkessian Republic, 180B, Kochubeya st., Cherkessk, Karachay-Cherkessian Republic, 369000, Russian Federation.
ORCID: orcid.org/0000-0002-7487-1728
2 — Federal State Budgetary Educational Institution of Higher Education “North Caucasian State Academy”, 36, Stavropolskaya st., Cherkessk, Karachay-Cherkessian Republic, 369000, Russian Federation.
3 — Republican State Budgetary Treatment and Preventive Institution “Republican Center for Public Health and Medical Prevention”, 62, Svobody st., Cherkessk, Karachay-Cherkessian Republic, 369000, Russian Federation.
One of the goals of the WHO Global action plan on antimicrobial resistance is to optimize the use of antibiotics to achieve the target of 60% use of Access group antibiotics and to reduce the use of Watch and Reserve group antibiotics according to the AWaRe classification. The purpose of the study was to analyze the consumption of antibacterial drugs in the hospital and outpatient settings using the Federal Government Information System for monitoring of medicines movement (SMMM). The consumption of antibiotics in the Karachay-Cherkessian Republic in 2022–2023 was evaluated using the WHO's Anatomical Therapeutic Chemical/ Defined Daily Dose methodology. The overall antibiotic consumption rate increased 16.4% to 19.7 DDD per 1000 inhabitants per day, the hospital antibiotic consumption rate increased 18.4% to 35.1 DDD per 100 bed days. Access group antibiotics accounted for 40.3% of total antibiotic consumption. Nearly 92% of all antibiotics were distributed through retail pharmacies. Regular analysis of hospital and outpatient consumption of antibiotics over time using the SMMM can be used for local and national stewardship interventions for rational use of these medicines. The оutpatient segment of the healthcare system appears to be а prime target for interventions to optimize antibiotic consumption to reduce the threat of antibiotic resistance.
Keywords: System for monitoring of medicines movement, monitoring antibiotic usage, defined daily dose, antimicrobial resistance
Background.
Одной из глобальных проблем здравоохранения в XXI веке является устойчивость к антибактериальным препаратам – антимикробная резистентность (АМР) [1, 2]. Основной причиной АМР является длительное, чрезмерное и неправильное использование антибактериальных препаратов (АБП) в медицине и при производстве продуктов питания [2]. АМР сопровождается ростом заболеваемости и смертности от ряда болезней, повышением расходов здравоохранения из-за увеличения длительности и стоимости лечения [3]. В 2019 году около 1,27 млн смертей в мире были обусловлены АМР [2]. При отсутствии действенных мер число таких смертей может возрасти к 2050 году до 10 млн в год [4].
В ответ на эти вызовы Всемирная организация здравоохранения (ВОЗ) предложила Глобальный план действий по борьбе с АМР, одной из целей которого является оптимизация использования АБП [5]. Для этого ВОЗ разработала классификацию AWaRe, разделяющую антибактериальные препараты на три группы: 1) группа доступных (Access); 2) группа наблюдения (Watch); 3) группа резерва (Reserve)1. В группу доступных входят антибиотики узкого спектра действия, рекомендуемые в качестве препаратов первого и второго выбора при часто встречающихся инфекциях. В группу наблюдения входят критически важные антибиотики широкого спектра действия, а также АБП, рекомендуемые только при определенных, ограниченных показаниях, с высоким потенциалом развития АМР. К резервным относят антибиотики, предназначенные для применения в качестве последнего средства при инфекциях с множественной лекарственной устойчивостью и представляющие собой ценный, не возобновляемый ресурс, который следует использовать как можно экономнее. Первоначальная цель оптимизации применения АБП состоит в том, чтобы не менее 60% использования в регионе или стране приходилось на АБП из группы доступных, а использование АБП из групп наблюдения и резерва должно быть ограничено [6].
В 2017 году Правительство Российской Федерации утвердило Стратегию предупреждения распространения АМР на период до 2030 года2. Одной из задач Стратегии является совершенствование мер по осуществлению контроля за оборотом АБП с учетом их потребления, отслеживанием оборота, движения и распределения путем ведения учета в электронной форме с участием производителей, импортеров, организаций оптовой и розничной торговли, медицинских организаций. Учет потребления АБП возможен по данным ФГИС «Мониторинг движения лекарственных препаратов» (система МДЛП), функционирующей в рамках национальной системы маркировки и прослеживаемости товаров. С 1 июля 2020 года введена обязательная маркировка для всех лекарственных препаратов для медицинского применения, а все субъекты обращения лекарственных средств обязаны с этой даты вносить сведения о маркированных ЛП и обо всех операциях с ними в системе МДЛП [7].
Цель исследования
Анализ потребления антибактериальных препаратов в амбулаторных и стационарных условиях в 2022-2023 годах по данным системы мониторинга движения лекарственных препаратов с использованием Анатомо-терапевтической химической классификации и системы установленных суточных доз.
Материал и методы
Потребление АБП рассчитывалось по методологии ВОЗ с использованием Анатомо-терапевтической химической классификации и системы установленных суточных доз (УСД, англ. Defined Daily Dose, DDD)3. УСД – основная международная единица для количественной оценки использования ЛС, представляющая собой среднюю суточную дозу ЛС при его применении по основному показанию у 80% пролеченных взрослых пациентов.
Проведен анализ данных системы МДЛП об АБП, выведенных из оборота в 2022–2023 годах в Карачаево-Черкесской Республике в аптечных организациях (амбулаторный сегмент) и в медицинских организациях (госпитальный сегмент). Всего было проанализировано 3885 GTIN по 69 МНН АБП. Для анализа потребления АБП в больницах рассчитывался показатель УСД на 100 койко-дней, а для оценки общего уровня потребления АБП и уровня потребления АБП в амбулаторных условиях – показатель УСД на 1000 жителей в день.
Статистическая обработка данных проведена с использованием пакета «Анализ данных» в системе Excel MS Office. Оценка различий между выборками проведена с применением t-критерия Стьюдента для оценки нулевой гипотезы, различия считали достоверными при уровне значимости p<0,05.
Результаты и их обсуждение
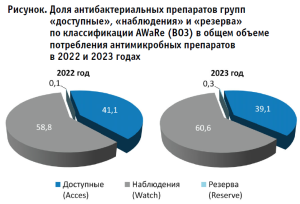
Общее потребление АБП в госпитальном и амбулаторном сегментах в 2022 г. составило 2 891 206 УСД по 65 МНН, уровень потребления АБП составил 16,9 УСД на 1000 жителей в день. В 2023 г. общее потребление АБП составило 3 361 032 УСД по 69 МНН (+16,3%, p<0,05), уровень потребления составил 19,7 УСД на 1000 жителей в день (+16,4%, p<0,05). Через аптечную сеть пациентами получено 91,8 %, в медицинских организациях – 8,2 % от общего объема потребленных АБП за два года. В 2022–2023 годах на доступные АБП приходилось 40,3%, из группы наблюдения – 58,8%, резерва – 0,23% от общего потребления АБП. В 2022 году АБП из группы доступных составляли 41,1%, наблюдения – 58,9%, резерва – 0,1% от общего потребления, в 2023 – 39,1%, 60,9% и 0,3%, соответственно (рис.).
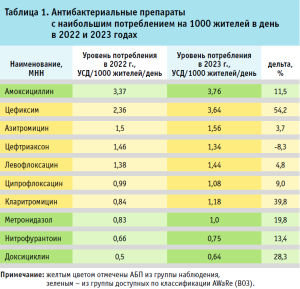
Самыми применяемыми АБП были амоксициллин, цефиксим, азитромицин, левофлоксацин, цефтриаксон, ципрофлоксацин, кларитромицин, метронидазол, нитрофурантоин и доксициклин (табл. 1). На эти препараты приходилось 82,3% всех потребленных АБП за два года.
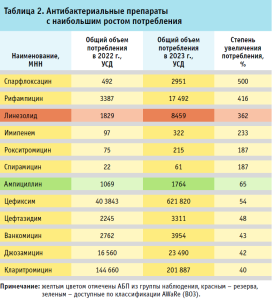
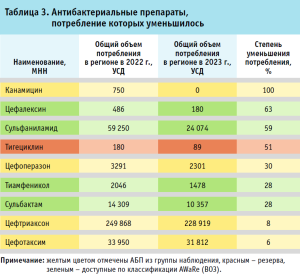
Среди 12 АБП с наибольшим ростом потребления в 2023 году (на 40% и более по сравнению с 2022 годом) десять относятся к группе наблюдения, один (линезолид) – к группе резерва и один (ампициллин) – к группе доступных АБП (табл. 2). Из девяти АБП с наибольшим снижением потребления в 2023 году, по сравнению с 2022 годом, четыре относятся к группе доступных АБП, четыре – к группе наблюдения, один – к группе резерва (табл. 3).
Амбулаторный сегмент. В амбулаторном сегменте в 2022 г. было реализовано 2 676 497 УСД АБП (62 МНН), в 2023 году – 3 100 780 УСД (63 МНН), увеличение на 15,9% было статистически достоверным (p<0,05). Доля АБП из группы доступных в 2022 году составила 43,8% от общего аптечного отпуска АБП, в 2023 – 41,9%, АБП из группы наблюдения – 56,1% и 58,0%, из группы резерва – 0,1% и 0,1% соответственно.
В десятку наиболее потребляемых в амбулаторных условиях вошли четыре АБП из группы доступных: амоксициллин, метронидазол, нитрофурантоин, доксициклин, а также шесть АБП из группы наблюдения: цефиксим, азитромицин, левофлоксацин, кларитромицин, ципрофлоксацин и цефтриаксон. На эти препараты приходилось 83,3% от общего объема аптечного отпуска АБП за два года.
Некоторые АБП из группы наблюдения в 100% случаев были приобретены в аптеках: ломефлоксацин, мидекамицин, миноциклин, нетилмицин, пефлоксацин, рокситромицин, спирамицин, цефдиторен. Около 40% применявшихся в регионе АБП из группы наблюдения и антибиотик из группы резерва полимиксин В имели долю амбулаторного употребления более 90% УСД от общего потребления за два года.
В 2023 году по сравнению с 2022 годом увеличился аптечный отпуск таких АБП из группы наблюдения, как рокситромицин (в 2,9 раз), спирамицин (в 2,8 раз), цефоперазон (на 66%), цефтазидим (на 53%), цефиксим (на 53%), спарфлоксацин (с 0 до 42 УСД). Уменьшился отпуск таких АБП из группы резерва, как линезолид (на 54%) и тигециклин (на 29%), АБП из группы наблюдения имипенема (на 39%) и АБП из группы доступных цефалексина (на 63%), сульфаниламида (на 60%), цефазолина (на 29%) и тиамфеникола (на 27%).
Госпитальный сегмент. В госпитальном сегменте в 2022 году было выдано для применения 234 349 УСД АБП (51 МНН), в 2023 году – 284 722 УСД (54 МНН), увеличение на 21,5% было статистически достоверным (p<0,05). Показатель госпитального потребления всех АБП (взрослые и дети) увеличился за год с 29,7 до 35,1 УСД на 100 койко-дней (на 18,4%, p<0,05). Доля АБП из группы доступных в 2022 г. составила 16,5% от общего потребления АБП в стационарах, в 2023 году – 14,1%, АБП из группы наблюдения – 82,7% и 82,9%, из группы резерва – 0,8% и 3,0%, соответственно.
В десятку наиболее потребляемых в стационарах вошли семь АБП из группы наблюдения: цефтриаксон, левофлоксацин, цефотаксим, рифампицин, ципрофлоксацин, моксифлоксацин, азитромицин и три АБП из группы доступных: сульбактам, амоксициллин, метронидазол. На эти 10 АБП приходилось 83,1% от общего объема применявшихся АБП.
Ряд АБП из группы резерва (цефтаролин, азтреонам) и из группы наблюдения (биапенем, канамицин, эртапенем, пиперациллин) применялись только в медицинских организациях, случаев отпуска в аптеках не было. Кроме того, высокую долю госпитального потребления (91–99% от общего потребления за два года) имели АБП из группы наблюдения – спарфлоксацин, рифампицин, цефоперазон, цефтазидим, из группы резерва – линезолид, из группы доступных – сульбактам.
Отмечено существенное увеличение годового потребления в стационарах таких АБП из группы наблюдения, как цефиксим в 66 раз (с 92 до 6123 УСД), эритромицин в 12,9 раз, цефуроксим в 7,2 раз, джозамицин в 6,6 раз, имипенем в 6,3 раз, спарфлоксацин в 5,9 раз, рифампицин в 5,3 раз, азитромицин в 2,8 раза, а также АБП из группы резерва – линезолид в 5,2 раз.
Уменьшение потребления в стационарах зафиксировано по таким АБП из группы наблюдения, как канамицин – на 100%, офлоксацин – на 99,5%, клиндамицин – на 84%, фосфомицин – на 76%, норфлоксацин – на 63%, из группы резерва: полимиксин В – на 74%, тигециклин – на 56% и из группы доступных: тиамфеникол – на 95%.
Ни в одной больнице региона, включая медицинские организации третьего уровня, в лечебные отделения не выдавались такие АБП из числа входящих в Оптимальный перечень антимикробных препаратов для больничного формуляра стационара для взрослых [8], как цефалексин, цефтазидим/авибактам, цефтолозан/тазобактал, дорипенем, нетилмицин, телаванцин, даптомицин, тедизолид, колистин.
Discussion.
Статистически достоверный рост общего потребления АБП в регионе за один год с 16,9 до 19,8 УСД на 1000 жителей в день (на 16,4%) согласуется с глобальным трендом роста потребления АБП. Как показало исследование, охватывающее 76 стран, с 2000 по 2015 гг. общее потребление АБП увеличилось на 65% – с 21,1 до 34,8 миллиардов УСД, уровень потребления АБП возрос на 39% – с 11,3 до 15,7 УСД на 1000 жителей в день [9].
Рост потребления АБП, обостряющий проблему АМР, обусловливает необходимость принятия мер по оптимизации применения этой группы лекарств. Имеются примеры эффективности таких мер. Например, в Армении общее потребление АБП снизилось на 32,7% – с 15,9 до 10,7 УСД на 1000 жителей в день в период с 2011 по 2015 гг. благодаря целевым информационным кампаниям и другим инициативам многоотраслевой группы министерства здравоохранения этой страны [10]. В Словении комплексные мероприятия, включающие введение ряда ограничений министерством здравоохранения и Агентством медицинского страхования, привели к снижению потребления АБП на 31% в период с 1999 по 2012 год [11].
Полученные в исследовании данные о том, что в 2023 году только 39,1% от общего потребления АБП приходилось на антибиотики из группы доступных, свидетельствуют о недостижении целевого показателя, установленного программой деятельности ВОЗ на 2019–2023 гг., рекомендующей, чтобы доля АБП из группы доступных составляла более 60% от общего использования антибиотиков, а потребление резервных антибиотиков должно быть ограничено ситуациями, когда все альтернативные АБП неэффективны [6]. Данные авторов о том, что 91,8 % АБП поступают к пациентам через розничную аптечную сеть, соответствуют сообщениям других исследователей о том, что более 90% случаев применения антибиотиков во всем мире приходится на амбулаторное лечение, и менее 10% – на стационарное лечение [12]. При отсутствии ограничений по продаже АБП в аптеках с возможностью их получения без рецепта возникают риски применения АБП пациентами без предписания врача и без показаний в ходе самолечения. В свою очередь, необоснованный и неправильный прием АБП, в том числе для лечения ОРВИ без присоединения бактериальной инфекции, прием в низких дозировках или раннее прекращение приема увеличивают опасность развития АМР и распространения устойчивых к АБП штаммов бактерий.
В настоящее время мероприятия по борьбе с АМР сфокусированы на госпитальном сегменте применения АБП [13], имеются рекомендации по Стратегии контроля антимикробной терапии при оказании медицинской помощи в стационарах [8], но нет таких рекомендаций для амбулаторно-поликлинической медицинской помощи. С учетом того, что более 90% всех АБП поступает через розничные аптеки, мероприятия по предотвращению развития АМР должны проводиться повсеместно как в госпитальных, так и амбулаторных условиях.
Для предотвращения случаев приобретения в аптеках АБП для лечения пациентов, находящихся на стационарном лечении в больницах, необходим контроль за наличием ЛП, входящих в больничные формуляры АБП, а также за формированием этих формуляров, предназначенных для обеспечения адекватной терапии и профилактики основных нозологических форм внебольничных и нозокомиальных инфекций [8].
Расширение вакцинации и применения средств лабораторной диагностики может сократить ненужное потребление антибиотиков [14] как напрямую за счет вакцинации против ряда бактериальных заболеваний, так и косвенно за счет сокращения вирусных заболеваний, при лечении которых часто без необходимости применяют антибиотики. Для предотвращения необоснованного назначения АБП немаловажным является исключение антибиотиков из стандартов медицинской помощи больным вирусными инфекциями, как это имеет место во вступившем в силу с 4 мая 2024 г. Стандарте медицинской помощи взрослым при острых респираторных вирусных инфекциях4. В действовавшем ранее и утратившем силу Стандарте специализированной медицинской помощи при ОРВИ тяжелой степени тяжести в перечень лекарственных препаратов входили антибиотики: азитромицин, левофлоксацин, цефоперазон, ванкомицин, гентамицин, амоксициллин5.
Также важным представляется проведение необходимых лабораторных исследований, предусмотренных стандартами медицинской помощи и клиническими рекомендациями, включая молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на различные вирусы, определение чувствительности микроорганизмов к антибиотикам, исследование уровня С-реактивного белка в крови. По данным исследования, проведенного во Вьетнаме, тестирование на С-реактивный белок при нетяжелых острых инфекциях дыхательных путей при оказании первичной медико-санитарной помощи достоверно снизило использование АБП без ущерба для выздоровления пациентов [14].
Conclusion.
В представленном исследовании показана возможность комплексной оценки регионального потребления антибактериальных препаратов в амбулаторном и госпитальном сегментах с использованием сведений МДЛП с применением Анатомо-терапевтической химической классификации и системы установленных суточных доз и классификации антибиотиков AWaRe.
Анализ сведений, имеющихся в системе МДЛП, об объемах потребления, ассортименте и местах применения АБП, может проводиться как в рамках научных исследований, так и в целях принятия мер по управлению антимикробной терапией, направленных на рациональное применение антибиотиков не только в стационарах, но и при оказании амбулаторно-поликлинической медицинской помощи, которая, по-видимому, должна стать главной мишенью для мероприятий, направленных на оптимизацию применения АБП. Актуальность таких мер обусловлена ростом потребления АБП во всем мире с возможностью усугубления проблемы АМР и снижением эффективности антибиотиков, что представляет собой серьезную угрозу для здоровья человека.
_______________________________________________________________________
1 World Health Organization. Access, Watch, Reserve (AWaRe) classification of antibiotics for evaluation and monitoring of use. 2021. URL: https://www.who.int/publications-detail-redirect/2021-aware-classification (дата обращения: 25.03.2024).
2 Распоряжение Правительства РФ от 25 сентября 2017 г. № 2045-р «О Стратегии предупреждения распространения антимикробной резистентности в РФ на период до 2030 года».
3 World Health Organization. The WHO Collaborating Centre for Drug Statistics Methodology. The ATC/DDD Methodology. URL: https:// www.who.int/tools/atc-ddd-toolkit/methodology (дата обращения: 25.03.2024).
4 Приказ Минздрава России от 18.03.2024 № 127н «Об утверждении стандарта медицинской помощи взрослым при острых респираторных вирусных инфекциях (ОРВИ) (диагностика и лечение)». URL: https://docs.cntd.ru/document/1305738940 (дата обращения: 13.05.2024).
5 Приказ Минздрава России от 07.11.2012 № 657н «Об утверждении стандарта специализированной медицинской помощи при острой респираторной вирусной инфекции тяжелой степени тяжести». URL: https://docs.cntd.ru/document/902385288 (дата обращения: 13.05.2024).
- Toner E., Adalja A., Gronvall G.K. [et al.] Antimicrobial resistance is a global health emergency. Health Secur. 2015; 13(3): 153–155.
- Murray C.J., Ikuta K.S., Sharara F. [et al.] Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022; 399: 629–655.
- Gulen T.A., Guner R., Celikbilek N. [et al.] Clinical importance and cost of bacteremia caused by nosocomial multi drug resistant acinetobacter baumannii. Int. J. Infect. Dis. 2015; 38: 32–35.
- Gautam A. Antimicrobial Resistance: The Next Probable Pandemic. JNMA J. Nepal Med. Assoc. 2022; 60: 225–228.
- Global action plan on antimicrobial resistance // World Health Organization: [website]. – URL: https://iris.who.int/handle/10665/193736.
- Sharland M., Zanichelli V., Ombajo L.A. [et al.] The WHO essential medicines list AWaRe book: From a list to a quality improvement system. Clin. Microbiol. Infect. 2022; 28: 1533–1535.
- Samoilova A.V., Kudryavtseva E.M. The Federal State Information System for monitoring the movement of Medicines for medical use is a digital tool in the field of control over the circulation of medicines. Vestnik Roszdravnadzora. 2022; 3: 6–15. (In Russian).
- The SCAT Program (Antimicrobial Therapy Control Strategy) in the provision of inpatient medical care: Russian clinical recommendations. / Edited by S.V. Yakovlev, N.I. Briko, S.V. Sidorenko, D.N. Protsenko. – M.: Publishing house "Pero", 2018. – 156 p. (In Russian).
- Klein E.Y., Van Boeckel T.P., Martinez E.M. [et al.] Global increase and geographic convergence in antibiotic consumption between 2000 and 2015. Proc. Natl. Acad. Sci. USA. 2018; 115(15): E3463– E3470. DOI: 10.1073/pnas.1717295115.
- Robertson J., Iwamoto K., Hoxha I. [et al.] Antimicrobial Medicines Consumption in Eastern Europeand Central Asia – An Updated Cross-National Study and Assessment of Quantitative Metrics for Policy Action. Front. Pharmacol. 2018; 9: 1156.
- Furst J., Cizman M., Mrak J. [et al.] The influence of a sustained multifaceted approach to improve antibiotic prescribing in Slovenia during the past decade: Findings and implications. Expert Rev. Anti Infect. Ther. 2015; 13: 279–289.
- Zanichelli V., Sharland M., Cappello B. [et al.] The WHO AWaRe (Access, Watch, Reserve) antibiotic book and prevention of antimicrobial resistance. Bull. World Health Organ. 2023; 101: 290–296.
- Jabeen N., Ullah W., Khalid J., Samad Z. Estimating antibiotics consumption in a tertiary care hospital in Islamabad using a WHO’s defined daily dose methodology. Antimicrob. Resist. Infect. Control. 2023; 23; 12(1): 132. DOI: 10.1186/s13756-023-01311-2.
- Do N.T., Ta N.T., Tran N.T. [et al.] Point-of-care C-reactive protein testing to reduce inappropriate use of antibiotics for non-severe acute respiratory infections in Vietnamese primary health care: a randomised controlled trial. Lancet Glob. Health. 2016; 4(9): e633–e641. DOI: 10.1016/S2214-109X(16)30142-5.
