PHARMACOVIGILANCE
Analysis of ICSR data for biotechnological protein drugs
1 — Federal State Budgetary Educational Institution of Higher Education “Yaroslavl State Medical University” of the Ministry of Healthcare of the Russian Federation, 5, Revolutsionnaya st., Yaroslavl, 150000, Russian Federation.
ORCID: https://orсid.org/0000-0002-4381-9513
2 — Federal State Budgetary Educational Institution of Higher Education “Yaroslavl State Medical University” of the Ministry of Healthcare of the Russian Federation, 5, Revolutsionnaya st., Yaroslavl, 150000, Russian Federation.
ORCID: https://orсid.org/0009-0004-7509-7326
3 — Federal State Budgetary Educational Institution of Higher Education “Yaroslavl State Medical University” of the Ministry of Healthcare of the Russian Federation, 5, Revolutsionnaya st., Yaroslavl, 150000, Russian Federation.
ORCID: https://orсid.org/0000-0001-7847-1679
4 — Territorial Administration of the Federal Service for Surveillance in Healthcare for the Kostroma Region, 1/2, avenue Mira, Kostroma, 156000, Russian Federation.
The study provides an analysis of a database of adverse reactions to biotechnological protein drugs. The database of the regional center for pharmacovigilance of the Yaroslavl region was analyzed. The main system organ classes of adverse reactions were identified: “Skin and subcutaneous tissue disorders”, “General disorders and reactions at the injection site”. The obtained data indicate the importance of recording adverse drug reactions and transmitting information to the pharmacovigilance system, which contributes to compliance with drug safety, increasing the responsibility and involvement of medical personnel in the development of pharmacovigilance.
Keywords: pharmacovigilance, antibodies, biotechnological protein, spontaneous reports
Background.
Фармаконадзор – вид деятельности по мониторингу эффективности и безопасности лекарственных препаратов, направленный на выявление, оценку и предотвращение нежелательных реакций (НР) применения лекарственных препаратов (ЛП)1. В современном мире значительна распространенность НР: по данным статистики, на 2019 г. в мире были зарегистрированы до 2 млн НР, из которых более 150 тыс. являлись крайне тяжелыми и имели фатальные последствия. Частота госпитализаций, связанных с развившимися у пациентов НР, в разных странах мира варьируется от 2 до 21%, но при этом значительная доля подобных осложнений лекарственной терапии потенциально являются предотвратимыми [1].
Одной из эффективных систем оценки НР лекарственных препаратов является система регистрации спонтанных сообщений [2]. Экспертами доказано, что в 10–20% случаях применение ЛП может сопровождаться появлением нежелательных реакций у пациентов. При этом в России доля передаваемых отчетом ICSR (Individual Case Safety Report) может составлять не более 20% от реального количества нежелательных реакций, что свидетельствует о необходимости совершенствования организационной работы при осуществлении фармаконадзора [3]. За последние пять лет сообщаемость по Ярославской и Костромской областям имеет тенденцию роста как в отношении числа поступающих сообщений, так и охвата медицинских организаций, внедривших в практическую деятельность выполнение требований по фармаконадзору. В Костромской области лидирующие позиции по числу поступивших сообщений принадлежат иммунобиологическим и антибактериальным лекарственным средствам. По Ярославской области выявлена тенденция роста числа сообщений в отношении лекарственных препаратов биотехнологических белков, получивших широкое применение в онкологии, онкогематологии, ревматологии, иммунологии и кардиологии для лечения тяжелых заболеваний [3].
Разработка методик анализа данных фармаконадзора способствует развитию прогностических возможностей и широкому применению риск-ориентированного подхода при применении технологий здравоохранения.
Материалы и методы
Проверена и проанализирована база данных спонтанных сообщений регионального центра фармаконадзора с точки зрения развития нежелательных реакций (исключены сведения о неэффективности подозреваемого препарата, зарегистрированные ранее как НР), наименования действующего вещества, пути введения лекарственного препарата (ЛП), системно-органного класса (СОК). Классифицированы сведения 40 спонтанных сообщений о 57 нежелательных реакциях, зарегистрированных в Ярославской области с 2019 по 2024 год и связанных с применением препаратов биотехнологических белков.
Исследование проведено на средства регионального гранта «Реализация научных исследований, выполняемых аспирантами под руководством научных руководителей», Министерство социальных коммуникаций и развития некоммерческих организаций Ярославской области (Выписка из Протокола № 3 КК-2024 заседания конкурсной комиссии, г. Ярославль).
Цель исследования
Разработать методику анализа спонтанных сообщений и выявить основные системно-органные классы, подверженные нежелательному воздействию при применении биотехнологических белков, на основе данных регионального центра фармаконадзора Ярославской области.
Результаты исследования и обсуждение результатов
Произведен поиск ICSR в базе данных регионального центра фармаконадзора согласно перечню МНН лекарственных препаратов биотехнологических белков, включенных в приложение 3 Территориальной программы государственных гарантий бесплатного оказания населению Ярославской области медицинской помощи2. Основные данные (наименование НР, МНН, торговое наименование лекарственного препарата, путь введения, доза, год регистрации НР, показание, критерий серьезности и исход) объединены в базу данных исследования. Проведена сверка наименования НР и показания для исключения данных о неэффективности терапии (ранее зарегистрированная НР исключалась из базы данных исследования, если показание и наименование НР совпадали). Для соблюдения корректности наименований НР проведена сверка базы данных исследования и раздела 4.8 «Нежелательные реакции» общей характеристики лекарственного препарата. В случае обнаружения расхождений в подходе к наименованию НР, наименование НР корректировались на основе данных общей характеристики лекарственного препарата (изменения в наименование НР в базе данных исследования).
Каждой НР присваивался системно-органный класс в соответствии с общей характеристикой лекарственного препарата (ОХЛП). Если НР являлась непредвиденной, то проводился поиск по наименованию НР в ОХЛП лекарственных препаратов той же фармако-терапевтической группы для присвоения корректного системно-органного класса.
Перечень спонтанных сообщений о НР был получен от врачей медицинских организаций г. Ярославля: ГБУЗ ЯО «Областная клиническая больница», ГУЗ ЯО «Детская поликлиника № 5», ГБУЗ ЯО «Клиническая больница им. Н.А. Семашко», ГБУЗ ЯО «Клиническая больница № 2»; г. Рыбинска: ГУЗ ЯО «Городская детская больница», ГБУЗ ЯО «Рыбинская городская Больница № 1»; г. Углича: ГУЗ ЯО Угличская ЦРБ; г. Переславль-Залесский: ГБУЗ ЯО «Переславская ЦРБ».
В таблице 1 изложены данные о зарегистрированных в системе спонтанных сообщениях НР. Более половины (53 % ICSR) было получено в связи с развитием НР у пациентов женского пола, 47 % – доля ICSR пациентов мужского пола.
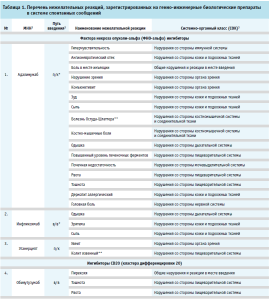
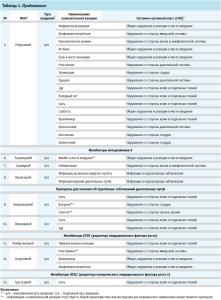
Биологические лекарственные препараты, указанные в таблице 1, применялись по следующим показаниям: ревматоидный артрит, анкилозирующий спондилит, ювенильный идиопатический артрит, спондилоартрит, псориатический артрит, язвенный колит, болезнь Крона, болезнь Бехчета, B-клеточная лимфома, хронический В-клеточный лимфоцитарный лейкоз, рак прямой кишки, рак сигмовидной ободочной кишки, рак легкого, рак молочной железы и бронхиальная астма.
Учитывая гетерогенность исследуемых видов терапии (по показаниям, числу спонтанных сообщений), была оценена структура СОК биологической терапии в целом по результатам базы данных спонтанных сообщений для 13 МНН биотехнологических белков (табл. 2).
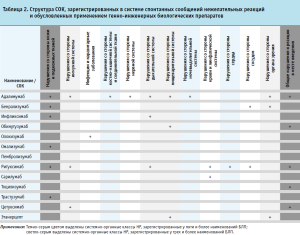
Наибольшее число нежелательных реакций было связано с нарушениями со стороны кожи и подкожных тканей (30 %), общими нарушениями и реакциями в месте введения (12 %), нарушениями со стороны зрения (9 %) и органов дыхания (9 %). Серьезные нежелательные реакции проявлялись в развитии ангионевротического отека (адалимумаб, Эксэмптия®), инфузионных реакций (ритуксимаб, Ацеллбия®), анафилактического шока (ритуксимаб, Реддитукс®; цетуксимаб, Эрбитукс) и отеком Квинке (цетуксимаб, Эрбитукс). Серьезные нежелательные реакции, как правило, относились к нарушениям со стороны иммунной системы. Зарегистрирована одна серьезная непредвиденная нежелательная реакция – слепота (бенрализумаб, п/к путь введения).
Выводы
Основными СОК, подверженными развитию нежелательных реакций в ответ на применение биотехнологических белков, являются «Нарушения со стороны кожи и подкожных тканей» (НР сыпь, зуд), «Общие нарушения и реакции в месте введения» (НР инфузионная реакция, анафилактический шок). Также значительное число НР зарегистрировано в СОК «Нарушения со стороны иммунной системы», «Нарушения со стороны дыхательной системы», «Нарушения со стороны пищеварительной системы» и «Нарушения со стороны органа зрения». Наибольшее число нежелательных реакций было связано с нарушениями со стороны кожи и подкожных тканей, общими нарушениями и реакциями в месте введения, нарушениями со стороны зрения и органов дыхания.
Для наименований биотехнологических белков «адалимумаб», «этанерцепт», «тоцилизумаб», «бенрализумаб» и «цетуксимаб» выявлены НР, ранее не указанные в общей характеристике лекарственного препарата или инструкции для медицинского применения. Зарегистрирована одна серьезная непредвиденная нежелательная реакция – слепота (бенрализумаб, п/к путь введения). Проведенное исследование подтверждает важность выявления нежелательных реакций при применении ЛП с соблюдением механизма передачи данных в системе фармаконадзора. Анализ и обобщение получаемых сведений о действии лекарственных препаратов создает основу лекарственной безопасности, способствует повышению ответственности и вовлеченности медицинского сообщества в развитие фармаконадзора.
______________________________________________________________________
1 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». URL: https://normativ.kontur.ru/document?moduleId=1&documentId=489959.
2 Постановление Правительства Ярославской области от 29.12.2023 № 1451-п «О Территориальной программе государственных гарантий бесплатного оказания населению Ярославской области медицинской помощи на 2024 год и на плановый период 2025 и 2026 годов».
3 Государственный реестр лекарственных средств. URL: https://grls.minzdrav.gov.ru/default.aspx.
- Litvinenko T.S., Polinskaya T.A., Shishov M.A., Safronenko A.V., Gantsgorn E.V. Pharmacovigilance: focus on the analysis of spontaneous reports of adverse drug reactions // Yuzhno-Rossijskij zhurnal terapevticheskoj praktiki (South Russian Journal of Therapeutic Practice.). 2023; 4(1): 46–52. DOI:10.21886/2712-8156-2023-4-1-46-52. (In Russian).
- Litvinenko T.S., Safronenko A.V., Maklyakov Yu.S., Gantsgorn E.V., Postnikova E.S., Gaisaev M.O., Brizhak V.G. Analysis of Spontaneous Reports as a Methodological Pharmacovigilance Tool // Biomedicina (Journal Biomed). 2022. № 2. URL: https://cyberleninka.ru/article/n/analiz-spontannyh-soobscheniy-kak-instrument-farmakonadzora [Accessed: 25.03.2025]. (In Russian).
- Krasheninnikov A.E. Abstract for the degree of Doctor of Pharmaceutical Sciences “Improving pharmacovigilance based on state and civil institutions for quality control of medicines in the Russian Federation”, Perm, 2020. (In Russian).
