CIRCULATION OF MEDICINES
Topical issues of pharmacovigilance in the activities of medical organizations (on the example of the Rostov region)
1 — Territorial body of Roszdravnadzor for Rostov region, 71в / 63в, Chentsova st., Rostov-on-Don, 344037, Russian Federation.
2 — Territorial body of Roszdravnadzor for Rostov region, 71в / 63в, Chentsova st., Rostov-on-Don, 344037, Russian Federation.
The article presents the experience of implementing the legal requirements for the provision of information on the safety and efficacy of medicines in the Rostov region. The relevant indicators of «communicability» in the framework of pharmacovigilance for the period from 2019 to the first quarter of 2022 are presented and analyzed. General directions for improving the efficiency of pharmacovigilance are proposed.
Keywords: pharmacovigilance, spontaneous messages, artificial intelligence
Применение лекарственных препаратов всегда сопряжено с потенциальными рисками недостаточной безопасности и эффективности, а также риском полипрагмазии, учитывая множество вариантов взаимодействия лекарственных средств между собой и их проявлений в патологически измененных органах и системах. В целях минимизации рисков вопросам фармаконадзора уделяется пристальное внимание как в нашей стране, так и на международном уровне. Всемирной организацией здравоохранения, Евразийским экономическим союзом созданы специальные программы мониторинга безопасности лекарственных препаратов. Основным международным методом мониторинга безопасности и эффективности лекарственных препаратов служит метод спонтанных сообщений. В субъектах Российской Федерации частота спонтанных сообщений, рассчитываемая на 100 тысяч населения, достаточно широко варьирует [1].
С учетом вышеизложенного, целью настоящей статьи является анализ результатов сообщаемости информации о безопасности применения лекарственных препаратов медицинскими работниками Ростовской области с учетом сведений, внесенных в автоматизированную информационную систему Росздравнадзора – национальную базу данных «Фармаконадзор»1.
Требования к медицинским работникам в контексте обязанности информирования о недостаточной безопасности и/или эффективности лекарственных препаратов установлены целым рядом нормативных правовых актов:
- Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза2;
- Решением Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза»;
- Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (статья 73);
- Федеральным законом от 12.05.2010 № 61-ФЗ «Об обращении лекарственных средств» (статья 64);
- приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
Дополнительно Росздравнадзором неоднократно направлялись информационные письма с разъяснениями о порядке осуществления и организации фармаконадзора на уровне медицинских организаций.
Одним из показателей для оценки эффективности фармаконадзора, как уже было отмечено выше, служит анализ сообщаемости информации о безопасности применения лекарственных препаратов.
В частности, в Ростовской области за период с 2019 года по первый квадриместр 2022 года наблюдался значительный рост данных сообщений (табл. 1).
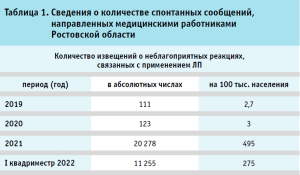
В тоже время, анализ структуры сообщений, внесенных в автоматизированную информационную систему Росздравнадзора – национальную базу данных «Фармаконадзор», свидетельствует о пропорциональном росте сообщений, связанных с применением вакцин (табл. 2).
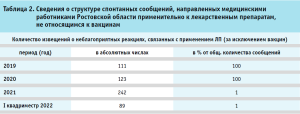
При более детальном анализе установлено, что основание направления значительной части спонтанных сообщений, связанных с применением вакцин, формально – наличие заболевания новой коронавирусной инфекцией и проведение соответствующей вакцинации в анамнезе.
Действительно, пунктом 7.1.6.4 «Правил надлежащей практики фармаконадзора Евразийского экономического союза», утвержденных Решением Совета Евразийской экономической комиссии от 03.11.2016 № 87, предусмотрено, что репортированию подлежат случаи отсутствия эффективности подозреваемого лекарственного препарата – вакцины, с целью выделения потенциальных сигналов о сниженной иммуногенности в подгруппе вакцин, сниженном иммунитете или замещении штамма. Формальный подход к исполнению данной нормы представляется необоснованным и искажающим объективную картину о безопасности и/или эффективности вакцин. Тем более, что положениями пункта 36 Порядка осуществления фармаконадзора, утвержденного приказом Росздравнадзора от 15.02.2017 № 1071, отдельно предусмотрено, что важнейшим аспектом в рассматриваемой ситуации является отсутствие индивидуальных особенностей пациента и (или) специфики его заболевания, влияющих на клинический эффект.
Вышеизложенное свидетельствует о двух разнонаправленных тенденциях в состоянии современного здравоохранения. С одной стороны, к сожалению, можно констатировать недостаточную информированность и неготовность медицинских работников нести ответственность за формальное исполнение обязанностей, связанных с фармаконадзором. С другой стороны, внедрение информационных технологий в деятельность Росздравнадзора (формирование автоматизированной информационной системы), а также широкое применение профилактических мероприятий в осуществлении контрольно-надзорных полномочий, позволило кардинально улучшить процессы направления, регистрации и анализа спонтанных сообщений, что в конечном итоге положительно отрази лось на его эффективности в целом.
Безусловно, сам механизм направления спонтанных сообщений, предусматривающий определенную «свободу усмотрения» со стороны лечащего врача в условиях процессов внедрения информатизации здравоохранения, требует обсуждения со стороны профессионального сообщества и, возможно, пересмотра. В данном контексте следующим качественно новым этапом является применение автоматизированных средств идентификации лекарственных препаратов в практике фармаконадзора [1]. В настоящее время сфера здравоохранения стоит на пороге широкого применения искусственного интеллекта: активно формируются доступные для обработки и анализа сведения как о пролеченных случаях, так и о примененных лекарственных препаратах. Многотысячная номенклатура лекарственных средств, а также потенциальные негативные аспекты полипрагмазии обуславливают необходимость перехода к цифровизации процессов, позволяющей автоматически осуществлять мониторинг безопасности и эффективности лекарственных препаратов в режиме реального времени. В настоящее время все необходимые предпосылки сформированы, при этом активная роль Федеральной службы по надзору в сфере здравоохранения по формированию соответствующей информационной среды уже сейчас позволяет внедрять принципы «умного контроля» в сфере фармаконадзора.
_______________________________________________________________________
1 URL: https://roszdravnadzor.gov.ru/services/npr_ais?
2 Федеральный закон от 31.01.2016 № 5-ФЗ «О ратификации Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза». URL: http://www.kremlin.ru/acts/bank/40479.
- Murashko M.A. , Samoilova A.V., Glagolev S.V. The use of drug identification tools in the practice of pharmacovigilance – Vestnik Roszdravnadzora. – 2020. – Vol. 5-1. – P. 6–9.
- Kudryavtseva E.M. , Gorelov K.V. Pharmacovigilance in medical organizations – Vestnik Roszdravnadzora. – 2021. – Vol. 2. – P. 53–57.
