ORGANIZATION OF WORK OF SUBORDINATE INSTITUTIONS
Optimizing the work of the Moscow Laboratory for Quality Control of Medicines during the COVID-19 pandemic
1 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0002-9667-1014
The article presents the results of optimization of the work of one of the branches of the “Information Center for Expertise, Accounting and Analysis of Circulation of Medical Products” of Roszdravnadzor - the Moscow Laboratory for Quality Control of Medicines - during the period of restrictive measures in connection with the spread of the new coronavirus infection COVID-19. The set of measures implemented in the laboratory to prevent the spread of the virus is described. Thanks to the restrictions introduced, the release of vaccines against coronavirus infection into circulation, as well as testing of drugs entering the Russian Federation under the simplified regime, was carried out without interruption.
Keywords: COVID-19 pandemic, Moscow Laboratory for Quality Control of Medicines, optimization of work in a pandemic, release of vaccines against coronavirus infection, increased laboratory throughput
Пандемия новой коронавирусной инфекции, захватившая мир в 2020 году, внесла значительные коррективы в порядок работы большинства организаций, в том числе и в деятельность учреждений Росздравнадзора.
В конце 2019 года в Китайской Народной Республике (КНР) произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй). Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 года определила официальное название инфекции, вызванной новым коронавирусом, – COVID-19 (Coronavirus disease 2019). Международный комитет по таксономии вирусов 11 февраля 2020 года присвоил официальное название возбудителю инфекции – SARS-CoV-2. Новая коронавирусная инфекция, вызванная SARS-CoV-2, включена в перечень заболеваний, представляющих опасность для окружающих1. С конца января 2020 года во многих странах мира стали регистрироваться случаи COVID-19, преимущественно связанные с поездками в КНР. В конце февраля 2020 года резко осложнилась эпидемиологическая обстановка по COVID-19 в Южной Корее, Иране и Италии, что в последующем привело к значительному росту числа случаев заболевания в других странах мира, связанных с поездками в эти страны. 11 марта 2020 года ВОЗ объявила о начале пандемии COVID-19.2
11 августа 2020 года в Российской Федерации была зарегистрирована первая в мире вакцина для профилактики коронавирусной инфекции – препарат «Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2», более широко известный под латинизированным названием Sputnik-V3.
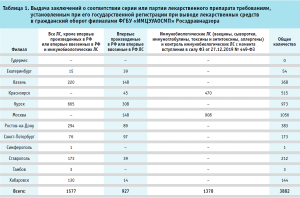
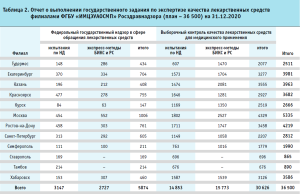
Принимая во внимание, что на Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (далее – ФГБУ «ИМЦЭУАОСМП» Росздравнадзора), в соответствии с требованиями статьи 52.10 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств», возложена ответственность за выдачу заключений о соответствии серии или партии иммунобиологического лекарственного препарата требованиям, установленным при его государственной регистрации при выводе лекарственных средств в гражданский оборот (табл. 1), а также, в соответствии с приказом Росздравнадзора от 07.08.2015 № 5539 «Об утверждении Порядка осуществления выборочного контроля качества лекарственных средств для медицинского применения», возложена ответственность за выполнение государственного задания по осуществлению выборочного контроля качества лекарственных средств для медицинского применения (табл. 2), Московская лаборатория контроля качества лекарственных средств (далее – МЛКЛС) столкнулась с необходимостью противостоять вызовам пандемии, не прерывая при этом работы по испытаниям лекарственных препаратов, в первую очередь – вакцины против коронавирусной инфекции.
Летом 2020 года на территории Российской Федерации действовали ограничительные меры, введенные в связи с распространением коронавирусной инфекции в соответствии с пунктом 1 Указа Президента РФ от 11.05.2020 № 316 «Об определении порядка продления действия мер по обеспечению санитарно-эпидемиологического благополучия населения в субъектах Российской Федерации в связи с распространением новой коронавирусной инфекции (COVID-19)». В частности, данные меры предусматривали приостановление или ограничение деятельности отдельных организаций на период действия данных мер.
При организации работы необходимо было руководствоваться общими ограничительными рекомендациями, согласно Санитарно-эпидемиологическим правилам СП 3.1.3597-20 «Профилактика новой коронавирусной инфекции (COVID-19)» (далее – Правила), утвержденными Постановлением Главного государственного санитарного врача Российской Федерации от 22.05.2020 № 15, которые, в частности, устанавливают, что все организации, независимо от формы собственности, обязаны4:
- разобщать лиц, подвергшихся риску заражения (при распространении инфекции – максимальное ограничение контактов);
- выявлять лиц с признаками инфекционных заболеваний;
- дезинфицировать рабочие помещения, использовать оборудование по обеззараживанию воздуха;
- иметь запас дезинфицирующих средств.
С целью реализации перечисленных мероприятий распоряжением руководителя МЛКЛС был внедрен комплекс мер, включавший в себя:
- изменение рабочего графика со сдвигом начала и окончания рабочего дня на один час. Данная мера была направлена на максимальное ограничение потенциальных контактов сотрудников по пути на работу в общественном транспорте с тем, чтобы передвижение осуществлялось вне часа пик, во время сниженной загрузки транспортных средств;
- полное прекращение доступа на территорию лаборатории лиц, не являющихся сотрудниками лаборатории. Данная мера была направлена в первую очередь на представителей организаций-поставщиков, снабжающих лабораторию материалами и реактивами. Для передачи данной категории товаров было выделено помещение приема образцов, изначально имеющее шлюзовую планировку и исключающее прямой контакт принимающей и передающей стороны;
- установка на всей территории лаборатории закрытых источников ультрафиолетового излучения, позволяющих проводить обеззараживание воздуха в присутствии сотрудников; раздача дезинфицирующих растворов в виде пульверизаторов, а также установка дополнительного количества стационарных диспенсеров с дезинфицирующими растворами в местах наибольшего скопления людей или наиболее проходимых местах лаборатории;
- закупка и выдача сотрудникам средств индивидуальной защиты, в том числе перчаток и одноразовых масок;
- закупка за счет средств, полученных от приносящей доход деятельности, электронных термометров и их передача на пункт охраны; введение обязательной проверки температуры тела посетителей. Все сотрудники также были обязаны измерять температуру тела дважды в день в домашних условиях (вечером и утром, перед выездом на работу) и вести дневник самонаблюдений с фиксацией полученных значений. При повышении температуры, вне зависимости от предполагаемой причины, сотрудник не допускался к работе и переводился в режим самоизоляции;
- передача информации о заболевших в Оперативный штаб г. Москвы, которая была обеспечена централизовано, силами отдела кадров ФГБУ «ИМЦЭУАОСМП» Росздравнадзора;
- регулярное, на еженедельной основе, тестирование сотрудников лаборатории на наличие коронавируса методом ПЦР также было обеспечено централизовано, силами управления делами Федеральной службы по надзору в сфере здравоохранения. Тестирование проводилось на рабочем месте, специализированной выездной медицинской бригадой. Для их работы в помещениях МЛККЛС было выделено отдельное помещение, позволяющее проводить тестирование сотрудников без скопления людей и риска передачи инфекции.
Заявленный производителями объем производства вакцины «Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2» (до 50 серий в неделю и более) потребовал дополнительного пересмотра имеющихся возможностей. Учитывая, что постановка одного испытания по показателю «Специфическая активность» требует раститровки семи стандартных 96-луночных планшетов и их своевременной обработки, изначальные мощности лаборатории позволяли обрабатывать в день не более 4 серий препарата (ограничением в данном случае являлась именно пропускная способность ИФА-тестирования, а не возможность постановки испытаний на животных), а также необходимость профилактического разобщения сотрудников по отдельным рабочим местам для предотвращения скопления персонала в одном помещении, руководством лаборатории при поддержке руководства Росздравнадзора принято решение о необходимости оборудования дополнительного помещения для постановки ИФА-тестирования. Благодаря усилиям, приложенным руководством Росздравнадзора, данную задачу удалось оперативно решить.
Во вновь выделенном помещении была организована аналитическая линия, позволяющая проводить еще два параллельных анализа, что суммарно увеличило пропускную способность лаборатории до 10 серий в день.
Для работы на данном участке в штат лаборатории были введены четыре дополнительные единицы квалифицированных специалистов.
Все предпринятые меры позволили Московской лаборатории успешно противостоять вызовам пандемии COVID-19. За 2020 год среди квалифицированных специалистов лаборатории было зафиксировано всего четыре изолированных случая заболевания, которые не привели к распространению инфекции среди персонала лаборатории.
Выпуск в обращение вакцин против коронавирусной инфекции, а также тестирование препаратов, поступающих в Российскую Федерацию в рамках упрощенного режима, установленного Федеральным законом от 16.12.2019 № 441-ФЗ «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях», в течение второго полугодия 2020 года и в текущем периоде 2021 года, осуществлялись без сбоев (табл. 3).


Благодаря предпринятым мерам весь заявленный к испытаниям объем лекарственных препаратов, применяемых для лечения и профилактики новой коронавирусной инфекции, был успешно проанализирован в установленные сроки, что позволило ФГБУ «ИМЦЭУАОСМП» решить поставленную задачу.
_______________________________________________________________________
1 Постановление Правительства РФ от 31.01.2020 № 66 «О внесении изменения в перечень заболеваний, представляющих опасность для окружающих». URL: http://government.ru/docs/all/126028/
2 Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (утв. Министерством здравоохранения РФ 07.05.2021). URL: https://base.garant.ru/400738625/
3 Государственный реестр лекарственных средств Российской Федерации. URL: https://grls.rosminzdrav.ru/
4 Пункты 4.2, 4.4 Правил.
