QUALITY AND SAFETY CONTROL OF MEDICINES
Application of a risk-based approach in the verification and implementation in practice of biological methods for research of immunobiological drugs
1 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0002-9667-1014
2 — Federal state budgetary institution “Information center for expertise, accounting and analysis of circulation of medical products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
The article is devoted to the experience of implementing the risk-oriented approach in the verification of the method “Specific activity (immunogenicity)” for biological agents – immunobiological drugs (vaccines). To develop an approach to the verification of the methodology, ILAC policies (on uncertainty assessment, decision rule) were used. The use of a risk-based approach helped to improve the quality of research results and their information content without attracting additional human, time and material resources.
Keywords: risk-oriented approach, Moscow Laboratory for Quality Control of Medicines, verification, uncertainty estimate, model variability estimation, confidence interval, specific risk assessment, risk matrix
Background.
Московская лаборатория контроля качества лекарственных средств (далее – МЛККЛС) является частью филиальной сети испытательных центров ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора (далее – ИМЦЭУАОСМП) и функционирует в соответствии с Распоряжением Правительства РФ от 17.01.2005 № 32-р.
МЛККЛС аккредитована в национальной системе аккредитации, что является обязательным требованием для функционирования в рамках процедуры вывода лекарственных средств в гражданский оборот в соответствии с требованиями ст. 52.1 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
Учитывая требования ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий», а также необходимость применения гармонизированного подхода к контролю качества лекарственных средств, соответствующего мировым и наднациональным рекомендациям, подтверждение соответствия МЛККЛС критериям аккредитации подразумевает строгое соблюдение требований ГОСТ ISO/IEC 17025-2019, в том числе в части, касающейся верификации аналитических методик.
Многообразие лекарственных средств и связанные с этим различия в дизайне отдельных аналитических методик, особенности пробоподготовки или оценки результатов, использование различной реактивной и аналитической базы при реализации одного и того же метода применительно к разным объектам, накладывают определенные ограничения на возможность применения прямых рекомендаций ГОСТ ISO/IEC 17025-2019 в отношении всех испытуемых объектов.
В целях разрешения данного противоречия и реализации требований ГОСТ ISO/IEC 17025-2019 для верификации аналитических методик необходимо использовать риск-ориентированный подход. Он позволит провести систематизацию и установить обоснованные критерии для выбора объекта-представителя, который, в свою очередь, поможет адекватно отразить требования к полной оценке выбранной методики.
Для разработки подхода к верификации методики «Специфическая активность (иммуногенность)» для биологических агентов были использованы политики ILAC1 по оценке неопределенности, а также правилу принятия решения.
Процедура перехода к риск-ориентированному подходу
Переход к риск-ориентированному подходу предполагал разделение процедуры верификации на три этапа:
- Верификация путем теоретической оценки соответствия установленным требованиям: проверка наличия необходимых человеческих, временных, а также материальных ресурсов, таких как лабораторные животные, стандартные образцы, реактивы, материалы, оборудование и помещения; подготовка к эксперименту; подтверждение того, что все необходимые требования соблюдены (параметры окружающей среды, состояние животных).
- Верификация путем апробации: выполнение испытаний с использованием стандартного образца и испытуемого объекта с получением результата и использованием его для формирования заключения о соответствии по правилу принятия решения, основанному на простой приемке.
- Верификация путем расчета метрологических характеристик: данная верификация является также валидацией. Накопление информации об испытаниях стандартного образца и исследуемых объектах, получение информации о вариативности системы, расчет метрологических характеристик методики исследований по имеющимся результатам без проведения дополнительных экспериментов с участием лабораторных животных.
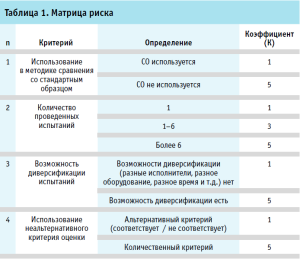
Для реализации риск-ориентированного подхода в лаборатории необходимо выбрать объект испытаний, соответствующий следующим требованиям:
- образец в соответствии с методикой как можно чаще испытывается одновременно со стандартным образцом (в лучшем случае – каждый раз);
- для наиболее полного оценивания характеристики неопределенности необходимо как можно большее количество данных результатов испытаний стандартного образца;
- испытания должны проводиться в одних и тех же условиях, но в разное время и разными испытателями, что позволит получить более полную информацию о вариативности результата в лаборатории;
- определяемый показатель должен характеризоваться числовым значением результата испытаний.
Для формализации процесса принятия решения в соответствии с требованиями к применению риск-ориентированного подхода была предложена матрица риска, в которой вышеприведенные критерии были сопоставлены с соответствующими числовыми значениями (табл. 1).
Индекс риска (X) рассчитывается по формуле:
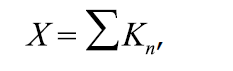
,
где Kn – количество проведенных испытаний.
Для последующего использования аналитического метода при верификации выбирается объект с максимальным значением индекса риска.
Для реализации риск-ориентированного подхода был выбран соответствующий всем условиям объект – иммунобиологический лекарственный препарат «Вакцина антирабическая культуральная концентрированная очищенная инактивированная сухая, лиофилизат для приготовления раствора для внутримышечного введения». Для расчетов были использованы результаты 27 испытаний стандартного образца, которые были получены в лаборатории в течении года.
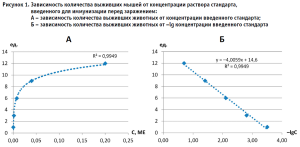
Методика испытаний заключается в иммунизации растворами образца и стандарта разных концентраций 0,20; 0,04; 0,008; 0,0016; 0,00032 МЕ2 /мл разных групп мышей линии BALB/C в возрасте 4–6 недель массой 12–14 граммов без различия пола в количестве 15 особей в группе. Мышей иммунизируют внутрибрюшинно по 0,5 мл двукратно с интервалом 7 суток. В качестве тест-штамма использовали штамм CVS3 фиксированного вируса бешенства. Через 7 суток после второй иммунизации мышам вводят разрешающую дозу тест-штамма CVS в мозг. После заражения регистрируют количество павших с 5 по 14 сутки животных, а также количество выживших. Мыши, павшие в течении первых пяти суток, считаются павшими по травматическим причинам и в опыте не учитываются. Наблюдается логарифмическая зависимость количества выживших мышей от концентрации раствора стандарта, введенного для иммунизации перед заражением (рис. 1).
По результатам всех проведенных испытаний стандарта наблюдалось нормальное их распределение, подтвержденное равенством среднего и медианы выборок, что указывает на отсутствие систематической ошибки и достаточное число испытаний для оценки метрологических характеристик.
Характеристика неопределенности, рассчитанная на самом высоком уровне концентрации раствора стандарта, вызывающей максимальную иммунизацию, характеризует рабочий диапазон определяемых величин, в том числе вблизи границ допуска по нормативному документу, и составляет ±4,2%.
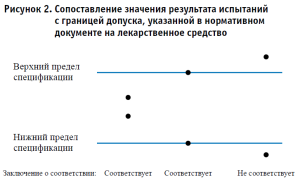
В лаборатории используется правило принятия решения, основанное на принципе простой приемки – сопоставлении значения результата испытаний с границей допуска, указанной в нормативном документе на лекарственное средство. После этого принимается решение и выдается заключение о соответствии или несоответствии. Значение характеристики неопределенности по этому правилу принятия решения не учитывается. Это несет в себе определенные риски: признать несоответствующий объект испытаний соответствующим, однако риск оценен и достигает 50% специфического риска, когда результат испытания оказывается на границе допуска (рис. 2).
С помощью риск-ориентированного подхода к оценке результатов испытаний мы можем осуществлять воздействие на риск путем введения защитной полосы, которая представляет собой более строгие границы допуска, чем указанные в нормативном документе на испытуемый объект (более строгие границы предела спецификации), измененные на величину характеристики неопределенности (или характеристики неопределенности, умноженной на коэффициент) (рис. 3).
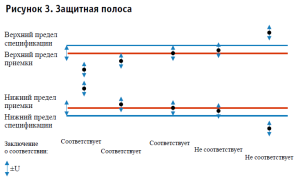
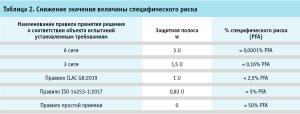
Представленное на рисунке 3 значение «±U» – характеристика неопределенности, которая обозначает доверительный интервал (Р = 95%); при введении защитной полосы, равной значению характеристики неопределенности (в данном случае ±4,2%), значение специфического риска снижается с 50 до 2,5%;
Варьируя шириной защитной полосы можно снижать значение величины специфического риска вплоть до 0,0001%, что позволяет учитывать особенности задачи, характеристик объекта, а также метода испытаний в каждом конкретном случае индивидуально (табл. 2). При этом воздействие на риск также может осуществляться путем сбора дополнительных данных и уточнения границ доверительного интервала.
Выводы
Продемонстрировано применение практического подхода, одновременно учитывающего требования ГОСТ ISO/ IEC 17025-2019, ILAC-G17:01/2021 Руководящие принципы ILAC по неопределенности измерений при испытаниях, а также Концепции 3R [reduction, refinement and replace] – сокращение, усовершенствование и замена по отношению к экспериментальным лабораторным животным.
Все результаты испытаний использованы для оценки соответствия объектов установленным в нормативной документации требованиям, для расчета метрологических характеристик, для оценки специфического риска и воздействия на риск. Не потребовалось проведения дополнительных исследований, тем самым снижено число лабораторных животных, участвующих в экспериментах, с сохранением достаточного их количества для обеспечения использования адекватной модели.
Качество результатов исследований и их информативность повышены путем перехода к риск-ориентированному подходу без привлечения дополнительных человеческих, временных и материальных ресурсов.
Ограничения
Данный практический подход позволяет оценить вариативность модели, доверительный интервал и специфический риск только по отношению к действительной используемой системе. При переходе к иному стандартному образцу, при внесении изменений в методику испытаний, даже незначительных, а также при использовании другой линии лабораторных животных процесс сбора информации необходимо начать с начала.
Полученная информация характеризует вариативность, неопределенность и риск только в данной лаборатории и имеет отношение только к данной методике.
_______________________________________________________________________
1 ILAC (аббр. от англ. International Laboratory Accreditation Cooperation) – международная организация по аккредитации лабораторий.
2 Международных единиц.
3 Challenge Virus Standard.
- ILAC-G8:09/2019 Guidelines on decision rules and statements of conformity. Руководящие указания по правилам принятия решений и заявлениям о соответствии.
- ILAC-G17:01/2021 ILAC Guidelines for Measurement Uncertainty in Testing Руководящие принципы ILAC по неопределенности измерений при испытаниях.
- ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий» / General requirements for the competence of testing and calibration laboratories.
- ГОСТ 34100.3-2017/ISO/IEC Guide 98-3:2008 Неопределенность измерения. Часть 3. Руководство по выражению неопределенности измерения / Uncertainty of measurement. Part 3. Guide to the expression of uncertainty in measurement.
