PHARMACOVIGILANCE
Pharmacovigilance in medical organizations
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
2 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
This article provides an overview of the requirements in Russian Federation for provide information on monitoring the safety and effectiveness of medicines from healthcare professionals (doctors, paramedics, nurses, pharmacists). The article presents the requirements of the legislation, a review of the practice of Roszdravnadzor's inspection of medical organizations for pharmacovigilance processes organization, an analysis of regions number adverse drug reactions, the measures planned by Roszdravnadzor to increase the collection of adverse drug reactions.
Keywords: pharmacovigilance, safety of drug therapy, medicines, Russian Federation requirements, spontaneous reporting system, reports of adverse drug reactions
Background.
Представление о современной фармакотерапии невозможно без учета проблем безопасности и эффективности применения лекарственных средств. Инновации в области фармакологии, появление новых, более эффективных лекарственных препаратов, с одной стороны, предоставили врачу широкий спектр фармакологических инструментов. С другой стороны, каждый такой инструмент – лекарственный препарат – обладает побочными действиями, противопоказаниями и ограничениями к применению. Увеличивающееся с каждым годом количество наименований лекарственных препаратов, которые стали общедоступны благодаря достижениям современной фармакологии, а также необоснованное их назначение порождает проблему полипрагмазии и бесконтрольного потребления лекарств.
Выявление и минимизация подобных рисков фармакотерапии является основным направлением деятельности систем фармаконадзора всех стран мира. В Российской Федерации уполномоченным органом по организации и проведению фармаконадзора выступает Росздравнадзор1. Отдел организации фармаконадзора Управления организации государственного контроля качества медицинской продукции Росздравнадзора и подведомственный Центр фармаконадзора ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения2 выступают основными акторами данного процесса со стороны регуляторного органа Российской Федерации, осуществляя непрерывный мониторинг безопасности и эффективности всех лекарственных препаратов на территории Российской Федерации, а также лекарственных средств, находящихся на этапе клинических исследований, проводимых на территории Российской Федерации.
Основным методом мониторинга безопасности и эффективности лекарственных препаратов во всех странах, включая Российскую Федерацию, является метод спонтанных сообщений3. Данный метод основывается на получении от работников здравоохранения информации о нежелательных реакциях или отсутствии терапевтического эффекта лекарственных препаратов4. Поддержание работы метода спонтанных сообщений заключается в законодательных требованиях к репортированию субъектами обращения лекарственных средств, включая специалистов в области здравоохранения, извещений о нежелательных реакциях или отсутствии терапевтического эффекта лекарственного препарата.
Требования законодательства Российской Федерации к субъектам обращения лекарственных средств
В Российской Федерации пунктом 3 статьи 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» в обязанность субъектов обращения лекарственных средств вменяется сообщение в порядке, установленном уполномоченным федеральным органом исполнительной власти, о побочных действиях, нежелательных реакциях (в том числе серьезных и непредвиденных) при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека либо животного при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов в Российской Федерации и других государствах. Порядок направления данной информации установлен приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора».
Для специалистов в области здравоохранения, к которым относятся врачи и другой медицинский персонал, который может наблюдать нежелательную реакцию, установлены требования к сообщению «особых» нежелательных реакций. Абсолютно все нежелательные реакции сообщать не имеет смысла, это усложнит работу как специалистов в области здравоохранения, так и регуляторного органа.
Пунктами 35–37 приказа Росздравнадзора от 15.02.2017 № 1071 обозначены требования, которым должна соответствовать информация, обязательная для направления в Росздравнадзор. Необходимо сообщать:
1) о летальных или непосредственно угрожающих жизни нежелательных реакциях – в течение 3 рабочих дней;
2) серьезных нежелательных реакциях (приведших к аномалиям или порокам развития, потребовавших госпитализации или ее продления, приведших к стойкой утрате работоспособности или инвалидности) – в течение 15 календарных дней;
3) случаях отсутствия заявленной эффективности лекарственных препаратов, применяемых при заболеваниях, представляющих угрозу для жизни человека, вакцин для профилактики инфекционных заболеваний, лекарственных препаратов для предотвращения беременности, когда отсутствие клинического эффекта не вызвано индивидуальными особенностями пациента и (или) спецификой его заболевания – в течение 15 календарных дней;
4) нежелательных реакциях, возникших вследствие злоупотребления препаратом, в случаях умышленной передозировки лекарственного препарата, при воздействии, связанном с профессиональной деятельностью, или в случаях использования лекарственного препарата в целях умышленного причинения вреда жизни и здоровью человека – в течение 15 календарных дней;
5) случаях индивидуальной непереносимости лекарственных средств, явившихся основанием для выписки лекарственных препаратов по торговому наименованию в рамках программ льготного лекарственного обеспечения – в течение 15 календарных дней.
Оптимизация работы Росздравнадзора по мониторингу безопасности и эффективности лекарственных препаратов
Для оптимизации работы и оперативности приема информации Росздравнадзором разработана национальная база данных «Фармаконадзор 2.0» Автоматизированной информационной системы Росздравнадзора, доступ в которую может получить любая организация5. В качестве резервного канала связи для получения информации о нежелательных реакциях работает электронная почта NPR@roszdravnadzor.ru.
Контрольно-надзорные мероприятия Росздравнадзора по проверке систем фармаконадзора в медицинских организациях
В целях неукоснительного исполнения медицинскими организациями требований к фармаконадзору, установленных пунктом 3 статьи 64 Федерального закона от 12.04.2010 №61-ФЗ и Порядком осуществления фармаконадзора, утвержденным приказом Росздравнадзора от 15.02.2017 №1071, Росздравнадзор письмом от 17.02.2020 № 02И-313/20 направил органам управления здравоохранением субъектов Российской Федерации Критерии оценки работы медицинских организаций по фармаконадзору:
- Знание сотрудниками медицинской организации законодательства в сфере мониторинга безопасности лекарственных средств (Федеральный закон от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств» и приказ Росздравнадзора от 15.02.2017 №1071 «Об утверждении порядка осуществления фармаконадзора»).
- Наличие внутренних приказов, регламентирующих порядок регистрации и сбора информации о нежелательных реакциях в медицинской организации и передачу сведений о них в Росздравнадзор.
- Наличие специалистов, ответственных за сбор и направление информации о нежелательных реакциях и проблемах безопасности лекарственных препаратов в Росздравнадзор.
- Организация взаимодействия с территориальным органом Росздравнадзора. Организация информирования центрального аппарата Росздравнадзора или территориальных органов Росздравнадзора по субъектам Российской Федерации о летальных реакциях на лекарственные препараты в течение 3 рабочих дней с момента, когда произошла данная реакция.
- Наличие персонализированного доступа в базу данных «Фармаконадзор 2.0» Автоматизированной информационной системы Росздравнадзора (http:// external.roszdravnadzor.ru).
- Среднее число выявляемых нежелательных реакций, количество сообщений, направленных в Росздравнадзор.
- Наличие навыков заполнения извещений о нежелательной реакции на лекарственные препараты (в электронной форме или на бумажном носителе).
- Фиксация сведений о выявленных в медицинской организации нежелательных реакциях на лекарственные препараты в медицинской документации пациентов.
- Направление в течение 5 рабочих дней врачебными комиссиями извещений о случаях индивидуальной непереносимости, явившихся основанием для выписки лекарственных препаратов по торговым наименованиям.
- Обсуждение вопросов фармаконадзора на совещаниях, проводимых руководством медицинской организации (утренние конференции, планерки).
- Консультирование медицинского персонала, проведение совещаний, учебных семинаров, направленных на повышение сообщаемости и качества сообщений о нежелательных реакциях при применении лекарственных препаратов.
Указанные критерии были разработаны Росздравнадзором для упрощения внедрения системы фармаконадзора в практику работы медицинской организации, их основная цель – своевременное обнаружение нежелательной реакции, качественный сбор всей необходимой информации и ее своевременное направление в Росздравнадзор.
В случае обнаружения фактов непредоставления требуемой информации в Росздравнадзор как по результатам контрольно-надзорных мероприятий, так и в результате анализа информации, содержащей сведения о возможных нежелательных реакциях (например, в средствах массовой информации, сети Интернет, обращениях граждан), Федеральная служба по надзору в сфере здравоохранения рассматривает вопрос о возбуждении дела об административном правонарушении на основании статьи 19.7.8 Кодекса об административных правонарушениях по факту нарушения требований приказа Росздравнадзора от 15.02.2017 № 1071, что может повлечь наложение штрафных санкций как на медицинскую организацию (до 70 тыс. рублей), так и на должностных лиц (до 15 тыс. рублей) за каждый обнаруженный случай несообщения нежелательной реакции в Росздравнадзор.
Причины недоведения до Росздравнадзора информации по безопасности фармакотерапии
Причины, по которым специалисты в области здравоохранения не сообщают информацию по фармаконадзору в Росздравнадзор, как в России, так и в других странах постоянно выявляются и изучаются. В данной области заместителем министра здравоохранения Российской Федерации С.В. Глаголевым проводился анализ причин несообщаемости информации о безопасности применения лекарственных препаратов, о чем было доложено на XI Всероссийском форуме «Здоровье нации – основа процветания России»6. Так, к препятствующим факторам отнесены:
- хорошо известная нежелательная реакция;
- недостаток времени;
- боязнь судебного преследования/административных санкций;
- сложное диагностирование нежелательной реакции;
- недостаток информации для направления сообщения;
- отсутствие интереса к фармаконадзору;
- сложные формы извещения о нежелательных реакциях;
- боязнь нарушить медицинскую тайну;
- отсутствие финансовых стимулов;
- желание самостоятельно опубликовать случай в медицинской или иной научной литературе.
В период пандемии COVID-19 ключевую роль играет фактор отсутствия времени у медицинских работников. Крайняя загруженность и ненормированный рабочий график, непрерывный поток пациентов повлияли на практику сообщаемости о нежелательных реакциях во всем мире, включая Россию. К этим факторам прибавилась проблема сложности заполнения извещения о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата при первом знакомстве с базой данных «Фармаконадзор 2.0». Эта сложность не случайна. Росздравнадзор в своей национальной базе данных «Фармаконадзор 2.0» использует международный формат ICH E2B (R3), который позволяет автоматически принимать сообщения из программных ресурсов по фармаконадзору отечественных и зарубежных разработок, поддерживать информационный обмен анонимизированными данными с ВОЗ в рамках программы международного мониторинга безопасности лекарственных средств.
Для целей оптимизации этого процесса сотрудниками подведомственной экспертной организации «Центр фармаконадзора ФГБУ “ИМЦЭУАОСМП”» Росздравнадзора готовится обучающий модуль по заполнению карты-извещения в базе данных «Фармаконадзор 2.0».
Сообщаемость о нежелательных реакциях при применении лекарственных препаратов по регионам Российской Федерации
Основным методом оценки сообщаемости является количество сообщений на 100 тыс. населения. По информации регуляторных агентств США и Великобритании, количество сообщений, ежегодно направляемых в регуляторные органы указанных стран, составляет 72 и 40 сообщений на 100 тыс. населения соответственно. В России средний показатель установлен на уровне 9 сообщений на 100 тыс. населения7. Следует отметить, что в нашей стране сообщаемость о нежелательных реакциях варьируется от региона к региону. Авторами статьи проведен анализ сообщаемости по регионам (табл.).
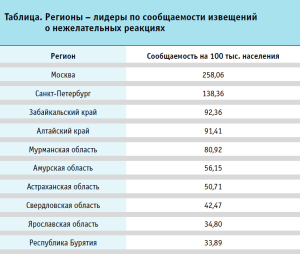
Минимальный показатель наблюдался в следующих субъектах РФ: Тюменская область, Магаданская область, Республика Адыгея, Тверская область, Республика Ингушетия, Республика Калмыкия, Кабардино-Балкарская Республика, Чеченская Республика, Республика Дагестан, Республика Северная Осетия-Алания (показатель варьировался от 0,14 до 2,33). Из Ненецкого и Чукотского автономных округов сообщений за 2020 г. не поступало.
Данные цифровые показатели помогают специалистам Росздравнадзора выявлять проблемные регионы, брать их на контроль и организовывать необходимые образовательные мероприятия по налаживанию системы безопасности фармакотерапии.
Conclusion.
Росздравнадзор как контрольно-надзорный орган обязан требовать строгого соблюдения законодательства, однако в настоящее время в вопросах фармаконадзора и сообщаемости информации о нежелательных реакциях на первое место выходят именно образовательные мероприятия и разъяснения необходимости сбора и передачи такой информации в регуляторный орган в целях безопасности фармакотерапии. По этой причине Росздравнадзором уделяется особое внимание как отдельным образовательным мероприятиям, так и освещению тематики на конференциях, подготовке видеолекций, печатных материалов, развитию и наполнению официального сайта Росздравнадзора. Ведомство активно взаимодействует с регионами низкой сообщаемости для организации работы по фармаконадзору и предоставлению необходимых образовательных мероприятий.
Безопасность пациентов – приоритет Росздравнадзора. Коллектив авторов благодарит всех специалистов, направляющих информацию по безопасности лекарственных препаратов в Федеральную службу по надзору в сфере здравоохранения. Каждое сообщение вносит весомый вклад в оценку пользы и риска лекарственных препаратов и в обеспечение безопасности фармакотерапии в целом.
_______________________________________________________________________
1 Постановление Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения».
2 URL: https://www.fgu.ru/about/struktura/ дата обращения: 27.04.2021.
3 International Drug Monitoring: The Role of National Centres (WHO Technical Report Series No. 498). Geneva: World Health Organization, 1972.
4 Стуров Н.В. Сравнительный анализ эффективности методов выявления неблагоприятных побочных реакций на лекарственные средства в российской федерации в современных условиях. Автореф. дисс. на соискание ученой степени канд. мед. наук. Москва, 2009.
5 URL: http://external.roszdravnadzor.ru.
6 Глаголев С.В. «Фармаконадзор в Российской Федерации на современном этапе». XI Всероссийский форум «Здоровье нации – основа процветания России».
7 «Росздравнадзор: выросшее число сообщений о нежелательных реакциях при применении лекарств говорит о развитии национальной системы фармаконадзора». URL: https://roszdravnadzor.gov.ru/news/266. Дата обращения: 01.05.2021.
