DRUG PROVISION
A risk-based approach to drug traceability in medical organizations
1 — Federal State Budgetary Educational Institution of Higher Education Yaroslavl State Medical University of the Ministry of Health of the Russian Federation, 5 Revolutsionnaya str., Yaroslavl, 150000, Russian Federation.
sova293@yandex.ru
ORCID: https://orcid.org/0000-0001-9110-446X
2 — State Budgetary Healthcare Institution of the Yaroslavl Region “Clinical Hospital No. 2”, 39 Suzdalskoe Shosse, Yaroslavl, 150030, Russian Federation.
isaeva.ilona1988@mail.ru
ORCID: https://orcid.org/0000-0002-1053-7317
3 — Federal State Budgetary Educational Institution of Higher Education Yaroslavl State Medical University of the Ministry of Health of the Russian Federation, 5 Revolutsionnaya str., Yaroslavl, 150000, Russian Federation.; Territorial Compulsory Medical Insurance Fund of the Yaroslavl Region, 11/9 Sovetskaya str., Yaroslavl, 150000, Russian Federation.
zamiralova@yartfoms.ru
4 — Federal State Budgetary Educational Institution of Higher Education Yaroslavl State Medical University of the Ministry of Health of the Russian Federation, 5 Revolutsionnaya str., Yaroslavl, 150000, Russian Federation.
sokolovaks89@mail.ru
ORCID: https://orcid.org/0009-0008-9110-6180
The introduction of a system of digital labeling and traceability of medicines allows for full control over their movement, which helps prevent illicit trafficking, optimize financial costs and improve patient safety. An analysis of international experience has shown that labeling approaches vary depending on the specifics of national markets, but Russia and the EAEU implement similar technologies that ensure the free movement of high-quality and safe medicines. Experts have identified the following risks: external (LP quality, suppliers) and internal (digital literacy, system synchronization, documentation errors). Organizational and technological solutions are proposed: development of digital competencies of specialists, integration of information systems.
Keywords: turnover of medicines in a medical organization, labeling of medicines, the Eurasian Economic Union (EAEU), digital labeling and traceability systems, traceability technologies, accounting for the turnover of medicines, pharmacy of a medical organization, electronic document management, risk-based approach, personalization of medical care
Background.
В современном российском обществе возможность сохранения и восстановления здоровья с помощью лекарственного обеспечения является важным параметром качества жизни индивидов, социальных групп, социума [1].
На выявление возможных проблемных ситуаций, оказывающих влияние на безопасность и качество лекарственной помощи, направлен риск-ориентированный подход, своевременно предотвращающий либо устраняющий возникающие риски.
Формирование цифрового поля здравоохранения путем интеграции государственных информационных систем с региональными и локальными информационными сегментами здравоохранения позволит прослеживать весь процесс лекарственного обеспечения в медицинской организации: от проверки адекватности назначения ЛП в соответствии с клиническими рекомендациями до оценки остатков ЛП как в аптеке, так и других структурных подразделениях медицинской организации (МО) [2].
Одним из инструментов обеспечения безопасности и качества ЛП, а значит предотвращения рисков при обороте ЛП, является система мониторинга ЛП. Основными элементами мониторинга является проверка достоверности средств идентификации и прослеживаемость движения ЛП. Так, каждая упаковка ЛП имеет уникальный идентификационный номер, который позволяет отслеживать его происхождение и подлинность [3]. Также система обеспечивает возможность отслеживания пути каждого ЛП от производителя лекарственных средств до конечного потребителя, включая регистрацию всех этапов обращения ЛП – производство, хранение, транспортировку и реализацию. Данная система поддерживается на законодательном уровне, устанавливая требования маркировке, а также определяя ответственность производителей, дистрибьюторов и аптечных организаций за соблюдение правил оборота ЛП [4].
Цель исследования
Совершенствование процесса прослеживаемости лекарственных препаратов при оказании лекарственной помощи пациентам в медицинских организациях для снижения рисков. Задачами исследования явилось изучение вопросов, связанных с развитием прослеживаемости и маркировки товаров за рубежом и в Российской Федерации (РФ). Обоснование положительных характеристик прослеживаемости упаковок ЛП, способствующих удовлетворению потребителей ЛП, структурирование преимуществ прослеживаемости ЛП. Выявление перечня рисков при обороте лекарственных препаратов в медицинской организации на основе экспертных мнений.
Материалы и методы
Материалами послужили нормативная документация, отражающая прослеживаемость и маркировку ЛП, данные государственной системы маркировки и прослеживаемости товаров «Честный знак», товарно-учетные системы медицинских организаций (ТУС МО), анкеты экспертов.
Использовались методы систематизации, типологизации, логического и структурного анализа, экспертных оценок, контент-анализа нормативно-правовых актов и научных публикаций.
Для выявления рисков при обороте ЛП в МО проведена экспертная оценка. Экспертами выступили заведующие аптек медицинских организаций Ярославской области (11 человек с высшим фармацевтическим образованием, средний возраст 50±8,5 лет, из них 90,0% – женщины), непосредственно отвечающие за организацию и контроль всех этапов движения ЛП в МО – от поступления и хранения до отпуска и списания.
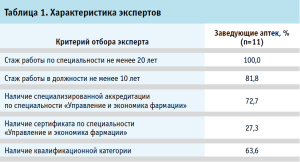
В таблице 1 представлены критерии отбора экспертов.
Для оценки степени согласованности между экспертами использовали коэффициент конкордации Кендалла (W) (1):
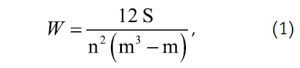
где:
S – сумма квадратов отклонений суммы рангов каждого объекта экспертизы от среднего арифметического рангов;
n – число экспертов;
m – число объектов экспертизы.
Величина коэффициента конкордации лежит в пределах от 0 до 1. Установлено, что эксперты согласованы во мнениях (W=0,74).
Результаты и обсуждение
Установлено, что потребность в контроле и отслеживании ЛС значима для всех участников оборота ЛП.
Проведен анализ литературных источников, посвященных маркировке ЛП средствами идентификации. Выявлены перспективы развития этого направления в России, а также рассмотрены системы отслеживания товаров в различных странах мира. Также в научных публикациях приводятся основные отличительные особенности маркировки ЛП на территории РФ по сравнению с системами маркировки других стран [5].
Обзор научной литературы выявил, что международный опыт маркировки ЛП в странах Евросоюза, Азии и Америки воспринят с большой осторожностью – от введения в действие до полного отказа. Так, в Китае отсутствуют жесткие правила для участников маркировки товаров. Маркировка просто практикуется в бизнесе, а производители лекарственных средств (ЛС) делают добровольные взносы на поддержание этого проекта. В США действуют несколько систем маркировки ЛП одновременно, конкурирующие между собой. В каждой стране есть свои особенности внутреннего рынка, что обусловлено разными подходами к формированию кодов маркировки и объема информации, заложенного в нем. По данным ВОЗ, имеется положительное значение маркировки ЛП, поскольку позволяет проследить все стадии жизненного цикла ЛП [6].
Также нами рассмотрен процесс маркировки ЛП в государствах – членах Евразийского экономического союза (ЕАЭС). Установлено, что государства – члены ЕАЭС технически готовы к внедрению маркировки лекарств и уже начали ее применять. Однако не все из них определили конкретные сроки для полного перехода на эту практику.
В России маркировка лекарств начала внедряться в 2017 году и уже показала свою эффективность. Этот опыт успешно применяют в рамках межгосударственного взаимодействия стран ЕАЭС. Совершенствование системы цифровой маркировки и прослеживаемости товаров проводится на основе сравнительного анализа обязательных атрибутов ЛП [9], выделяются проблемы использования маркировки, предлагаются направления ее улучшения и развития в целях повышения экономической безопасности посредством развития системы прослеживаемости в ЕАЭС [7, 8, 9, 10].
На основе взаимосвязи участников товаропроводящей цепочки обеспечивается прослеживаемость всех товарных групп. Формирование бизнес-процессов и технологий цифровой маркировки и прослеживаемости отрабатывается производителями, дистрибьюторами, фармацевтическими и медицинскими организациями, включая оператора системы ЦРПТ (Честный знак). Особое внимание уделяется общественному контролю через мобильные приложения на всех этапах движения лекарственных препаратов. Цифровой код маркировки обеспечивает единое решение для всех товарных групп. Его сложно подделать, а информацию о товаре невозможно удалить из системы. [11].
Сегодня в России и странах ЕАЭС используются одинаковые процессы и технологии цифровой маркировки. Это позволяет без проблем перемещать качественные и безопасные товары через границы государств.
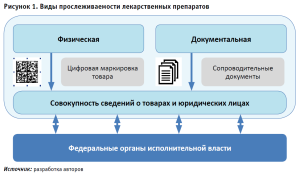
На современном этапе законодательство РФ активно поддерживает внедрение технологий прослеживаемости как комплекса мероприятий, обеспечивающих регистрацию движения товаров по товаропроводящей сети с момента нанесения средства идентификации или контрольного (идентификационного) знака, а также автоматизированное предоставление юридически значимых сведений о совершенных операциях с единицей товара и их обработку в ГИС [12]. На рисунке 1 представлены виды прослеживаемости ЛП. Введенные в гражданский оборот ЛП имеют прослеживаемость, физически выраженную в коде DataMatrix на упаковке и документально подтвержденную сопроводительными документами в электронном виде или на бумажном носителе.
На основе анализа нормативно-правовых актов выявлены и охарактеризованы ряд преимуществ прослеживаемости ЛП, способствующие повышению уровня здравоохранения и защите прав потребителей. Анализ нормативно-правовых актов [4, 13, 14] позволил классифицировать преимущества прослеживаемости ЛП по признаку социальной структуры общества – индивида и совокупности людей, объединенной едиными признаками (табл. 2).
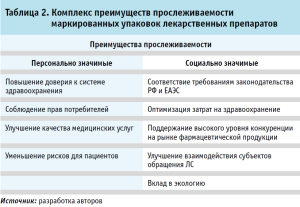
Нами были выделены две группы – персонально значимые и социально значимые, структурированные в зависимости от персональной безопасности пациента и улучшения общественного здоровья. Следовательно, прослеживаемость ЛП позволяет вести учет оборота лекарственных средств не только для целей и задач государства, но и персонализации лекарственной помощи пациентов.
Важно учитывать аспекты, которые минимизируют риски, при сохранении преимуществ системы прослеживаемости. Эксперты выделяют риски при обороте лекарств в медицинских организациях, разделяя их на внешние и внутренние, в зависимости от этапа оборота. Внешние риски связаны с поставщиком лекарств и их качеством, которое определяется производителем, Росздравнадзором и другими органами. Внутренние риски включают бизнес-процессы аптеки и структурных подразделений медицинской организации, а также компетенции специалистов.
В таблице 3 представлен анализ рисков.

Представленный перечень рисков, как внешних, так и внутренних, указывает, что нарушения условий хранения и транспортирования ЛП приводят к потере качества, сохранности ЛП; ошибки в сопроводительной документации и/ или невыполнение обязательств поставки – к срывам поставок, искажениям сроков годности. Учет движения ЛП осуществляется на базе цифровых платформ с соответствующим программным обеспечением на соответствующих технологических устройствах. Все бизнес-процессы сопровождаются фармацевтическими и медицинскими специалистами с определенными цифровыми знаниями. Низкая цифровая грамотность специалистов и отсутствие синхронизации между программами для целей мониторинга ЛП по различным параметрам приводит к появлению дельты между внешними данными цифровой маркировки и внутренними данными ТУС. Своевременный мониторинг рисков обеспечивает качество услуг.
Совершенствование прослеживаемости ЛП в медицинской организации возможно на основе выявленных рисков путем разработки комплекса организационных и технологических решений.
В настоящее время выбытие ЛП определено для МО на этапе оказания медицинской помощи законодательно. Однако в практической деятельности это выполняется частично, поскольку для МО с одним местом деятельности аптеки и структурного подразделения паспорт бизнес-процесса выбытия ЛП не сформирован [15]. Схема прослеживаемости ЛП в МО представлена на рисунке 2.
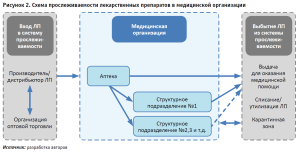
Функционал ТУС МО позволяет оперативно получать полные статистические данные о движении упаковок ЛП. В связи с этим, нами предложена база данных (БД) для ТУС МО «Рекомендации по управлению движением упаковок лекарственных препаратов в медицинской организации с одним местом деятельности» для целей прослеживаемости каждой упаковки ЛП в структурных подразделениях [16].
В результате внедрения БД возможен контроль за всеми бизнес-процессами, включая выдачу ЛП для оказания медицинской помощи, регулирование объема товарных запасов, хранение ЛП, отслеживание сроков годности ЛП как в аптеке МО, так и в структурных подразделениях.
Выводы
Риск-ориентированный подход к прослеживаемости лекарственных препаратов в медицинских организациях непосредственно влияет на безопасность лечения и поддержание общественного здоровья в целом. Выявленные риски при обороте лекарственных препаратов в медицинской организации позволяют разработать предложения по совершенствованию прослеживаемости ЛП в медицинских организациях, сформировать базу локальных нормативно-правовых документов (положения, приказы, стандартные операционные процедуры), организовать образовательные мероприятия для специалистов здравоохранения.
Принятие организационных решений позволяет повысить ответственность фармацевтических и медицинских работников, осуществляющих внесение информации в систему мониторинга движения ЛП, а также повысить удовлетворенность пациентов лекарственной помощью. Реализация технологических решений актуализирует оснащенность рабочих мест фармацевтических и медицинских работников, предотвращает незаконный оборот ЛП, оптимизирует финансовые расходы на лекарственное обеспечение.
Следовательно, комплексный подход к прослеживаемости ЛП снижает риски неблагоприятных последствий применения ЛП у пациентов во время лечения.
- Melnikova O.A., Smirnov A.V., Marchenko S.D., Melnikov M.Yu. Model of a risk-based approach in the implementation of pharmaceutical activities // Farmatsiya. – 2022. – No. 2. P. 41–48. (In Russian).
- Kuznetsov P.P. On the system of medical information and analytical centers // Vrach i informacionny`e texnologii (Medical Doctor and Information Technologies). – 2004. –No. 6. – P. 14–19. (In Russian).
- Kotikov V.N., Petrosyants V.A. Implementation of the drug samples tracing system // Vedomosti Nauchnogo centra e`kspertizy` sredstv medicinskogo primeneniya. Regulyatorny`e issledovaniya i e`kspertiza lekarstvenny`x sredstv (The Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products). – 2015. – No. 3. – P. 28–31. (In Russian).
- Decree of the Government of the Russian Federation dated December 14, 2018 № 1556 “On Approval of the Regulation on the System for Monitoring the Movement of Drugs for Medical Use”. URL: https://base.garant.ru/72136156/ (In Russian).
- Pogodina, I.V., Goglova E.G. Product labeling in different countries of the world // Vestnik Vladimirskogo gosudarstvennogo universiteta imeni Aleksandra Grigor`evicha i Nikolaya Grigor`evicha Stoletovy`x. Seriya: Yuridicheskie nauki (Bulletin of Vladimir state university named after Alexander and Nikolay Stoletovs. «Law science» edition). – 2022. – No. 3(33). – P. 35–38. (In Russian).
- Denisova A.S., Kuznetsova A.A. Labeling of medicines: experience and problems of implementation, directions of digitalization // Rossijskij e`konomicheskij internet-zhurnal (Russian Economics online-journal). – 2023. – No. 1. (In Russian).
- Vasilyeva M.V., Vasilyeva M.A. The role of traceability technologies of commodity flows in ensuring the security of the state // Obrazovanie i pravo (Education and law). – 2021. – No. 8. – P. 124–130. (In Russian).
- Ivanitskaya A.E. Digital labeling of goods as a measure of economic security: prospects and risks // Problems of regional and global security in the modern world: Proceedings of the V All-Russian scientific and practical conference with international participation of teachers and students, Vladimir, April 25, 2023. – Vladimir: Kopiya-Service, 2023. – P. 35–41. (In Russian).
- Kovarda V.V., Laptev R.A., Timofeeva O.G. Prospects for increasing the level of economic security in the context of digitalization of economic processes through the development of a traceability system in the EAEU. // Vestnik evrazijskoj nauki (The Eurasian Scientific Journal). – 2020. – Vol. 12, No. 5. – P. 5. (In Russian).
- Laptev R.A., Kovarda V.V., Rogov R.A. The main directions of the development of the traceability system of goods as a factor in ensuring Russia's security in the context of the expansion of the globalization process // Vestnik evrazijskoj nauki (The Eurasian Scientific Journal). – 2020. – Vol. 12, No. 1. – P. 54. (In Russian).
- The Russian system for labeling and traceability of medicines is being developed // Menedzhment kachestva v medicine (Quality management in medicine). – 2019. – No. 2. – P. 26–29. (In Russian).
- Samoilova A.V., Kudryavtseva E.M. The Federal State Information System for monitoring the movement of Medicines for medical use is a digital tool in the field of control over the circulation of medicines. Vestnik Roszdravnadzora. 2022; 3: 6–15. (In Russian).
- Federal Law of the Russian Federation No. 61-FZ of April 12, 2010, “On the Circulation of Medicines”. URL: https://base.garant.ru/12174909/ (In Russian).
- Order of the Government of the Russian Federation of December 28, 2018 No. 2963-r “On Approval of the Concept for the Creation and Operation in the Russian Federation of a System for Labeling Goods with Means of Identification and Traceability of Goods Movement”. (In Russian).
- Sokolova O.V., Isaeva I.Yu., Lavrentyeva L.I., Kulikova O.A. Current issues of introducing drug labeling into information systems of a medical organization // Kardiovaskulyarnaya terapiya i profilaktika (Cardiovascular Therapy and Prevention). – 2023. – Vol. 22, No. S6. – P. 117. (In Russian).
- Certificate of state registration of the database No. 2023623905 Russian Federation. Recommendations for managing the movement of drug packages in a medical organization with one location: No. 2023623693: declared 02.11.2023: published 13.11.2023 / O.V. Sokolova, I.Yu. Isaev; applicant Federal State Budgetary Educational Institution of Higher Education “Yaroslavl State Medical University” of the Ministry of Health of the Russian Federation. (In Russian).
