DRUG PROVISION
Extended results of the study of activities in the field of pharmaceutical compounding in the Far Eastern Federal District
1 — The Federal State Budgetary Educational Institution of Higher Education «Pacific State Medical University» of the Ministry of Health of the Russian Federation (FSBEI VO TSMU of the Ministry of Health of Russia), 2, Ostryakova Ave., Vladivostok, 690002, Russian Federation.
ustinova.lubov@ustinov.com
ORCID: https://orcid.org/0000-0003-0977-7353
2 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation (SFFEI HE SPCPU of the Ministry of Healthcare of the Russian Federation), 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
dmitry.yurochkin@pharminnotech.com
ORCID: https://orcid.org/0000-0003-4609-0155
3 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation (SFFEI HE SPCPU of the Ministry of Healthcare of the Russian Federation), 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
sergey.erdny-garyaev@pharminnotech.com
ORCID: https://orcid.org/0000-0001-6297-9304
4 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation (SFFEI HE SPCPU of the Ministry of Healthcare of the Russian Federation), 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
cvetkova.elizaveta@spcpu.ru
The presented work for the first time details the results of monitoring the activities of medical and pharmacy organizations licensed for pharmaceutical activities with the right to compounded drugs for medical use, located in the territory of the Far Eastern Federal District. The number of operating compounding pharmacies has been clarified, and their territorial distribution across the constituent entities of the Russian Federation that are part of the district has been presented. A classification by organizational and legal forms has been implemented, and the number of pharmacies with the right to compound narcotic drugs and psychotropic substances has been determined. For the first time, the results of monitoring of the procurement of services for the production of medicines to for state and municipal needs of the district are presented, which can be expanded to 30 main and 92 auxiliary procurement parameters, which can have high practical significance for clarifying the development directions of new and existing pharmacies in the district. The obtained results specify the parameters of pharmaceutical activities and characterize infrastructure, technological, personnel issues, demand level for services (work) on the compounded of medicines and in-pharmacy packaging of registered medicines, the needs of pharmacies for pharmaceutical substances, including in “small” packaging, and also establish the nomenclature of registered medicines from which manufacturing is carried out.
Keywords: methods of personalized medicine, health saving technologies, pharmaceutical compounding, compounded drug, extemporaneous medicines, compounding and dispensing of medicines, stock preparation, in-pharmacy packaging of registered medicines in pharmacy organizations
Background.
Стратегия научно-технологического развития Российской Федерации, утвержденная Указом Президента РФ от 28.02.2024 № 145, в качестве одного из приоритетных направлений развития медицины устанавливает «переход к персонализированной, предиктивной и профилактической медицине, высокотехнологичному здравоохранению и технологиям здоровьесбережения, в т.ч. за счет рационального применения лекарственных препаратов (прежде всего антибактериальных) и использование генетических данных и технологий» [1]. Основу всеобъемлющего доступа к лекарственным препаратам для медицинского применения (далее – ЛП), применяемых в составе методов персонализированной медицины, составляет наличие возможностей для дальнейшего развития на базе медицинских, аптечных организаций (далее соответственно – МО, АО) и их обособленных подразделений. Широко известно, что производственные аптеки могут обеспечить необходимыми диапазонами дозировок, лекарственных форм и комбинаций действующих веществ по востребованной номенклатуре ЛП [2]. С учетом приказа Росстандарта от 09.04.2025 г. № 268-ст1, вступившего в силу с 1 июля 2025 г., такая фармацевтическая инфраструктура отнесена к «деятельности в сфере здравоохранения». Приоритеты системы лекарственного обеспечения определяют задачи по бесперебойному и своевременному доступу пациентов к необходимым видам терапии, в том числе персонифицированным, высокотехнологичным и новым методам лечения, вне зависимости от территориального признака по месту жительства гражданина и (или) месту его регистрационного учета. Современные фармацевтические практики требуют от аптечной инфраструктуры развития компетенций в области разработки, проведении испытаний, освоении, внедрении передовых и важнейших технологий изготовления ЛП [3, 4, 5].
Значительное количество работ российских ученых подтверждает высокую востребованность услуг (работ) аптечных организаций, имеющих лицензию на фармацевтическую деятельность с правом изготовления ЛП, с правом изготовления асептических ЛП, с правом изготовления радиофармацевтических ЛП (как структурное подразделение медицинской организации)2 (далее – производственные аптеки, ПА) [6, 7, 8, 9, 10, 11]. Однако, с одной стороны мы наблюдаем недостаточный объем сведений о текущей деятельности и состоянии действующих ПА, а с другой практически отсутствуют глубокие исследования об объемах спроса в государственном секторе фармацевтического рынка в рамках закупок услуг по изготовлению ЛП. Наличие таких сведений имеет важнейшее значение. Органы государственной власти, управления здравоохранением могли бы их применять при выработке комплексных решений при реализации полномочий в сфере обращения лекарственных средств (далее – ЛС), в том числе при формировании и реализации региональной государственной политики в области персонализированной, предиктивной и профилактической медицины, высокотехнологичного здравоохранения с применением современных подходов к лечению, новых видов лекарственной терапии, к которым всецело относятся лекарственные препараты аптечного изготовления (далее – ЛПАИ, экстемпоральные ЛП, ЭЛП). Также наличие таких исследований потенциально востребовано управленческим персоналом ПА в целях определения направлений развития инфраструктуры, ассортимента, формирования новых профессиональных связей с врачебным и пациентским сообществом, постановки научно-исследовательских задач для разработки технологий изготовления ЛП, методик контроля качества, включая экспресс-методы анализа, проведения испытаний стабильности, а также выстраивания новых кооперационных цепочек с поставщиками и производителями исходного сырья, материалов, оборудования. Таким образом, проведение системного анализа и выработка консолидированных сведений, структурированных и обработанных данных, характеризующих деятельность ПА, играет существенное значение для принятия взвешенных и сбалансированных решений, что определило актуальность настоящей работы.
Цель работы
Цель работы – определить и систематизировать показатели действующих производственных аптек на территории Дальневосточного федерального округа (далее – ДФО), выявить территориальные особенности функционирования фармацевтического рынка услуг по изготовлению ЛП и выработать перспективные задачи по направлениям развития данной области организации фармацевтического дела.
Материалы и методы
В работе были использованы открытые данные Единого реестра лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации (далее – РФ, Россия) в соответствии с переданным полномочием по лицензированию отдельных видов деятельности Росздравнадзора по состоянию на 10 июля 2024 года (далее – Реестр РЗН)3, открытые данные Единого реестра лицензий на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений, в том числе изготовлению ЛП из наркотических средств, психотропных веществ и их прекурсоров Росздравнадзора по состоянию на 12 ноября 2024 года (далее соответственно – НСиПВ, Реестр НСиПВ)4, результаты исследования социально-экономического положения за 4 квартал 2023 года Федеральной службы государственной статистики (Росстата) [12], результаты мониторинга ПА в РФ за 2023–2024 годы (далее – Мониторинг) [13, 14], полученные в ходе двух взаимосвязанных исследований, а также данные Единой информационной системы в сфере закупок (ЕИС закупки) по представленной информации о ЛС5.
В исследовании применен опросный метод в форме дистанционного анкетирования (как устного, так и письменного) по параметрам Мониторинга ПА в РФ за 2023–2024 годы, основу которого составила разработанная форма анкеты [13, 14], включающая в себя возможность формирования информации (данных) по 16 системным блокам. Период исследования данной части: 2021–2023 гг. В части анализа закупок услуг по изготовлению ЛП для обеспечения государственных и муниципальных нужд проведено кабинетное исследование (“ad hoc”). Изучению подлежали все установленные контракты посредством поиска по 41 ключевому слову и словосочетанию в рамках признака «предмет контракта», из которых только 23 были релевантными. Полученная информация была структурирована в базу данных. Дополнительно был проведен контроль поиска на критерий «достаточности» – реализована валидация полученных сведений о контрактах с применением оценки результативности запросов по ключевому словосочетанию «изготовлен* лекарств*» в рамках разделов исходного источника информации: «наименование заказа»; «наименование лота», «наименование товара», «характеристика товара». Экспериментальная часть проведена в период с 15 января 2025 года по 09 апреля 2025 года. Отметим ограничение методологии, которое было выражено в проведении экспресс-анализа – целенаправленно исключены «смешанные» контракты на оказание сразу нескольких услуг по контракту.
Results.
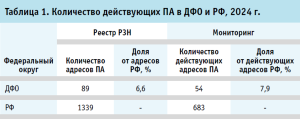
В соответствии с данными Реестра РЗН по состоянию на 10 июля 2024 года установлено, что в РФ по уникальным адресам осуществляет деятельность 138 166 аптек, среди которых 1339 относятся к ПА (0,97% от всех АО). По итогам Мониторинга ПА была достоверно подтверждена деятельность по изготовлению ЛП по 683 адресам (0,51% от всех АО) [14, 15].
По данным Реестра РЗН, на территории ДФО в 2024 году имели лицензию 89 ПА, из которых от 54 были получены достоверные данные о сохранении соответствующего вида фармацевтической деятельности (60,7% от всех ПА ДФО из Реестра РЗН) (табл. 1). Для остальных 35 ПА информация не была получена и в исследовании принята как «прекратившие деятельность». Показателен сравнительный анализ данных Реестра РЗН на июнь 2022 года, который возможно провести на основании ранее проведенного исследования Абросимовой Н. В. и Крюковой И. В. Определено, что на тот период в ДФО лицензиями на фармацевтическую деятельность с правом изготовления ЛП обладали 99 аптечных и медицинских организаций в основном государственной формы собственности, что составляло 5,7 % от общего количества лицензий на фармацевтическую деятельность [15]. То есть за последние два года количество ПА в округе сократилось – каждая десятая исключила данное право из состава лицензий.
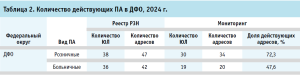
Согласно положениям приказа Минздрава России от 31.07.2020 № 780н, можно выделить два типа аптек: ПА, осуществляющие розничную торговлю (отпуск) ЛП населению (далее – розничные ПА) и ПА, действующие как структурные подразделения медицинских организаций (далее – больничные ПА). По данным Реестра РЗН, в ДФО среди розничных ПА деятельность осуществляют 38 ЮЛ по 47 адресам, а среди больничных – 36 ЮЛ по 42 адресам. Преобладает доля розничных ПА (51,4% по ЮЛ и 52,8% по адресам). Однако данные Мониторинга [14] свидетельствуют, что в ДФО сохранилась фактическая деятельность среди амбулаторных ПА по 34 адресам в составе 30 ЮЛ, а среди больничных ПА – по 20 адресам в составе 19 ЮЛ (табл. 2).
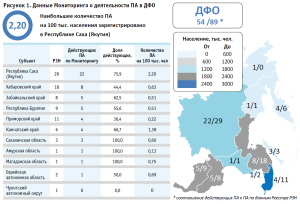
Наибольшее количество ПА среди субъектов ДФО осуществляет деятельность в Республике Саха (22 адресов). В первой тройке также Хабаровский край (восемь адресов), Забайкальский край и Республика Бурятия (по пять адресов). Существенный недостаток действующих ПА наблюдается в Приморском крае и в Амурской области. Установлено, что в Чукотском автономном округе отсутствуют действующие ПА (рис. 1). В этой части мы также отмечаем сопоставимость результатов, приведенных в работе по анализу обеспеченности населения ДФО ЛПАИ [15], где отмечается, что Республика Саха (Якутия), Забайкальский край, Камчатский край, Хабаровский край имеют доступность ЭЛП выше, чем в среднем по ДФО. Коллегами предложен анализ показателей «Количество населения на одну производственную аптеку» и «Количество больничных коек на одну производственную аптеку». В настоящем исследовании мы дополнительно представляем и актуализируем полученные результаты по показателю «Количество производственных аптек на 100 тыс. населения», который также используется в отчетах о социально-экономическом положении субъектов РФ, формируемых Росстатом.
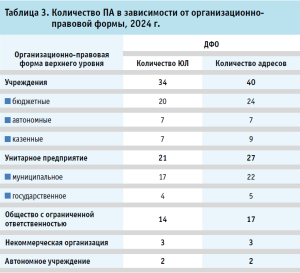
В таблице 3 представлены сведения Реестра РЗН по количеству ПА в зависимости от организационно-правовой формы, согласно которым (по адресам осуществления деятельности) к организациям в форме унитарных предприятий и учреждений относятся 67 ПА (75,3%). Следует отметить, что современная учебно-производственная аптека, созданная на базе Тихоокеанского государственного медицинского университета (г. Владивосток) в рамках проекта «Приоритет-2030», на момент написания текста исследования получила соответствующую лицензию и можно ожидать, что в ближайшее время на территории Приморского края существенно повысится доступность экстемпоральных ЛП для населения.
Согласно положению о лицензировании фармацевтической деятельности, с 1 сентября 2023 года изготовление радиофармацевтических ЛП выделено как отдельный вид работ и услуг6. По данным Мониторинга в России изготовление радиофармацевтических ЛП осуществляют 14 ПА, в ДФО расположена одна аптека в Хабаровском крае.
Согласно Единому реестру лицензий на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров (далее – НСиПВ, Реестр НСиПВ) и результатам Мониторинга была представлена таблица 4.
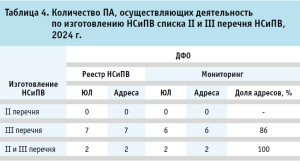
В ДФО доля ПА, состоящих в Реестре НСиПВ, составляет 10,1%, среди них в рамках мониторинга предоставили заполненные анкеты 14,8%. В ДФО ПА с лицензией НСиПВ действуют в пяти субъектах: Амурской области, Забайкальском крае, Камчатском крае, Республике Саха и Сахалинской области. Большинство действующих ПА, осуществляющих деятельность по изготовлению НСиПВ, приходится на розничные аптеки (семь адресов, 87,5%).
Важно подчеркнуть, что данная деятельность требует дополнительных расходов, а само по себе изготовление ЛП из НСиПВ списка II и III перечня НСиПВ на сегодняшний день является больше «уникальностью» и с точки зрения значимости для системы лекарственного обеспечения выступает одной из форм социальных функций, неся соответствующую дополнительную нагрузку на персонал, затраты при организации деятельности, что требует внедрения механизмов государственной поддержки (субсидий, компенсирующих затраты или целевых контрактов на оказание соответствующих услуг).
Данные Мониторинга позволяют выделить и представить углубленный анализ по 19 анкетам (полностью или частично заполненным), предоставленным соответствующим количеством ПА (по адресам для осуществления фармацевтической деятельности ПА) ДФО, из которых семь относится к розничным и 12 – к больничным аптекам.
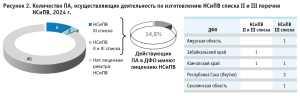
Распределение перечня оказываемых услуг (работ), составляющих фармацевтическую деятельность с правом изготовления и отпуска ЛП, показывает, что 10 (52,6 %) ПА ДФО имеют право осуществлять изготовление асептических ЛП.
Затрагивая вопрос структуры фармацевтических работников установлено, что в 19 ПА ДФО при изготовлении ЛП задействовано не менее 181 единицы в штатных расписаниях (табл. 5).

У семи из 19 производственных аптек (36,8%) наблюдается острый дефицит провизоров-аналитиков и (или) провизоров-технологов. Всего таких специалистов задействовано не менее 36 единиц в штатных расписаниях (19,9% от общего числа фармацевтических работников).
В частности, наибольший дефицит наблюдается по провизорам-технологам, отсутствие которых указало шесть респондентов. По нашей оценке, при осуществлении деятельности по изготовлению ЛП в ДФО задействовано порядка 520 фармацевтических работников (8,8% от всей РФ).
Рассматривая 19 полученных анкет в части объемов изготовленных единиц, по итогам 2023 года установлено, что общее количество единиц ЛПАИ в ДФО составило не менее 2 074 тыс. (рис. 3), из них:
- не менее 64 тыс. ед. отпущено по рецептам на ЛП, где расфасованных ФС, но отпускаемых в виде ЭЛП (однокомпонентные по составу), составляло не менее 23 тыс. единиц;
- 1853 тыс. ед. отпущено по требованиям МО, где расфасованных ФС, но отпускаемых в виде ЭЛП, составляло не менее 125 тыс. ед., а также расфасованных в условиях АО зарегистрированных ЛП – не менее 51 тыс. ед.
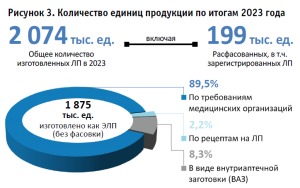
Одновременно общее количество изготовленных единиц ЛП в виде ВАЗ как по рецептам на ЛП, так и по требованиям МО, составило не менее 157 тыс. единиц при общем количестве не менее 4 842 серий.
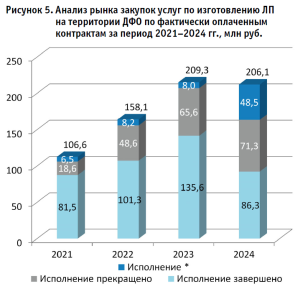
Анализ динамики рынка закупок услуг по изготовлению ЛП на территории ДФО7 свидетельствует об устойчивой тенденции к росту общего спроса на услуги по изготовлению ЛП, объема финансирования по заключенным контрактам с 112,2 млн руб. в 2021 году до 225,5 млн руб. по итогам 2024 г. При этом наиболее значительный прирост на 53% наблюдался в 2022 году, тогда как в 2024 году темпы роста резко замедлились до 0,4% (рис. 4).
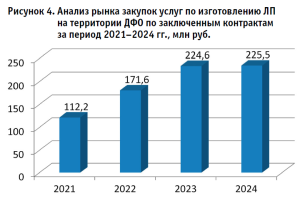
Такой рост мы можем связать с обсуждениями и подписанием уже реализованного законопроекта – вступлением в силу положений, принятых Федеральным законом от 05.12.2022 № 502-ФЗ8.
Анализ исполнения заключенных контрактов за рассматриваемый период свидетельствует, что среднее значение исполнения контрактов составляет 92,9% (рис. 5).
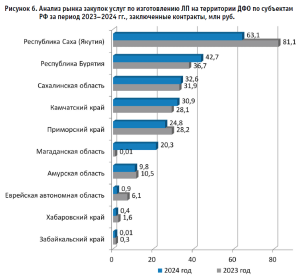
Сравнительный анализ 2023 и 2024 годов по объемам закупок услуг по изготовлению ЛП субъектами, входящими в состав ДФО, который выявляет существенную региональную дифференциацию (рис. 6).
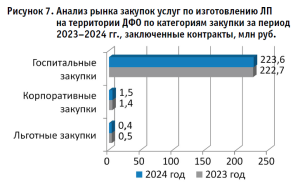
На рисунке 7 показан анализ закупок услуг по изготовлению ЛП на территории ДФО по категориям закупки за период 2023–2024 гг. Наблюдается устойчивое доминирование госпитального сегмента с незначительным ростом объемов с 222,7 млн руб. до 223,6 млн руб. (+0,4%), что свидетельствует о стабильности спроса со стороны медицинских организаций и отражает сформировавшуюся потребность для обеспечения оказания медицинской помощи с применением ЛПАИ, тогда как корпоративные закупки9 демонстрируют умеренный прирост с 1,4 млн руб. до 1,5 млн руб (+7,1%). В ДФО льготные закупки за рассматриваемый период осуществлялись в Республике Саха (Якутия) и Сахалинской области, при этом наблюдается выраженная отрицательная динамика льготных закупок с сокращением с 0,5 млн руб. до 0,4 млн руб. (–20%).
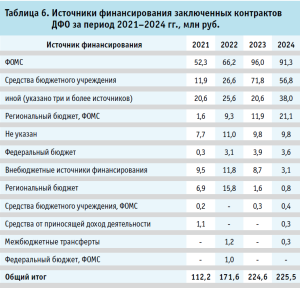
Анализ динамики источников финансирования закупок услуг по изготовлению ЛП в ДФО за 2021–2024 гг. выявляет диверсифицированную систему, свойственную для готовых лекарственных форм при закупках медицинскими организациями (табл. 6).
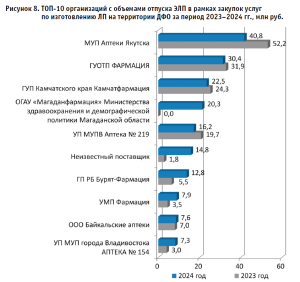
На рисунке 8 показан анализ динамики объемов отпуска экстемпоральных ЛП среди ведущих поставщиков в ДФО за период 2023–2024 гг., согласно которому выявлены значительные изменения в структуре рынка. МУП «Аптеки Якутска» сохраняет лидерство, несмотря на сокращение объемов с 52,2 млн руб. до 40,8 млн руб. (–21,8%), что может быть связано с перераспределением заказов внутри Республики Саха (Якутия), тогда как ГУ «ОТП Фармация» (Сахалинская область) демонстрирует относительную стабильность, снизив поставки с 31,9 млн руб. до 30,4 млн руб. (–4,7%), что подтверждает устойчивость «особого» положения данного поставщика в регионе. ГУП «Камчатфармация», занимающая третье место, также показывает умеренное снижение активности – с 24,3 млн руб. до 22,5 млн руб. (–7,4%), которое, вероятно, связано с набирающим обороты УМП «Фармация» (рост с 3,5 млн руб. до 7,9 млн руб.).
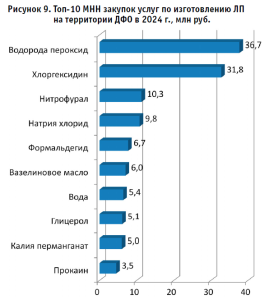
Анализ структуры закупок ЛПАИ по международным непатентованным наименованиям (МНН) в ДФО за 2024 год указывает на востребованность традиционных рецептур и подчеркивает потребность в исходном сырье (рис. 9, табл.7).

В таблице 7 представлены результаты данные о потребностях в ФС за 2023 год, в разрезе анатомо-терапевтическо-химической классификации (далее – АТХ), которые предоставили 18 респондентов. В составе данных установлена информация о не менее 89 международных непатентованных наименованиях (далее – МНН) и 12 наименованиях вспомогательных веществ.
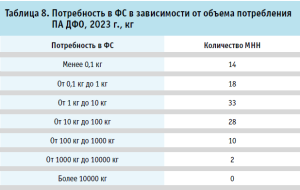
Распределение потребности в зависимости от массы ФС представлена в таблице 8. По итогам 2023 года, общая потребность производственных аптек в ФС менее 1 кг составляет для 32 МНН, представляющих в основном ЛП для лечения сердечно-сосудистых заболеваний и заболеваний нервной системы (дигоксин, карведилол, фуросемид и др.).
10 из 18 респондентов предоставили сведения, что используют при изготовлении ЛП зарегистрированные ЛП по не менее 79 МНН, из которых более двух раз было отмечено респондентами 24 МНН: пропранолол, спиронолактон, каптоприл, преднизолон, ацетилсалициловая кислота, силденафил, гидрохлоротиазид+триамтерен, фуросемид, дигоксин и другие. Также установлено, что по 65 МНН существует дополнительная потребность в ФС, которую невозможно было официально представлять с 2010 года и стала объективна с момента вступления в силу положений, принятых Федеральным законом от 05.12.2022 № 502-ФЗ10.
При анализе 19 полученных анкет на наличие производственных помещений респондентов, установлено, что общая площадь производственных помещений составляет 2828 м2, из которых 562 м2 приходится на «ассистентскую» и 389 м2 – на «асептический бокс».
Discussion.
Исследование наглядно демонстрирует, что на территории субъектов РФ, входящих в ДФО, по данным Реестра РЗН в 2024 году имели лицензию 89 ПА, однако выявлено, что фактически функционирует 54 ПА по адресам осуществления фармацевтической деятельности, что составляет 7,9% от всех установленных ранее действующих ПА в России. 34 ПА относятся к аптекам розничного типа, 20 действуют как структурные подразделения медицинских организаций (больничные). Среди субъектов ДФО наибольшее количество действующих ПА осуществляет деятельность в Республике Саха. В Чукотском автономном округе отсутствуют действующие ПА. Наименьшее значение показателя по количеству действующих ПА на 100 тыс. населения наблюдается в Приморском крае и в Амурской области. Правом на изготовление радиофармацевтических ЛП обладает только одна ПА, расположенная в Хабаровском крае. В этой части отметим, что при анализе данного профиля осуществления ФД мы отмечаем особенность, характерную для ряда МО, оказывающих преимущественно медицинскую помощь по профилю «Онкология», которые по большей части имеют лицензию на производство ЛС со стадией производства готовых лекарственных форм, в основном в виде растворов и при этом одновременно имеют (расширяют посредством переоформления) лицензию на фармацевтическую деятельность с правом изготовления радиофармацевтических ЛП. Лицензией на изготовление ЛП по перечню НСиПВ обладают ПА, расположенные в пяти из 11 субъектах ДФО. По нашей оценке, при осуществлении деятельности по изготовлению ЛП в ДФО задействовано порядка 520 фармацевтических работников (8,8% от всей РФ). Установлено, что по итогам 2023 года ПА ДФО было изготовлено не менее 2074 тыс. единиц ЛПАИ (порядка 4,6% от всей РФ). Производственными аптеками ДФО востребованы не менее 89 фармацевтических субстанций, из которых годовой спрос менее 1 кг наблюдается по 32 МНН, а также по не менее 12 наименованиям вспомогательных веществ. При изготовлении ЛП также используются зарегистрированные ЛП по 79 МНН, которые составляют дополнительную и неудовлетворенную потребность в «малых фасовках» фармацевтических субстанций. Динамика объема закупок услуг по изготовлению ЛП на территории ДФО свидетельствует о сформированном спросе на услуги по изготовлению ЛП, который оценивается в размере 225,5 млн руб по итогам 2024 года. Наблюдается устойчивое доминирование госпитального сегмента с незначительным ростом спроса на +0,4% год к году.
Проведенный анализ позволяет уточнить рекомендации для МО и АО при составлении условий контракта и технического задания заказчиками. Мы считаем важным определять:
- корректное наименование предмета контракта «Услуги по изготовлению лекарственных препаратов», а не «Поставка товара» или использование слова «производство»; имеет значение как в тексте контракта, так и в техническом задании предусматривать форму требования медицинской организации;
- корректное описание объекта закупки, чтобы минимизировать риски в случае арбитражного разбирательства и применения исчерпывающего обоснования о сущности зарегистрированного ЛП как совокупности факторов в виде МНН, лекарственной формы, дозировки и фасовки;
- корректное применение ставки НДС в случае нахождения организации на общей системе налогообложения;
- корректный код ОКПД2, где рекомендовано не использовать код «21.20.1» ОКПД2 и применять «86.90.19.190 – Услуги в области медицины прочие, не включенные в другие группировки» или «21.20.23.190 – Препараты фармацевтические прочие»).
С практической точки зрения одной из задач заказчиков, поставщиков, профессиональных некоммерческих организаций является формирование института «лучших практик» при исполнении государственных контрактов, заключаемых в целях удовлетворения государственных и муниципальных нужд в части обеспечения граждан изготовленными ЛП и индивидуально расфасованными ЛП в условиях АО, включающих выработку и формирование корректной арбитражной практики, что, в целом, затруднительно без системного устранения административных барьеров и правовых коллизий в сфере изготовления и отпуска ЛП. Одной из таких проблематик является ограниченный доступ льготных категорий граждан к ЛПАИ, что в том числе продемонстрировано в настоящем исследовании. У отдельных категорий граждан – пациентов, которым диагностированы заболевания, требующие индивидуального подхода в назначении и применении лекарственной терапии, формально отсутствуют нормативно-закрепленные, стабильные государственные гарантии по льготному лекарственному обеспечению. Только пять из 89 субъектов РФ, не входящих в состав ДФО, имеют такую нормативную базу, что безусловно является примерами «лучших практик», которые реально вносят вклад в социально-экономическое развитие субъектов РФ. Одновременно это не означает, что такие потребности у граждан отсутствуют. Дополнительные законодательные и подзаконные нормативные правовые документы субъекта РФ предназначены для обеспечения ЛП в случаях, когда пациент относится к одной из категорий граждан или соответствующей категории лиц, обладающих правом на получение государственной социальной помощи в виде набора социальных услуг и определенных ст. 6.1 Федерального закона от 17.07.1999 № 178-ФЗ11. Тогда субъектами РФ могут быть приняты решения, устанавливающие меры социальной поддержки и дополнительные меры социальной поддержки в рамках их социального законодательства. Проблематика взаимосвязана с тем, что обеспечение выстроено по «стандартному» механизму – «…в соответствии со стандартами медицинской помощи необходимыми ЛП в объеме не менее, чем это предусмотрено перечнем жизненно необходимых и важнейших лекарственных препаратов, сформированным в соответствии с Федеральным законом от 12 апреля 2010 г. № 61-ФЗ, по рецептам на ЛП…». То есть обеспечение базируется исключительно на зарегистрированных ЛП, – произведенных в промышленных условиях. Изготовленные ЛП не подлежат государственной регистрации, следовательно, не могут быть включены в перечень жизненно необходимых и важнейших лекарственных препаратов. Таким образом, на текущий момент возникает существенный объем правовых коллизий при предоставлении услуг (работ) по изготовлению ЛП и внутриаптечной фасовке зарегистрированных ЛП в рамках действующих положений законодательства, которые также могут отражаться в случаях компенсации страховыми компаниями каждого законченного случая лечения пациентов, но прежде всего отражает ситуацию, когда потребности пациентов обеспечиваются не в полном объеме. Таким образом, с точки зрения развития системы регулирования и формирования единой, гармонизированной системы обращения ЛПАИ, мы дополняем и подтверждаем актуальность заключения, представленного в том числе при обзоре судебной практики в отношении государственных закупок ЭЛП за 2012–2022 годы [17], в котором сформулирована необходимость внесения изменений в несколько законов:
- конкретизировать понятия и само определение фармацевтической деятельности с правим изготовления ЛП, дополнить видом услуг (работ) по внутриаптечной фасовке зарегистрированных ЛП;
- уточнить понятие (определение) зарегистрированного ЛП как совокупности факторов в виде МНН, лекарственной формы, дозировки и фасовки, а также предусмотреть случаи, при которых возможно изготовление зарегистрированного ЛП (например, при возникновении дефицита и (или) дефектуры);
- рассмотреть возможность установления и конкретизации прав органов государственной власти и органов местного самоуправления, которые обеспечивали бы возможность выступать самостоятельными заказчиками услуг (работ) по изготовлению ЛП и внутриаптечной фасовке зарегистрированных ЛП, что имеет потенциал для оптимизации процессов в части льготного лекарственного обеспечения населения, а также сформирует основы для повышения доступности для пациентов целого сегмента социально-фармацевтических услуг, реализуемых в целях обеспечения конституционных прав граждан РФ;
- внести взаимоувязанные поправки в ряд статей законодательства об основах охраны здоровья граждан в РФ, об обязательном медицинском страховании в РФ, о государственной социальной помощи, дополнив соответствующими положениями о применимости изготовленных ЛП, что создаст правовые основания для медицинских работников, имеющих право на назначение и выписывание рецептов на экстемпоральные ЛП, а также повысит эффективность применения фармакотерапии и уровень персонификации дозировок, лекарственных форм или комбинации действующих веществ, где это целесообразно и предусмотрено действующими клиническими рекомендациями, стандартами и схемами лечения при наличии указанных МНН и (или) комбинаций.
Принятие данных предложений, прежде всего в интересах удовлетворения клинических потребностей пациентов, способно служить эффективным механизмом повышения качества оказания медицинской помощи и стандартизации в обеспечении конституционных прав граждан РФ, а также преодоления текущих ограничений и возникающих правовых коллизий, с которыми сегодня сталкиваются органы управления здравоохранением, медицинские работники при внедрении персонализированных методов лечения в клиническую практику. Совершенствование законодательства в целом будет способствовать развитию предложения со стороны аптечных организаций – повышению количества и качества доступного ассортимента индивидуально изготовленных ЛП.
Наши коллеги также пришли к заключению, что внутриаптечное изготовление ЛП продолжает оставаться актуальным по многим сегментам оказания медицинской помощи, однако вопросы нормативного правового регулирования, назначения ЛПАИ, затраты на модернизацию инфраструктуры приводят к сокращению аптек с правом изготовления ЛП и подчеркивают, что в каждом случае наличие производственной аптеки в субъекте РФ необходимо рассматривать на уровне органов управления здравоохранением как важную составляющую доступности медицинской помощи населению [15].
Conclusion.
Проведенное исследование свидетельствует о росте спроса организаций на услуги по изготовлению ЛП на территории ДФО. Говоря о практическом значении подобных исследований, мы отмечаем значимость полученных данных для органов государственной власти субъектов РФ на территории ДФО, которые могут способствовать выработке комплексных решений при развитии аптечной инфраструктуры как объектов здравоохранения (с учетом приказа Росстандарта от 09.04.2025 № 268-ст12), в том числе при реализации мероприятий уполномоченными исполнительными органами субъектов РФ по возрождению и обеспечению функционирования производственных аптек в сфере здравоохранения с учетом пп. 5. п. 9 постановления Совета Федерации Федерального Собрания РФ от 15.02.2023 № 49-СФ «О государственной политике в сфере охраны здоровья матери и ребенка».
Дальнейшие исследования объемов и номенклатуры спроса, анализ закупок услуг по изготовлению ЛП по государственно-территориальным образованиям различного уровня позволят аптечным организациям вырабатывать эффективные решения, направленные на формирование программ развития действующей или вновь создаваемой инфраструктуры. Исходные данные могут оцениваться и рассчитываться на базе до 30 основных и 92 вспомогательных метрик, фильтров и параметров, характеризуя:
- общие параметры закупок услуг по изготовлению ЛП, включая способы размещения, законодательное основание, статусы закупки, особые условия, источники финансирования, субъекты процедуры (заказчики и организаторы, участники и победители);
- сведения по структуре лотов и спецификаций, включая типы, количество позиций, требования к услуге (товару) по МНН, отнесению к фармакотерапевтическим группам, изготовителю, упаковке, необходимым характеристикам, в том числе по дозировкам, лекарственным формам, объемам фасовки;
- широкие временные параметры, включая планы-графики процедур (подачу заявок, размещение, заключения, исполнения), сроки исполнения и отпуска (оказания услуг);
- географическое распределение, включая нахождение заказчика, территорию отпуска (грузополучатели);
- финансовые параметры, включая бюджет (источники финансирования), начальные максимальные цены, сведения об обеспечении заявок и контрактов, цены участников и исполнителей;
- данные о контрактном исполнении, включая их статус, фактические поставки по натуральному и стоимостному выражению.
Представленные выводы способны обозначать задачи для всех этапов развития ПА: определение продуктового портфеля, необходимых мощностей, условий изготовления, зонирования, подбора инженерного, технологического и аналитического оборудования, формирования программы научно-исследовательских задач для разработки технологий изготовления ЛП, методик контроля качества, включая экспресс-методы анализа, проведения испытаний стабильности, а также выстраивания новых кооперационных цепочек с поставщиками и производителями исходного сырья, материалов, оборудования.
__________________________________________________________
1 Приказ Росстандарта от 09.04.2025 № 268-ст «Об утверждении Изменения 802/2025 ОКТМО к Общероссийскому классификатору территорий муниципальных образований и Изменения 527/2025 ОКАТО к Общероссийскому классификатору объектов административно-территориального деления». URL: https://www.consultant.ru/document/cons_doc_LAW_503144/
2 Приказ Министерства здравоохранения Российской Федерации от 31.07.2020 № 780н «Об утверждении видов аптечных организаций». URL: https://www.garant.ru/products/ipo/prime/doc/74547990/ (дата обращения: 24.03.2025 г.).
3 Единый реестр лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности. URL: https://roszdravnadzor.gov.ru/services/licenses (дата обращения: 10.07.2024).
4 Единый реестр лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности. URL: https://roszdravnadzor.gov.ru/services/licenses (дата обращения: 12.11.2024).
5 Единой информационной системы в сфере закупок (ЕИС закупки). URL: https://zakupki.gov.ru/ (дата обращения: 15.01.2025-09.04.2025).
6 Постановление Правительства РФ от 31.03.2022 № 547 «Об утверждении Положения о лицензировании фармацевтической деятельности» [Электронный ресурс] // Режим доступа https://base.garant.ru/403826246/ (дата обращения 31.01.2025).
7 Объемы закупок рассчитывались по суммам заключенных контрактов. Дополнительно рассчитаны начальные максимальные цены контрактов и суммы фактически оплаченных контрактов. Результаты проанализированы и представлены по соответствующим годам отпуска ЭЛП.
8 Федеральный закон от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств». Электронный ресурс. URL: https://docs.cntd.ru/document/1300131660 (дата обращения: 24.10.2024)
9 К корпоративным закупкам в рамках настоящего исследования следует относить закупки субъектов хозяйственной деятельности в форме акционерных обществ с государственным участием для собственных нужд по ФЗ-223, а также закупки для обеспечения деятельности санаторно-курортных организаций.
10 Федеральный закон от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона «Об обращении лекарственных средств». Электронный ресурс. URL: https://docs.cntd.ru/document/1300131660 (дата обращения: 24.10.2024).
11 Федеральный закон от 17.07.1999 № 178-ФЗ «О государственной социальной помощи». URL: https://docs.cntd.ru/document/901738835 (дата обращения: 16.04.2024).
12 Приказ Росстандарта от 09.04.2025 № 268-ст «Об утверждении Изменения 802/2025 ОКТМО к Общероссийскому классификатору территорий муниципальных образований и Изменения 527/2025 ОКАТО к Общероссийскому классификатору объектов административно-территориального деления». URL: https://www.consultant.ru/document/cons_doc_LAW_503144/
- Decree of the President of the Russian Federation of 28.02.2024 No. 145 “On the Strategy for Scientific and Technological Development of the Russian Federation” [Website] // Available at: http://www.kremlin.ru/acts/bank/50358 (Accessed: 13.12.2024). (In Russian).
- Basis for forming a unified harmonized system of regulation in the field of compounding pharmacies: Monograph / I.A. Narkevich, V.S. Fisenko, Z.M. Golant, D.S. Yurochkin, D.D. Mamedov, S.E. Erdni-Garyaev, A.A. Leshkevich. - St. Petersburg: Mediapapir, 2023. – 292 p. (In Russian).
- Sboev G.A. Development of methodological foundations for harmonization of pharmacy practice and integration of quality assurance and management systems: diss. – State Educational Institution of Higher Professional Education “Moscow Medical Academy”, 2009. (In Russian).
- Shishova L.I., Yarutkin A.V., Bagirova V.L. Current and future pharmacopoeial requirements for the quality of extemporaneous medicinal products: a review of regulatory standards. Regulatory research and medicine evaluation. 2024; 14(4): 386–399. https://doi.org/10.30895/1991-2919-2024-14-4-386-399 (In Russian).
- Yarutkin A.V., Bagirova V.L. State pharmacopoeia of the Russian Federation edition XV: development priorities. Regulatory research and medicine evaluation. 2024; 14(5): 572–579. https://doi.org/10.30895/1991-2919-2024-14-5-572-579 (In Russian).
- Mamedov D.D., Yurochkin D.S., Golant Z.M., Fisenko V.S., Alekhin A.V., Narkevich I.A. Past, current and future of legal regulation of drugs compounding in the Russian Federation. Pharmacy & Pharmacology. 2023; 11(3): 176–192. https://doi.org/10.19163/2307-9266-2023-11-3-176-192 (In Russian).
- Farrakhov A.Z. Compounding pharmacy restoration as a current healthcare priority. Regulatory research and medicine evaluation. 2024; 14(4): 380–385. https://doi.org/10.30895/1991-2919-2024-14-4-380-385 (In Russian).
- Medvedeva D.M., Narkevich I.A., Nemyatykh O.D. Analysis of the availability and affordability of pharmaceuticals for children in need of palliative care // Farmakoekonomika. Modern Pharmacoeconomics and Pharmacoepidemiology. – 2021. – Vol. 14. – №. 2. – P. 167–179. (In Russian).
- Miroshnichenko Yu.V., Klimkina E.A., Enikeeva R.A. Analysis of the range of drugs manufactured in pharmacies of military medical organizations // Voennomedicinskij zhurnal (Military medical journal). – 2024. – Vol. 345. – № 11. – P. 69–74. DOI: 10.52424/00269050_2024_345_11_69. (In Russian).
- Martynov A.A., Vlasova A.V. Problems of drug provision in dermatovenereology at the present stage // Farmateka. 2023; 30(9–10): 204–207. DOI: 10.18565/pharmateca. 2023.9-10.204-207. (In Russian).
- Alekhin A.V., Erivantseva T.N., Ryazhenov V.V., Lyskov N.N., Alekhina N.A., Kuznetsova M.M. New role of extemporaneous manufacturing in regulating drug products access onto the market // Pharmacy & Pharmacology. 2023; 11(2): 161–172. https://doi.org/10.19163/2307-9266-2023-11-2-161-172 (In Russian).
- Socio-economic situation in Russia 2023 [Website] // Available at: https://rosstat.gov.ru/storage/mediabank/soc_pol_RF_2023.rar (Accessed: 28.12.2024). (In Russian).
- Fisenko V.S., Farrakhov A.Z., Solomatina T.V., Alekhin A.V., Yurochkin D.S., Erdni-Garyaev S.E., Mamedov D.D., Golant Z.M. Monitoring of compounding pharmacies in the Russian Federation// Vestnik Roszdravnadzora. – 2023. – Vol. 3. – P. 22–33. (In Russian).
- Farrakhov A.Z., Leonov S.D., Bashankaev B.N., Ogul L.A., Solomatina T.V., Krupnova I.V., Yurochkin D.S., Erdni-Garyaev S.E., Mamedov D.D., Golant Z.M., Chagin D.A., Narkevich I.A. Monitoring of compounding pharmacies in the Russian Federation for 2023–2024 (part 1) // Vestnik Roszdravnadzora. – 2025. – Vol. 3. – P. 6–28. (In Russian).
- Abrosimova N.V., Kryukova I.V. Providing the population of the Far Eastern Federal District with pharmaceutical products: problems and trends // Zdravooxranenie Dal`nego Vostoka (Healthcare of the Far East). – 2022. – No. 3. – P. 44–48. DOI: 10.33454/1728-1261-2022-3-44-48. (In Russian).
- Erdni-Garyaev S.E., Mamedov D.D., Yurochkin D.S., Zelikova D.D., Golant Z.M., Fisenko V.S., Narkevich I.A. Pharmacy compounding regulation in the German pharmaceutical market. Part 1. Main features of the legislation (Review) // Regulatory Research and Medicine Evaluation. 2024; 14(1): 91–109. URL: https://doi.org/10.30895/1991-2919-2024-14-1-91-109/ (In Russian).
- Fisenko V.S., Farrakhov A.Z., Mamedov D.D., Yurochkin D.S., Golant Z.M., Narkevich I.A. Review of judicial practice in relation to public procurement of extemporal drugs for 2012–2022 // Vestnik Roszdravnadzora. – 2023. – Vol. 5. – P. 19–30. (In Russian).
