LEGAL REGULATION OF THE CIRCULATION OF MEDICAL DEVICES
Review of key changes in regulatory legal acts in the field of circulation of medical devices
1 — Department of Regulation of Circulation of Medicines and Medical Devices of the Ministry of Health of the Russian Federation, 3, Rakhmanovsky Lane, GSP-4, Moscow, 127994, Russian Federation.
2 — Department of Regulation of Circulation of Medicines and Medical Devices of the Ministry of Health of the Russian Federation, 3, Rakhmanovsky Lane, GSP-4, Moscow, 127994, Russian Federation.
3 — Department of Regulation of Circulation of Medicines and Medical Devices of the Ministry of Health of the Russian Federation, 3, Rakhmanovsky Lane, GSP-4, Moscow, 127994, Russian Federation.
4 — Department of Regulation of Circulation of Medicines and Medical Devices of the Ministry of Health of the Russian Federation, 3, Rakhmanovsky Lane, GSP-4, Moscow, 127994, Russian Federation.
The article provides an overview of the main regulatory changes in the sphere of circulation of medical devices in the Russian Federation, including issues of development preferential regimes for Russian-made medical devices in demand by the healthcare system.
Keywords: medical devices, registration, national regime, purchases
Background.
Президентом Российской Федерации определены национальные цели развития России до 2030 года1. Сохранение населения и укрепление здоровья граждан является одним из национальных приоритетов Российской Федерации. Увеличение продолжительности жизни граждан невозможно без внедрения в здравоохранение новых медицинских технологий и инновационных медицинских изделий.
На реализацию этой задачи направлен новый национальный проект «Новые технологии сбережения здоровья». Прорывные разработки, которые позволят обеспечить систему здравоохранения передовыми технологиями и инновационными медицинскими изделиями, будут способствовать увеличению продолжительности жизни граждан.
Национальный проект «Новые технологии сбережения здоровья» направлен на достижение высокого уровня технологического суверенитета в области медицинских технологий, производство инновационных лекарственных препаратов и медицинских изделий.
Мероприятия национального проекта связаны с разработкой и ускоренным внедрением в экономику важнейших наукоемких технологий2.
В результате реализации национального проекта будут созданы условия для увеличения доли российских разработок в сфере медицинской науки, увеличится количество отечественных разработок оригинальных лекарственных препаратов и медицинских изделий, повысится доступность для граждан передовых технологий лечения, произойдет увеличение доли российских лекарственных препаратов и медицинских изделий.
За последние пять лет, несмотря на вызовы, здравоохранение развивалось как никогда ранее в новейшей истории нашей страны. При этом национальные проекты, сформированные для достижения национальных целей, стали ключевым инструментом улучшения качества здоровья, жизни и благополучия граждан.
Современные вызовы – импортозамещение, цифровизация, кибербезопасность, обеспечение стабильных цепочек поставок и оперативное реагирование на эпидемиологические риски, – требуют адаптации регуляторных подходов и развития механизмов взаимодействия государства, производителей и медицинского сообщества.
Кроме того, качество, безопасность и эффективность медицинских изделий напрямую влияют на охрану здоровья населения и эффективность оказания медицинской помощи. Поэтому регулирование обращения медицинских изделий занимает одно из ключевых мест в нормативно-правовом поле и требует постоянного совершенствования.
Совершенствование процедур регистрации медицинских изделий
В соответствии с законодательством3 на территории Российской Федерации разрешается обращение медицинских изделий, прошедших государственную регистрацию в порядке, установленном Правительством Российской Федерации, и медицинских изделий, прошедших регистрацию согласно международным договорам и актам, составляющим право Евразийского экономического союза (далее – Союз).
Таким образом, на территории Российской Федерации имеется два подхода к регистрации медицинских изделий. Кроме того, за последние несколько лет были введены и успешно реализуются механизмы ускоренной регистрации и внесения изменений в регистрационные досье медицинских изделий.
Формирование эффективной системы допуска в обращение медицинских изделий требует систематической работы по совершенствованию законодательства в этой сфере.
С 1 марта 2025 года вступили в силу новые национальные правила регистрации медицинских изделий4 (далее – Правила).
Осуществлен комплексный пересмотр процедуры государственной регистрации медицинских изделий, действующей с 2012 года5, отвечающий современным подходам предоставления государственных услуг.
Ключевые особенности:
- Перевод государственной услуги по государственной регистрации медицинских изделий в электронный вид (реестровая модель): был осуществлен переход от предоставления результата государственной услуги по регистрации медицинских изделий в виде бумажного документа к записи в электронном реестре и полностью исключено предоставление в регистрирующий орган документов регистрационного досье на медицинское изделие в бумажном виде.
- Возможность выбора одной из «альтернативных» процедур государственной регистрации для медицинских изделий отечественного производства: особенностью процедуры государственной регистрации для медицинских изделий отечественного производства является предоставление заявителем в регистрирующий орган исключительно заявления о государственной регистрации. При этом полный комплект документов регистрационного досье, в том числе заключение по результатам экспертизы качества, эффективности и безопасности, является уже «проверенным и согласованным» подведомственным учреждением регистрирующего органа.
Производители медицинских изделий отечественного производства могут воспользоваться данной процедурой при условии проведения всего перечня доклинических испытаний в ФГБУ «ВНИИИМТ» Росздравнадзора, а клинических испытаний – в медицинских организациях, включенных в сеть национальных медицинских исследовательских центров, состав которой утвержден Министерством здравоохранения Российской Федерации, а для программного обеспечения с применением технологий искусственного интеллекта, предназначенного для анализа рентгеновских изображений – в ГБУЗ «НПКЦ ДИТ ДЗМ». Срок государственной регистрации в данном случае составляет 10 рабочих дней. Данная мера устанавливает преференции для отечественных производителей медицинских изделий, направленные на повышение уровня импортозамещения. Она позволит значительно повысить качество подготовки документов, представляемых заявителем в целях государственной регистрации медицинских изделий, и сократить время вывода отечественного медицинского изделия на рынок Российской Федерации.
- Установление возможности использования производителем собственных доказательных материалов, что позволит сократить объем испытаний, проводимых испытательными лабораториями (центрами), аккредитованными в национальной системе аккредитации.
- Особенности внесения изменений в документы, содержащиеся в регистрационном досье на программное обеспечение с применением технологий искусственного интеллекта: внесение изменений в документы, содержащиеся в регистрационном досье на программное обеспечение с применением технологий искусственного интеллекта, являющееся медицинским изделием, в части внесения изменений в нумерацию его версии, которые не влияют на его функциональное назначение и принцип действия, осуществляется посредством подачи в регистрирующий орган заявления о внесении изменений в документы, содержащиеся в регистрационном досье.
Кроме того, Правилами предусмотрено, что в случае добровольного проведения инспектирования производства медицинских изделий 1 и 2а класса риска (нестерильных) производители получают возможность в уведомительном порядке (без проведения экспертизы качества, эффективности и безопасности) вносить в свои регистрационные досье любые изменения.
На рисунке представлены сроки регистрационных процедур по выводу медицинских изделий в обращение согласно редакциям Правил государственной регистрации медицинских изделий.
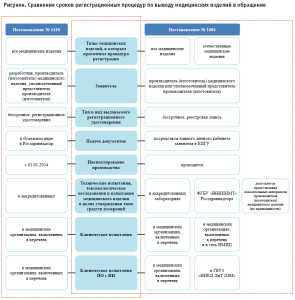
Также в отношении постановления Правительства Российской Федерации от 01.04.2022 № 552 «Об утверждении особенностей обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера» внесены следующие изменения:
- продлен срок действия постановления до 1 января 2028 г.;
- осуществлен перевод государственной услуги в электронный вид, что будет способствовать снижению издержек заявителя на взаимодействие с Росздравнадзором и сокращению сроков предоставления государственной услуги.
Следует отметить, что указанным постановлением для медицинских изделий, включенных в перечень, установлена возможность прохождения нескольких ускоренных процедур государственной регистрации в целях получения регистрационного удостоверения сроком до 1 января 2028 г.
Кроме того, Минздравом России совместно с Росздравнадзором проводится огромная работа для достижения цели – создания единого рынка медицинских изделий Союза, которая позволит экономить временные, денежные ресурсы заявителей, но, в первую очередь, позволит оптимизировать сам процесс регистрации медицинских изделий, упростить процесс признания с помощью единых требований к качеству, безопасности и эффективности медицинских изделий и в целом положительно скажется на всех участниках рынка: уполномоченных органах стран Союза, отечественных и международных производителях, дистрибьюторах.
Так, по итогам заседания 15 августа 2025 г. Евразийского межправительственного совета одобрена Концепция развития общего рынка медицинских изделий в рамках Евразийского экономического союза6.
Концепция является программно-стратегическим документом, направленным на определение основных векторов интеграции в рамках Союза для дальнейшего развития общего рынка медицинских изделий, и предусматривает в том числе:
- состояние рынка медицинских изделий в государствах-членах Союза;
- достигнутый фактический уровень интеграции и гармонизации права Союза в сфере обращения медицинских изделий по состоянию на 1 января 2025 года;
- общие подходы к разработке единых правил обращения медицинских изделий в рамках Союза с учетом рекомендаций Международного форума регуляторов медицинских изделий (IMDRF);
- основные результаты функционирования общего рынка медицинских изделий в рамках Союза;
- перспективные направления развития регулирования общего рынка медицинских изделий;
- формирование единого информационного пространства Союза в сфере обращения медицинских изделий.
Приоритет закупок медицинских изделий отечественного производства
Развитие медицинской промышленности сегодня связано с деятельностью регуляторов, производителей медицинских изделий, сырья, материалов и комплектующих, организаций, обеспечивающих проведение исследований и испытаний, заказчиков в лице медицинских сообществ, а также институтов развития, реализующих системные государственные меры поддержки.
В настоящее время государством активно реализуются различные механизмы поддержки отечественных производителей медицинских изделий. Среди мер поддержки отечественных производителей можно отметить установление национального режима при проведении закупочных процедур.
Из года в год практика показывает, что законодательство о закупках7 является одним из наиболее активно меняющихся. Минувший 2024 год не стал исключением.
В развитие нововведений Правительство Российской Федерации приняло постановление Правительства Российской Федерации от 23 декабря 2024 г. №1875 «О мерах по предоставлению национального режима при осуществлении закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд, закупок товаров, работ, услуг отдельными видами юридических лиц» (далее – Постановление № 1875), устанавливающее преференции при осуществлении закупок в соответствии законодательством о закупках.
Постановлением № 1875 предусмотрено установление:
- перечня товаров (в том числе поставляемых при выполнении закупаемых работ, оказании закупаемых услуг), происходящих из иностранных государств, работ, услуг, соответственно выполняемых, оказываемых иностранными гражданами, иностранным и юридическими лицами, в отношении которых устанавливается запрет закупок для обеспечения государственных и муниципальных нужд, закупок отдельными видами юридических лиц (далее – перечень запрета);
- перечня товаров, (в том числе поставляемых при выполнении закупаемых работ, оказании закупаемых услуг), происходящих из иностранных государств, работ, услуг, соответственно выполняемых, оказываемых иностранными гражданами, иностранными юридическими лицами, в отношении которых устанавливается ограничение закупок для обеспечения государственных и муниципальных нужд, закупок отдельными видами юридических лиц (далее – перечень ограничений);
- преимущества в отношении товаров российского происхождения.
Минздравом России совместно с Минпромторгом России и Росздравнадзором ведется постоянная работа по дополнению перечня запрета и перечня ограничений медицинскими изделиями.
Для проведения всесторонней оценки и проработки вопроса заинтересованные организации вправе представить в адрес Минпромторга России информацию, обосновывающую необходимость включения медицинских изделий в перечень запрета или перечень ограничения (с указанием конкретного наименования медицинского изделия и кода Общероссийского классификатора продукции по видам экономической деятельности), в том числе: финансово-экономическое обоснование, оценку нагрузки на федеральный бюджет, статистические сведения о потребности рынка в продукции и удовлетворении рынка продукцией отечественными производителями, сведения о производственных мощностях отечественных производителей и иной информации об отечественных производителях, позволяющие оценить целесообразность таких изменений.
Наличие предусмотренных Постановлением № 1875 ограничений и запрета позволит отечественному производителю осуществлять долговременные инвестиции в производство, научно-исследовательские и опытно-конструкторские работы.
Conclusion.
Завершая обзор основных изменений законодательства в сфере обращения медицинских изделий, можно констатировать, что регуляторная политика обращения медицинских изделий движется в направлении ускорения доступа к медицинским изделиям при одновременном контроле за качеством, безопасностью и эффективностью медицинских изделий.
Минздравом России совместно с Росздравнадзором ведется постоянная и системная работа по совершенствованию актов, регулирующих обращение медицинских изделий. Так, в настоящее время осуществляется работа по комплексному пересмотру приказов Минздрава России, утверждающих:
порядок проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий;
порядок организации и проведения экспертизы качества, эффективности и безопасности медицинских изделий.
Ведется работа по внесению изменений в Положение о федеральном государственном контроле (надзоре) за обращением медицинских изделий8. Продолжается работа по разработке и утверждению новых индикаторов риска нарушения обязательных требований, используемых Федеральной службой по надзору в сфере здравоохранения при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий.
Также подготовлен проект федерального закона «О внесении изменений в часть вторую Налогового кодекса Российской Федерации» в части регулирования налогообложения и взимания государственной пошлины при обращении медицинских изделий.
Формирование нормативного правового регулирования, направленного на снижение зависимости от импорта и увеличение доли выпуска высокотехнологичной отечественной продукции, позволит обеспечить рынок безопасными и эффективными медицинскими изделиями.
___________________________________________________________
1 Указ Президента Российской Федерации В.В. Путина от 7 мая 2024 г. № 309 «О национальных целях развития Российской Федерации на период до 2030 года и на перспективу до 2036 года».
2 Указ Президента Российской Федерации от 18 июня 2024 г. № 529 «Об утверждении приоритетных направлений научно-технологического развития и перечня важнейших наукоемких технологий».
3 Статья 38 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
4 Постановление Правительства Российской Федерации от 30 ноября 2024 г. № 1684 «Об утверждении Правил государственной регистрации медицинских изделий».
5 Постановление Правительства Российской Федерации от 27 декабря 2012 г. № 1416 «Об утверждении Правил государственной регистрации медицинских изделий».
6 Распоряжение Евразийского межправительственного совета от 15 августа 2025 г. № 10 «О Концепции развития общего рынка медицинских изделий в рамках Евразийского экономического союза».
7 Федеральный закон от 5 апреля 2013 г. № 44-ФЗ «О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд». Федеральный закон от 18 июля 2011 г. № 223-ФЗ «О закупках товаров, работ, услуг отдельными видами юридических лиц».
8 Постановление Правительства Российской Федерации от 30 июня 2021 г. № 1066 «О федеральном государственном контроле (надзоре) за обращением медицинских изделий» (вместе с «Положением о федеральном государственном контроле (надзоре) за обращением медицинских изделий»).
