DRUG PROVISION
Modern methodological approaches to the transfer of original medicines
1 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
2 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0000-0003-0936-5551
3 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0009-0000-1738-6198
4 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0009-0005-7007-9476
5 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0009-0007-4292-880X
6 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0000-0002-5950-8269
7 — Federal State Budgetary Institution “Scientific Center for the Examination of Medical Products” of the Ministry of Health of the Russian Federation, 8, bld 2, Petrovsky blvd, Moscow,127051, Russian Federation.
ORCID: https://orcid.org/0000-0002-1441-3418
New medical technologies in the field of health care acquire real therapeutic value only if they are effectively implemented in wide clinical practice. Despite the significant number of new innovative projects that declare their goal to improve the quality and accessibility of medical care, the number reaching the stage of successful implementation, according to the literature, does not exceed 10%. The global challenges that Russia is currently facing dictate the need for priority development and implementation of patient-oriented domestic developments in the field of healthcare. Work on the implementation of innovative technologies and scientific programs in the field of healthcare requires scientific, legal, communicative, economic support. Based on the experience of the transfer of innovative domestic medicines, a basic model has been created – a track for the transfer of the original drug from the idea to the patient, which allows you to implement a comprehensive step-by-step plan for the implementation process, due to the clear regulation of the functionality of all its subjects. In the course of the work, materials from available literature sources on the implementation of research programs, the provision of legal protection for the results of intellectual activity, methodological approaches to the issues of evaluating efficacy and safety, the development of the design and strategy of preclinical and clinical studies of drugs, the promotion and scaling of the results of innovative developments, the search for industrial partners, ways introduction into circulation and implementation of the commercialization strategy. The presented scheme of the process of introduction of the original medicinal product clearly reflects the stages of implementation of medical innovations. The ,0organization of work on the promotion of medical technologies in accordance with the proposed model is designed to help meet the need for quality medical care, the formation of private and public partnerships, reducing the risks of investing in the health sector.
Keywords: original drug, track, scientific program, information and analytical program, database, medical technology, medical innovation, patient orientation, transfer of medical technologies, promotion strategy
Background.
Инновационная модель развития здравоохранения подразумевает комплексное взаимодействие медицинской науки и практического здравоохранения, выявление инновационных технологий на стадии разработки и их внедрение в практическое здравоохранение. Однако, несмотря на значительное число инновационных проектов, заявляющих своей целью повышение качества и доступности медицинской помощи, число доходящих до стадии успешного внедрения не превышает 10% [1].
Глобальные вызовы, с которыми столкнулась Российская Федерация, диктуют необходимость приоритетной разработки и реализации современных отечественных технологий, так как в условиях экономических санкций самодостаточность и технологическая независимость становятся ключевыми факторами для развития государства1.
В рамках стартовавшего в 2022 году федерального проекта «Медицинская наука для человека» и реализации стратегических инициатив социально-экономического развития Российской Федерации до 2030 года планируется повысить эффективность и практический выход от исследований и разработок в сфере здравоохранения, результаты которых должны воплощаться в готовых лекарственных препаратах (ЛП), изделиях медицинского назначения (ИМН), методах и способах профилактики, диагностики, лечения и реабилитации для практического здравоохранения.2
Внесены изменения в госпрограмму по развитию фармацевтической отрасли, основным курсом которой является разработка и реализация отечественных инновационных продуктов. Одной из основных целей госпрограммы является увеличение объемов производства отечественных лекарственных средств и медицинских изделий к 2030 году в денежном выражении в два раза по сравнению с 2021 годом3.
Указанные регламентирующие документы, определяющие развитие медицинской науки, фармацевтической промышленности предусматривают использование результатов фундаментальных научных исследований для получения отечественных инновационных продуктов и технологий, создание технологических инноваций в фармацевтической и медицинской промышленности, вывод на внутренний рынок отечественной инновационной продукции, разработку эффективных механизмов трансфера инновационных технологий, технологическое перевооружение производственных мощностей, государственных учреждений науки и образования [2].
Реализация поставленных задач требует новых подходов, формирования особой экосистемы отечественной медицинской науки и практического здравоохранения, основными задачами которых является создание, сопровождение и внедрение современных инновационных медицинских технологий (ИМТ).
В соответствии с приказом Минздрава России от 28.01.2022 № 40 «О центре трансфера медицинских технологий» на базе федерального государственного бюджетного учреждения «Научный центр экспертизы средств медицинского применения» Минздрава России создан центр трансфера медицинских технологий (далее – Центр).
Основными функциями Центра являются:
- Содействие лицам, осуществляющим научную (научно-исследовательскую) и (или) научно-техническую деятельность, а также федеральным органам исполнительной власти, обеспечивающим разработку и реализацию программ научных исследований в сфере охраны здоровья, их координацию в выявлении и предоставлении правовой охраны результатам интеллектуальной деятельности, полученным при проведении прикладных научных исследований в интересах медицины и здравоохранения.
- Формирование рекомендаций, касающихся доклинических исследований и клинических исследований лекарственных препаратов, технических испытаний и клинических испытаний медицинских изделий, исследований, направленных на обеспечение достаточного уровня доказательности методов и способов профилактики, диагностики, лечения и реабилитации, по проектам тематик прикладных научных исследований и тематикам прикладных научных исследований по представлению координационного центра исследований и разработок в области медицинской науки.
- Консультирование по вопросам способов внедрения разработанных лекарственных препаратов, медицинских изделий, методов и способов профилактики, диагностики, лечения и реабилитации, материалов, предназначенных для изготовления медицинских изделий по индивидуальным заказам пациентов, и расширения их применения с учетом действующего нормативно-правового регулирования.
- Содействие в коммерциализации результатов разработок, включая создание и ведение перечней перспективных разработок и их результатов, производителей медицинской и фармацевтической продукции, оценке ожидаемых сравнительной клинической эффективности и безопасности результатов разработок и экономических последствий их применения, поиске индустриальных партнеров для коммерциализации результатов разработок, консультирование, в том числе правовое, по вопросам разработки и реализации стратегии коммерциализации результатов разработок, организация аукциона интеллектуальной собственности.
- Подготовка предложений по механизмам финансового обеспечения проведения ранних фаз клинических исследований лекарственных препаратов, права на которые принадлежат бюджетным или автономным государственным учреждениям, на принципах венчурных инвестиций.
Работа по продвижению инновационных технологий и реализации научных программ в сфере здравоохранения требует тщательной, предварительной комплексной оценки их социально-экономического эффекта и научной значимости, эффективности, безопасности, доступности, результатов применения на практике, уровня доказательности представленных материалов.
Наиболее затратной и регламентированной технологией трансфера является трансфер оригинального лекарственного препарата. Анализ российского фармацевтического рынка демонстрирует, что, несмотря на высокую затратность и регламентированность разработки и внедрения оригинальных лекарственных препаратов, их трансфер имеет неоспоримые рыночные преимущества по сравнению с препаратами-дженериками4.
Инновационные лекарственные препараты могут обеспечить наивысшую рыночную доходность и одновременно явиться мощными драйверами инновационного развития здравоохранения и фармацевтической отрасли в Российской Федерации, позволяющими создавать новые терапевтические направления и целые рыночные сегменты.
Важнейшим компонентом в процессе продвижения медицинских технологий должна быть стратегия, основанная на максимальной персонализации и ускорении в продвижении медицинской технологии с учетом ее терапевтической ценности, социальной значимости и ориентированности на удовлетворение потребности пациента в лечении с учетом эпидемиологической ситуации.
Наглядный пример такой ситуации – пандемия COVID-19, потребовавшая максимального напряжения для экстренного поиска идей, разработки научных программ, инновационных технологий и быстрого внедрения лекарственных препаратов и вакцин в практическое здравоохранение для диагностики и лечения новой коронавирусной инфекции.
Авторами на основе наработанного Центром опыта проведена работа с целью разработки базового трека трансфера и модели процесса продвижения оригинального лекарственного препарата от разработчика к пациенту.
Задачи:
- Детально изучить нормативно-правовую базу для разработки, осуществления программ научных исследований и предоставления правовой охраны результатам интеллектуальной деятельности в сфере разработки продвижения новых лекарственных препаратов.
- Сформулировать четкие алгоритмы действий, касающихся доклинических, клинических, постмаркетинговых исследований лекарственных препаратов, направленных на обеспечение достаточного уровня доказательности эффективности и безопасности.
- Предложить оптимальные пути масштабирования результатов разработок, поиска индустриальных партнеров, введения в оборот и реализации стратегии коммерциализации препарата.
- Пошагово детализировать в базовом треке процесс трансфера и предложить пациентоориентированную модель продвижения нового лекарственного препарата.
Материалы и методы
В работе использован метод подбора актуальной информации по доступным научным базам в соответствии с задачами исследования: РИНЦ, Scopus®, Microsoft Academic, MedLine, PubMed, Wiley (коллекция журналов Database Collection (2016–2021г.)
В процессе работы были изучены и обобщены материалы из доступных литературных источников по вопросам осуществления программ научных исследований, управления проектами, предоставления правовой охраны результатам интеллектуальной деятельности, методологических подходов к вопросам оценки эффективности и безопасности, разработке дизайна и стратегии доклинических и клинических исследований лекарственных препаратов, трансфера технологий, продвижения и масштабирования результатов инновационных разработок, поиска индустриальных партнеров, путей введения в оборот и реализации стратегии коммерциализации оригинального лекарственного препарата.
Для анализа и обобщения информации применялись современные информационно-аналитические программы для поиска и обработки больших баз неопределенно структурированных данных по ключевым словосочетаниям: оригинальный лекарственный препарат, регистрационные исследования, правовая охрана результатов интеллектуальной деятельности, инновационная медицинская технология, методология доклинических и клинических исследований, управление проектами, трансфер медицинских технологий, стратегия коммерциализации оригинального лекарственного препарата, масштабирование результатов инновационных разработок, введение в оборот лекарственного препарата.
По результатам проведенной работы нами был разработан базовый трек5 проекта по трансферу оригинального лекарственного препарата и представлена пациентоориентированная модель внедрения нового оригинального лекарственного препарата.
Существует общий процесс разработки нового продукта от гипотезы до запуска в производство, который состоит из нескольких этапов. Общий процесс разработки от идеи до производства представлен на рисунке 1.
Сущность любого проекта заключается в постановке задач и в обеспечении выполнения необходимых работ, которые заранее не только были спланированы, но и эффективно выполнены.
Реализация проекта от создания до вывода на рынок оригинального лекарственного препарата как нового продукта уникальна на всех его этапах – от возникновения гипотезы, проработки и создания прототипа, до запуска в производство готового лекарственного препарата. Общий процесс разработки нового оригинального лекарственного препарата от поиска новых молекул до серийного производства представлен на рисунке 2.
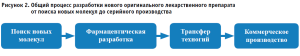
В процессе научного поиска новых молекул, фармацевтической разработки, т.е. последовательного преобразования идеи о продукте в технологию и сам продукт, важна определенная совокупность и последовательность мероприятий, которые приведут к запланированному результату в условиях временных и ресурсных ограничений.
Разработка и создание оригинального лекарственного препарата – это трудоемкий дорогостоящий мультидисциплинарный процесс, требующий поэтапного продвижения с участием целого ряда высококвалифицированных специалистов: химиков, биологов, провизоров, врачей, юристов, экономистов, маркетологов, патентоведов, специалистов в области трансфера технологий, инвесторов, руководителей проекта и др., слаженно действующих в рамках процесса продвижения проекта в соответствии с компетенциями, необходимыми для решения конкретных задач каждого этапа.
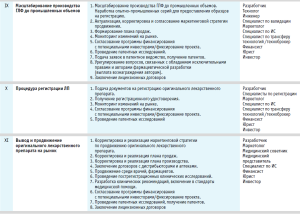
На всех этапах реализации проекта по трансферу оригинального лекарственного препарата в треке регламентируется выполнение ряда мероприятий, необходимых для успешного продвижения. При этом его участники, непосредственно осуществляющие процесс трансфера, должны иметь определенный набор компетенций, определяемых особенностями препарата. По мере реализации проекта доля ответственности, профессиональный состав и роль участников процесса в принятии решения по дальнейшему продвижению могут динамически меняться. В таблице приведен базовый трек по трансферу оригинального лекарственного препарата.

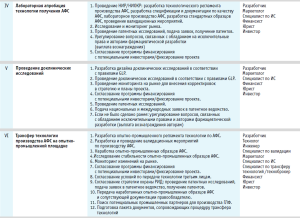


В связи с растущим пониманием роли пациента в системе здравоохранения становится все более востребованным тренд пациентоориентированности.
Особую актуальность этот тренд приобретает в подходах к разработке и трансферу лекарственных препаратов. Именно пациент является основным объектом, определяющим необходимость в лекарственном препарате от инициации этапа разработки до внедрения, а терапевтическая ценность и успешность продвижения препарата непосредственно зависят от степени удовлетворения персонализированной потребности пациента в лечении.
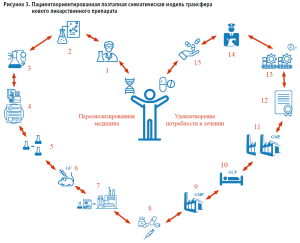
На основании концептуального пациентоориентированного подхода нами разработана поэтапная схематическая модель трансфера инновационного лекарственного препарата с описанием основных этапов процесса трансфера от идеи до коммерциализации.
Этапы процесса:
- Разработка идеи на основе персонализированной потребности в лекарственном препарате.
- Подтверждение и развитие гипотезы.
- Лабораторная разработка технологии производства АФС.
- Разработка регуляторной стратегии, бизнес-модели и технико-экономического обоснования (ТЭО).
- Лабораторное масштабирование технологии производства АФС.
- Доклинические (неклинические) исследования.
- Трансфер технологии производства АФС на опытно-промышленные площадки.
- Выбор готовой лекарственной формы и разработка состава препарата. Лабораторная разработка технологии производства ГЛФ.
- Трансфер технологии производства ГЛФ на опытно-промышленные площадки.
- Клинические исследования.
- Масштабирование технологии производства ГЛФ до промышленных объемов.
- Государственная регистрация лекарственного препарата.
- Серийное промышленное производство и коммерциализация.
- Динамический мониторинг продвижения ЛП и опыта его клинического применения.
- Дистрибуция. Доведение ЛП до пациента. Удовлетворение потребности в лечении.
Результаты и обсуждение
Представленные в статье материалы посвящены трансформации современного здравоохранения в новую, инновационно ориентированную, экосистему, позволяющую сделать здоровье человека ведущим фактором, определяющим социальную стабильность. Создание подобной системы невозможно без существенной модернизации здравоохранения на основе реализации инновационных проектов.
Авторами разработана и детализирована базисная модель внедрения оригинального лекарственного препарата, которая является самой затратной и зарегламентированной технологией трансфера в сфере здравоохранения. Однако именно ускорение процесса доведения оригинального лекарственного препарата до клинической практики позволяет достигать максимальных результатов.
Ярким примером успешной разработки и быстрого внедрения может служить трансфер новых лекарственных препаратов и вакцин для лечения новой коронавирусной инфекции в период пандемии COVID-19.
Инновационный процесс в здравоохранении является последовательной цепью определенных шагов, которые должны привести новаторов от создания идеи к внедрению инновационного продукта, именно этот принцип и положен в основу представленной концепции трансфера, в которой детально прописан процесс взаимодействия субъектов на каждом этапе реализации проекта.
В представленном треке показана цепь событий, в результате которых медицинская инновация, инициированная потребностью пациента в лечении, превращается из идеи в конкретный продукт – лекарственный препарат.
Авторы выделяют 11 основных стадий трансфера нового лекарственного препарата, осуществление которых включает большое количество важных действий и взаимосвязанных, часто параллельно протекающих, процессов – от создания собственно интеллектуального продукта и проведения доклинических и клинических испытаний до вопросов юридического сопровождения, производства и выведения в оборот.
Особое внимание уделено вопросам маркетинга ЛП, который по существу является определяющим для выделения основных стадий цикла внедрения ЛП. Детально прописаны вопросы становления будущего производства, отдельные аспекты коммерциализации и продвижения.
Использование предлагаемой авторами маршрутизации продвижения нового лекарственного препарата предусматривает возможность частичного государственного субсидирования и основано на осуществлении целенаправленной взаимосвязанной деятельности субъектов, которая согласована и распределена по этапам и срокам осуществления, что существенно снижает риски инвестиций и способствует достижению эффективной реализации проекта.
Следует отметить, что инновационная деятельность в сфере здравоохранения подразумевает активное развитие государственно-частного партнерства как главного инструмента снижения затратной нагрузки на государственный бюджет и создания новых возможностей для разработчиков и производителей новых лекарственных препаратов. Важно, что в представленной модели начальным и конечным объектом деятельности по внедрению нового лекарственного препарата является пациент.
Conclusion.
Авторами разработан базовый трек трансфера оригинального лекарственного препарата, в котором поэтапно детализирован его путь от идеи до внедрения в клиническую практику.
Процесс продвижения нового лекарственного препарата рассматривается в рамках концепции пациентоориентированной медицины и направлен на оптимизацию взаимодействия участников при последовательной реализации взаимосвязанных стадий трансфера с учетом сложившейся регуляторной практики, правовых, технологических и экономических реалий.
В рамках представленной модели трансфера степень удовлетворенности персонализированной потребности пациента в лечении определяет терапевтическую ценность нового лекарственного препарата и успешность его продвижения.
Методологические подходы к трансферу оригинальных лекарственных препаратов, предложенные авторами стати, призваны способствовать ускорению реализации медицинских инноваций, становлению частно-государственного партнерства, снижению рисков инвестирования в сфере здравоохранения.
_______________________________________________________________________
1 Распоряжение Правительства Российской Федерации от 06.10.2021 № 2816-р (ред. от 14.03.2022) «Об утверждении перечня инициатив социально-экономического развития Российской Федерации до 2030 года».
2 Проект «Медицинская наука для человека» РГ03-ОС01-Р03. Научно-технологическое развитие Российской Федерации.
3 Постановление Правительства Российской Федерации от 29.12.2021 № 2544 «О внесении изменений в государственную программу Российской Федерации “Развитие фармацевтической и медицинской промышленности”».
4 Фармацевтический рынок России 2021: влияние пандемии и стратегии развития. URL: https://delprof.ru/press-center/open-analytics/farmatsevticheskiy-rynok-rossii-2021-vliyanie-pandemii-i-strategii-razvitiya/.
5 Трек – от англ. track – след, дорожка, колея, курс, трасса, путь.
1. Pavlenko O.V. Russian innovations in medical technology // Analytical Bulletin of the Federation Council of the Federal Assembly of the Russian Federation (Analiticheskij vestnik Soveta Federacii Federal'nogo Sobraniya Rossijskoj Federacii). 2018; 4 (390): 64–73.
2. Gornak S.Yu. Statistics of innovations in the system of medical care of the population // Proceedings of the St. Petersburg State University of Economics (Izvestiya Sankt-Peterburgskogo gosudarstvennogo ekonomicheskogo universiteta). 2015; 3 (93): 117–120.
