PHARMACOVIGILANCE
Monitoring of compounding pharmacies in the Russian Federation
1 — Ministry of Health of the Russian Federation, 3, Rakhmanovsky lane, City Service Post Office-4, Moscow, 127994, Russian Federation.
2 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
3 — The State Duma of the Federal Assembly of the Russian Federation, 1, Okhotny Ryad str., Moscow, 103265, Russian Federation.
4 — The Ministry of Industry and Trade of the Russian Federation, 10-2, Presnenskaya emb., Moscow, 123317, Russian Federation.; Bauman Moscow State Technical University, 5-1, 2nd Baumanskaya st., Moscow, 105005, Russian Federation.
5 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0003-4609-0155
6 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0001-6297-9304
7 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0001-5061-0729
8 — Federal State Funded Educational Institution of Higher Education «Saint Petersburg State Chemical and Pharmaceutical University» of the Ministry of Health of the Russian Federation, 14, lit. A, Prof. Popov str., Saint Petersburg, 197022, Russian Federation.
ORCID: https://orcid.org/0000-0003-0256-6692
The authors conducted monitoring of actual activities of Russian pharmaceutical organizations that have retail license for compounding of drugs, which was dedicated to identifying key infrastructural, technological and personnel characteristics of the compounding segment. Monitoring was performed on the basis of data and with the support of the Federal Service for Surveillance in Healthcare (Roszdravnadzor). The article presents main results of the current state of actual activities in the compounding segment for 2022 and proposes further measures in development of compounding pharmacies.
Keywords: register of compounding pharmacies, extemporaneous medicines, industrial pharmacies, industrial pharmacy able to manufacture medicines, prescription and production department, manufacturing and dispensing of medicines, intra-pharmacy preparation, packaging of registered medicinal product
Background.
Мониторинг производственных аптек (далее – мониторинг) осуществлялся в рамках подготовки к реализации норм Федерального закона от 05.12.2022 № 502-ФЗ «О внесении изменений в статью 56 Федерального закона “Об обращении лекарственных средств”» (в части изготовления лекарственных препаратов для медицинского применения (далее – ЛП))1.
Аптечные организации, имеющие лицензию на фармацевтическую деятельность с правом изготовления и отпуска ЛП, асептических ЛП, радиофармацевтических ЛП (далее – производственные аптеки), являются важным элементом системы здравоохранения, обеспечивая функции, не доступные прочим участникам (субъектам хозяйственной деятельности) рынка обращения лекарственных средств – оказание услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП.
Возможность оказания такого вида услуг (работ) производственными аптеками напрямую влияет на рациональность назначения и применения ЛП и, как следствие, эффективность использования средств бюджетов системы здравоохранения всех уровней, включая средства граждан. В настоящее время услуги (работы) по изготовлению ЛП и фасовке зарегистрированных ЛП осуществляются по рецептам на ЛП, требованиям медицинских организаций. При этом ключевой задачей развития сегмента деятельности производственных аптек можно считать интеграцию изготавливаемых ЛП (далее – экстемпоральные лекарственные препараты, ЭЛП) в систему лекарственного обеспечения, в том числе при обеспечении отдельных категорий граждан, имеющих право на получение государственной социальной помощи, базовую и территориальные программы обязательного медицинского страхования.
Интеграция ЭЛП в программу государственных гарантий бесплатного оказания гражданам медицинской помощи должна осуществляться посредством внесения изменений, в частности, в Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (далее – ФЗ-323)2, Федеральный закон от 29.11.2010 № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации» (далее – ФЗ-326)3, а также в Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (далее – ФЗ-61)4 в части внесения изменений в ст. 56 и ее дополнения положениями об услугах (работах) по изготовлению ЛП и фасовке зарегистрированных ЛП, а также обеспечения возможности органам государственной власти и органам местного само управления выступать заказчиками с целью реализации своих полномочий в сфере охраны здоровья граждан.
Не менее важным аспектом развития спроса на услуги (работы), реализуемые производственными аптеками, является выработка лучших практик осуществления закупок со стороны медицинских организаций и органов управления здравоохранением субъектов Российской Федерации.
Развитие спроса на услуги (работы) по изготовлению ЛП и фасовке зарегистрированных ЛП и интеграция ЭЛП в программу государственных гарантий бесплатного оказания гражданам медицинской помощи будут служить наиболее эффективным основанием для решения отраслевых задач по развитию и внедрению системы обеспечения качества аптечных организаций, надлежащих аптечных практик, а также преодоления текущих инфраструктурных ограничений и кадрового дефицита, что в целом будет способствовать развитию предложения со стороны аптечных организаций – повышения количества доступной к изготовлению или фасовке номенклатуры ЛП.
Представленные результаты работы по мониторингу рассмотрены в рамках очередного заседания Рабочей группы по подготовке к реализации норм Федерального закона от 05.12.2022 № 502-ФЗ в части изготовления ЛП (далее – Рабочая группа), действующей при Комитете Государственной Думы по охране здоровья, 12 апреля 2023 года с целью выявления барьеров, возникающих у производственных аптек, которые препятствуют их развитию, в том числе законодательных и организационных, а также выработки обоснованных рекомендаций в области модернизации материально-технической базы производственных аптек в субъектах Российской Федерации и развития деятельности по изготовлению ЛП, фасовке зарегистрированных ЛП и отпуску ЛП.
Полученные результаты могут быть использованы в целях определения общего объема средств мер государственной поддержки, предоставляемых и распределяемых для софинансирования расходных обязательств субъектов Российской Федерации, возникающих при реализации мероприятий региональных программ на закупку услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП, а также формирования дополнительных финансовых инструментов, основных целевых показателей, влияющих на достижение национальных целей развития и обеспечения приоритетов в сфере обеспечения национальной безопасности Российской Федерации, в части создания, модернизации, освоения изготовления ЛП, фасовки зарегистрированных ЛП и развития современной высокотехнологичной аптечной инфраструктуры. При этом результаты мониторинга позволяют детализировать план мероприятий (дорожную карту) по совершенствованию государственной политики и нормативного правового регулирования в сфере оказания фармацевтической помощи и осуществления фармацевтической деятельности в области изготовления и отпуска ЛП, который будет взаимосвязан с адресной, доступной и целенаправленной поддержкой как нефинансовых, так и финансовых мер.
Таким образом, целью проведения мониторинга являлась оценка текущего состояния производственных аптек для выработки дальнейших мероприятий в области совершенствования государственной политики и нормативного правового регулирования в сфере осуществления фармацевтической деятельности в области изготовления и отпуска ЛП, включая формирование предложений по необходимым мерам государственной поддержки развития современной высокотехнологичной аптечной инфраструктуры.
В ходе выполнения работы решены следующие задачи:
- Определено количество производственных аптек, функционирующих и сохранивших деятельность по изготовлению и отпуску ЛП в Российской Федерации.
- Проведена классификация производственных аптек по видам отпуска и типам изготавливаемых ЛП.
- Оценены производственные мощности и необходимый объем модернизации материально-технической базы.
- Оценено количество фармацевтических работников, занятых в сфере изготовления ЛП.
- Сформирован реестр производственных аптек, функционирующих и сохранивших фактическую фармацевтическую деятельность с правом на изготовление и отпуск ЛП на территории Российской Федерации.
Материалы и методы
В работе применены эмпирические методы исследования, в частности использован опросный метод в форме дистанционного анкетирования, что позволило провести анализ полученных сведений и сформулировать результаты мониторинга производственных аптек. Разработанная анкета включала в себя формирование базы данных по следующим направлениям: сведения о юридическом лице и лицензии на фармацевтическую деятельность; вид аптечной организации; перечень оказываемых услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП; сведения о фармацевтических работниках, занятых при изготовлении ЛП; информацию о количестве изготовленных ЛП по итогам 2022 года в натуральном выражении; сведения о производственных помещениях и контактную информацию для актуализации реестра (далее – анкета).
В качестве материалов использованы данные Единого реестра лицензий на фармацевтическую и медицинскую деятельность Росздравнадзора по состоянию на 28 марта 2023 года, а также реестр Государственной думы, который представлял выборку, сформированную и предоставленную Росздравнадзором.
Анализ данных и обработка анкет осуществлена с использованием MS Excel, графическое представление информации выполнено в MS PowerPoint.
В отношении полученных и консолидированных данных разработана методика экстраполяции результатов мониторинга на фактическое количество общих площадей действующих производственных аптек на сведения всего Единого реестра лицензий на фармацевтическую и медицинскую деятельность Росздравнадзора в отношении изготовления лекарственных препаратов, которые потенциально нуждаются в модернизации материально-технической базы. Методика учитывала введение коэффициентов (экспертно) – охват мониторинга, потенциальное неучастие в программе модернизации (полученные отказы), коэффициент изготовления только нестерильных лекарственных форм (применяется для поправки при экстраполяции необходимых к модернизации площадей «Стерильный бокс»), коэффициент создания новых высокотехнологичных производственных аптек.
Мониторинг проведен в период с 28 марта 2023 года по 7 апреля 2023 года. Обработка полученных анкет, данных и интерпретация результатов осуществлена в период с 28 марта 2023 года по 10 апреля 2023 года.
Результаты и обсуждение
В соответствии с Единым реестром лицензий на фармацевтическую и медицинскую деятельность Росздравнадзора (далее – Реестр РЗН) по состоянию на 28 марта 2023 года, правом на изготовление ЛП обладали 1019 юридических лиц и индивидуальных предпринимателей, которые осуществляли свою деятельность по 1378 адресам, включая производственную аптеку на территории космодрома Байконур. Мониторинг проведен по реестру Государственной думы, который представлял выборку, сформированную и предоставленную Росздравнадзором (далее – Реестр ГД). Реестр ГД на момент проведения мониторинга содержал информацию по 396 юридическим лицам, которые при сопоставлении Реестра РЗН и Реестра ГД имели в своих структурах 643 (по адресам осуществления деятельности) производственные аптеки или рецептурно-производственные отделы – структурные подразделения медицинских или аптечных организаций, обладающие лицензией на фармацевтическую деятельность с правом изготовления и отпуска ЛП. Таким образом, в рамках мониторинга количество направленных анкет (количество респондентов) в общем составило 396 единиц, при этом количество охваченных адресов по месту осуществления фармацевтической деятельности составило 643, а в целом по Реестру РЗН охват по количеству адресов осуществления деятельности по изготовлению и отпуску ЛП составил 46,7%.
По результатам мониторинга от аптечных организаций из 396 запросов (направленных анкет) получено 280 ответов, которые содержали в себе следующую информацию:
- 4 ответа – отказ в предоставлении информации (0,6%);
- 47 ответов – прекратили деятельность по изготовлению и отпуску ЛП (7,3%);
- 229 ответов – предоставлена информация в виде заполненной анкеты (35,6%);
- 363 – не получен ответ по адресу осуществления деятельности (56,5%).
В отношении поступившей информации о прекращении деятельности по изготовлению и отпуску ЛП, у ответственных лиц, осуществляющих предоставление информации по анкете, дополнительно уточнены причины и период прекращения деятельности – 17 из 47 прекратили ее в период с 2015 по 2019 гг., что подчеркивает негативный и продолжающийся тренд закрытия производственных аптек в России, а также продолжающийся процесс перехода фармацевтической деятельности в статус неквалифицированных видов деятельности («Розничная торговля лекарственными препаратами»). Обращая внимание на количество производственных аптек, прекративших свою деятельность, выделяются следующие федеральные округа – Дальневосточный федеральный округ (35,3%), Центральный федеральный округ (26,9%) и Северо-Кавказский федеральный округ (22,2%). К основным факторам, которые повлияли на данное решение, респонденты отнесли:
- отсутствие спроса, что связано с ограничениями в компенсации расходов на экстемпоральные лекарственные препараты в рамках программы государственных гарантий как за счет средств обязательного медицинского страхования, так и средств льготного лекарственного обеспечения;
- морально устаревшую материально-техническую базу, оснащение и отсутствие со стороны государства финансовых мер государственной поддержки;
- проблемы при заключении и исполнении государственных контрактов на оказание услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП в рамках Федерального закона от 05.04.2013 № 44-ФЗ «О контрактной системе в сфере закупок товаров, работ, услуг для обеспечения государственных и муниципальных нужд»5;
- низкая доступность фармацевтических субстанций в малых фасовках, включая отсутствие ряда фармацевтических субстанций и вспомогательных веществ в государственном реестре лекарственных средств для медицинского применения6.
Таким образом, в рамках мониторинга ответ получен от 43,5% респондентов (по количеству адресов), что составило расчетный показатель доли активности мониторинга производственных аптек в России относительно всех лицензий на фармацевтическую деятельность с правом изготовления и отпуска ЛП (по адресам), информация о которых содержится в Реестре РЗН – 20,3%.
Детальная информация относительно полученных ответов в разрезе федеральных округов Российской Федерации и дополнительная характеристика каждого округа по количеству производственных аптек; количеству производственных аптек, прекративших деятельность; количеству фармацевтических работников, задействованных при изготовлении ЛП; количеству изготовленных единиц продукции; представлена на рисунке 1.
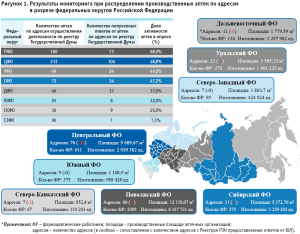
Интерпретация результатов опроса.
Рассматривая 229 заполненных анкет в части наличия производственных помещений респондентов, установлено, что общая площадь производственных аптек составляет 36 282 м2, из которых 8 149 м2 приходится на «Ассистентскую» и 4 760 м2 на «Асептический бокс». В случае экстраполяции результатов мониторинга на фактическое количество общих площадей действующих производственных аптек на сведения всего Реестра РЗН, общее количество площадей действующих производственных аптек, которые нуждаются в модернизации материально-технической базы, в целом составит 140 660 м2, из них 31 592 м2 придется на «Ассистентскую» и 11 257 м2 на «Асептический бокс».
Преобладающее количество действующих производственных аптек относится к розничным аптекам – «Аптекам, осуществляющим розничную торговлю (отпуск) лекарственными препаратами» (далее – розничная производственная аптека). Количество респондентов данного вида аптечных организаций, которые обладают правом на изготовление ЛП, составило 205 (90%), в то время как количество больничных аптек – «Аптека как структурное подразделение медицинской организации» (далее – больничная производственная аптека) составило 24 (10%).
Распределение перечня оказываемых услуг (работ), составляющих фармацевтическую деятельность с правом изготовления и отпуска ЛП, показывает, что 140 (61%) производственных аптек могут осуществлять изготовление стерильных лекарственных форм (рисунок 2).
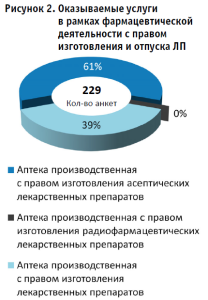
Приложением к Положению о лицензировании фармацевтической деятельности, утвержденным постановлением Правительства Российской Федерации от 31.03.2022 № 547 «Об утверждении Положения о лицензировании фармацевтической деятельности» (далее – Положение о лицензировании фармацевтической деятельности)7, не предусмотрена отдельная деятельность по изготовлению радиофармацевтических лекарственных препаратов (далее – РФЛП), одновременно приказом Минздрава России от 31.07.2020 № 780н «Об утверждении видов аптечных организаций»8 установлен тип производственной аптеки – «Аптека производственная с правом изготовления радиофармацевтических лекарственных препаратов» как структурное подразделение медицинской организации. При этом в Положение о лицензировании фармацевтической деятельности внесены изменения9, которые вступят в силу с 1 сентября 2023 года, и деятельность по изготовлению и отпуску РФПЛ будет разрешена не только для больничных производственных аптек, но и для розничных. Соответственно, как видно из результатов мониторинга, в составе рецензентов отсутствуют производственные аптеки, обладающие правом на изготовление РФЛП. С одной стороны, это связано с малой долей охвата больничных производственных аптек, а с другой, согласно приказу Минздрава России от 12.11.2020 № 1218н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях» (далее – приказ № 1218н)10, изготовление РФПЛ непосредственно в медицинской организации не является лицензируемым видом деятельности. При этом приказ № 1218н устанавливает необходимость осуществлять изготовление РФПЛ, предназначенных для парентерального введения в соответствии с требованиями Государственной фармакопеи Российской Федерации, предъявляемыми к стерильности таких ЛП, с соблюдением, в соответствующих случаях, асептических условий изготовления ЛП, а также с учетом особенностей изготовления лекарственных форм в асептических условиях согласно Правилам изготовления и отпуска ЛП11, установленным законодательством об обращении лекарственных средств, которые предъявляются к аптечной организации, являющейся структурным подразделением медицинской организации. На сегодняшний день, как известно, фактическая деятельность по изготовлению и отпуску РФЛП для собственных нужд медицинских организаций осуществляется и может осуществляться в рамках требований приказа № 1218н (без лицензии), в рамках лицензии на производство лекарственных средств, в рамках лицензии на фармацевтическую деятельность, что само по себе приводит к двойному, тройному толкованию требований при организации такого вида деятельности. При этом, именно в рамках фармацевтической деятельности, изготовление РФЛП больше всего нуждается в совершенствовании и устранении правовых коллизий.
Неоднозначность в данном вопросе вызвана следующими факторами. На текущий момент в медицинских и фармацевтических образовательных организациях не реализованы программы подготовки для фармацевтических работников по особенностям обеспечения радиационной безопасности при изготовлении РФЛП, в том числе в части системы обеспечения качества аптечных организаций. Перечень профессиональных компетенций, квалификационных характеристик, трудовых функций, необходимых знаний и навыков в рамках профессиональных стандартов, как и советующие должности в номенклатуре должностей медицинских и фармацевтических работников (например «Инженер-физик», «Радиохимик», «Химик-аналитик», «Радиобиолог», «Микробиолог», «Электроник», «Специалист по валидации и сертификации» и другие) не установлены и, прежде всего, не предусматривается возможность выполнения трудовых функций специалистами с высшим немедицинским и нефармацевтическим образованием (например химического, технического, технологического, инженерного и других видов образования), что в данный момент выходит за рамки Положения о лицензировании фармацевтической деятельности. Серьезным вопросом выступает проблематика с зарегистрированными РФЛП – дозировка ЛП указывается в диапазоне (например, «флудезоксиглюкоза» [18F], 40–2500 МБК/мл), что при наличии прямого ограничения согласно п. 2 ст. 56 ФЗ-61 полностью исключает деятельность по изготовлению и отпуску РФЛП любыми типами и видами производственных аптек.
Затрагивая вопрос структуры должностей фармацевтических работников и исходя из полученных ответов респондентов, установлено, что в 229 производственных аптеках при изготовлении ЛП задействовано 2075 человек (рисунок 3).
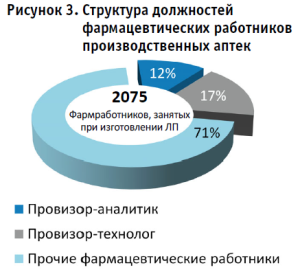
У 84 из 229 производственных аптек (37%) наблюдается острый дефицит провизоров-аналитиков и (или) провизоров-технологов. Всего таких специалистов задействовано 249 человек (12% от общего числа фармацевтических работников). В частности, в больничных производственных аптеках количество штатных единиц провизора-аналитика не превышает 1,0 ставки, что говорит о риске приостановки деятельности в любое время. Дефицит наблюдается также и по провизорам-технологам, которых задействовано 352 человека (17%). Однако, по результатам мониторинга, не представляется возможным оценить количество провизоров-технологов, которые имеют непосредственную возможность осуществлять контрольную функцию при изготовлении ЛП, что входило ранее в трудовые обязанности и на данный момент исключено в соответствии с профессиональным стандартом «Провизор»12 – по окончании программ специалитета 33.05.01 «Фармация» провизор имеет право занимать должности: провизор, провизор-технолог. При этом, наличие соответствующего сертификата, получаемого после прохождения программы ординатуры по специальности 33.08.01 «Фармацевтическая технология», не является обязательным. В связи с такой конструкцией профессионального стандарта, значение вышеуказанной программы ординатуры полностью нивелировано. Указанные специалисты согласно требованиям приказа Минздрава России от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность»13 выполняют основные функции по обеспечению надлежащего качества и безопасности изготовленных лекарственных препаратов.
По итогам 2022 года установлено, что общее количество единиц изготовления производственными аптеками составило 16,9 млн, включая концентраты, полуфабрикаты, тритурации, из которых изготовленных и отпущенных ЛП – 14,9 млн единиц и расфасованных зарегистрированных ЛП по требованиям медицинских организаций – 1,7 млн единиц. В структуре изготовленных и отпущенных ЛП преобладает спрос на услуги (работы) по изготовлению ЛП и фасовке зарегистрированных ЛП по требованиям медицинских организаций – более 65%, из которых 55% приходится непосредственно на изготовление ЛП. 34% из всего количества изготовленных и отпущенных единиц приходится на внутриаптечную заготовку – предварительно изготовленные ЛП, предназначенные для отпуска по наиболее часто поступающим в аптечную организацию рецептам на ЛП или требованиям медицинских организаций.
В ходе обработки полученных анкет структурирована база данных, которая позволила сформировать «среднестатистические портреты» розничной и больничной производственной аптеки, представленные на рисунках 4 и 5 соответственно.


Необходимо отметить, что по средней общей площади больничные производственные аптеки больше розничных производственных аптек на 15%. Сравнение распределения структуры фармацевтических работников, занятых при изготовлении ЛП, также имеет свое отличие, которое заключается в преобладании провизоров-технологов почти в 2 раза. В отношении распределения загрузки больничной производственной аптеки – средняя доля изготовленных ЛП по требованиям медицинских организаций, в том числе для собственных нужд, выше на 25 п.п., при этом средняя доля изготовленных ЛП по рецептам на ЛП ниже почти на 12 п.п.
Conclusion.
Результаты мониторинга продемонстрировали и подтвердили «традиционные» проблематики производственных аптек14, которые на протяжении длительного периода времени характерны для российского фармацевтического рынка.
С точки зрения конкретизации результатов исследования и продолжения работы по мониторингу производственных аптек в Российской Федерации необходимо:
- Провести расширенное исследование деятельности производственных аптек при информационной поддержке Комитета ГД по охране здоровья, Минздрава России, Росздравнадзора и его территориальных органов, органов государственной власти субъектов Российской Федерации, в том числе с целью оценки динамики изготовления ЛП и консолидации данных о потребности в фармацевтических субстанциях, вспомогательных веществах и других видов исходного сырья (например, химических предшественников для изготовления РФЛП), упаковочных, укупоривающих материалов, аптечной посуды, материалов для маркировки и других материалов, необходимых для изготовления ЛП и фасовки зарегистрированных ЛП.
- Рассмотреть возможность формирования и выработки механизма предоставления регулярной отчетности о деятельности производственных аптек, в том числе в рамках модуля (подсистемы) Единой государственной информационной системы в сфере здравоохранения.
В рамках будущей деятельности Рабочей группы в части мероприятий по формированию единой системы нормативного правового регулирования деятельности в области изготовления и отпуска ЛП могут быть рекомендованы следующие предложения:
- Разработать комплексные нефинансовые и финансовые меры государственной поддержки производственных аптек, включая план мероприятий (дорожную карту), в том числе задачи по развитию и обеспечению спроса на услуги (работы) производственных аптек. Опираясь на результаты мониторинга, возможно рассчитать экономическую целесообразность и потенциальную экономию бюджетных средств от модернизации производственных аптек, а также осуществить расчеты для формирования бюджетов системы лекарственного обеспечения, в том числе обеспечения отдельных категорий граждан, имеющих право на получение государственной социальной помощи, федерального и территориальных фондов обязательного медицинского страхования в пределах базовой и территориальных программ государственных гарантий в целях интеграции ЭЛП.
- При решении задач по формированию устойчивого спроса на услуги (работы) по изготовлению ЛП и фасовке зарегистрированных ЛП со стороны системы здравоохранения Российской Федерации, внести изменения в положения ст. 14, 37, 80, 81, 83 ФЗ-323 в части дополнения положениями о включении ЭЛП в клинические рекомендации и стандарты оказания медицинской помощи, а также в программы государственных гарантий и льготного лекарственного обеспечения населения Российской Федерации.
- Обеспечить беспрепятственную компенсацию затрат для медицинских организаций при закупке услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП посредством внесения изменений в положения пп. 7 ст. 35 ФЗ-326 в части конкретизации структуры тарифа услугами (работами) по изготовлению ЛП и фасовке зарегистрированных ЛП, оказываемых аптечными организациями, имеющими лицензию на фармацевтическую деятельность, с целью гармонизации с положениями Налогового Кодекса Российской Федерации, устранения правовых коллизий, возникающих в рамках заключения и исполнения государственных контактов, установления отдельного порядка в отношении ЭЛП в рамках подзаконных нормативных правовых актов контрактной системы в сфере закупок и исключения случаев отказа в компенсации затрат медицинских организаций на закупку соответствующих услуг (работ) со стороны страховых компаний по формальному признаку.
- С целью повышения профессиональных компетенций, знаний, умений, навыков и расширения квалификации медицинских работников рассмотреть возможность расширения и (или) включения дополнительных дисциплин в рамках федеральных государственных образовательных стандартов, прежде всего по образовательным программам высшего образования специалитета 31.05.01 «Лечебное дело», специалитета 31.05.02 «Педиатрия» и других программ высшего профессионального образования врачей, включая программы ординатуры, в отношении назначения, выписывания рецептов на ЛП, в том числе в форме электронного документа, и применения в клинической практике ЭЛП.
- Рассмотреть возможность разработки и реализации в рамках системы непрерывного образования дополнительных профессиональных программ для медицинских работников по вопросам порядка назначения врачами, выписывания рецептов на ЭЛП, в том числе в форме электронного документа, и их применения в клинической практике.
- Рекомендовать научно-практическому совету Министерства здравоохранения Российской Федерации и медицинским профессиональным некоммерческим организациям пересмотреть и доработать клинические рекомендации положениями о применимости ЭЛП по профилям оказания медицинской помощи.
- В части изготовления и отпуска РФЛП:
- ввиду особенностей регистрации РФЛП и указания производителями в составе регистрационного удостоверения диапазона дозировок дополнительно рассмотреть снятие запрета на изготовление зарегистрированных ЛП, что установлено в п. 2 ст. 56 ФЗ-61, а также рассмотреть «исключающие случаи» в отношении ЭЛП;
- дополнить абз 3. пп. «к)» п. 4. и абз 3. пп. «н)» п. 6. Положения о лицензировании фармацевтической деятельности положениями о возможности осуществления фармацевтической деятельности в сфере обращения лекарственных средств для медицинского применения в части изготовления РФЛП специалистами с иными видами среднего и высшего образования, а именно – химического, технического, технологического, инженерного и другими;
- актуализировать номенклатуру должностей медицинских и фармацевтических работников15, дополнив должностями специалистов с высшим немедицинским и нефармацевтическим образованием, которые уже сегодня задействованы и востребованы в производственных аптеках, в том числе при изготовлении РФЛП, а также разработать и утвердить советующий перечень профессиональных компетенций, квалификационных характеристик, трудовых функций, знаний и навыков в рамках профессиональных стандартов, в том числе для медицинских и фармацевтических работников в области радиохимии, радиационной безопасности с учетом особенностей, установленных законодательством Российской Федерации в области обеспечения национальной радиационной безо пасности. Для фармацевтических работников также необходимо включить такие должности как «заместитель заведующего (начальника) структурного подразделения (отдела) аптечной организации»; должности фармацевтических работников, задействованных в отделах структурных подразделений аптечных организаций или пунктах отпуска лекарственных препаратов, участвующих в программе льготного лекарственного обеспечения населения; провизоров – уполномоченных лиц по качеству, которые будут являться ответственными лицами за внедрение, актуализацию документов системы обеспечения качества аптечных организаций в части изготовления, хранения, перевозки и отпуска ЛП («уполномоченное лицо по качеству»), провизоров – специалистов по валидации и сертификации; сохранить должности «Провизор-стажер» и установить должности «Провизор-аналитик стажер» и «Провизор-технолог стажер»;
- понимая логику регулятора в части устранения имеющегося в настоящее время дублирования должностей «провизор» и «провизор-технолог» в рамках профессионального стандарта, тем не менее предлагается сохранить должность «Провизор-технолог», что обосновано текущим приоритетом по возрождению деятельности производственных аптек, а также в полной мере соответствует тенденциям развития как текущей, так и современных высокотехнологичных производственных аптек.
- Разработать и внедрить механизм «ускоренного допуска» к осуществлению фармацевтической деятельности по советующим должностям фармацевтических работников (заведующий, заместитель заведующего, провизор-аналитик, провизор-технолог) за счет прохождения программ дополнительного профессионального образования (от 144 до 250 часов (не более)), которые бы практически в полном объеме основывались на прохождении производственной практики (стажировки) в очной форме. Местом прохождения производственной практики (стажировки) в очной форме в обязательном порядке должны являться действующие производственные аптеки (для всех видов специализаций) и аккредитованные контрольно-аналитические лаборатории и центры контроля качества лекарственных средств (для провизоров-аналитиков). При этом провизоры должны иметь возможность трудоустраиваться на должности «провизор-аналитик стажер», «провизор-технолог стажер».
- В целях преодоления кадрового дефицита и нивелирования рисков в части снижения уровня квалификации фармацевтических работников в связи сокращением сроков обучения по программам среднего профессионального образования и сокращением компетенций в области изготовления и отпуска ЛП, повышения показателя укомплектованности должностей фармацевтических работников с высшим профессиональным образованием в аптечных организациях, в том числе являющихся структурными подразделениями медицинских организаций, недопущения перехода фармации в статус сфер, не требующих высокой квалификации, возрастания интереса абитуриентов к полноценной профессиональной подготовке по программам высшего профессионального образования, структурирования, упорядочивания карьерной лестницы фармацевта и провизора целесообразно на уровне положения о лицензировании фармацевтической деятельности рассмотреть вопрос ограничения на занятие должности заведующего аптечной организацией, структурным подразделением (отделом) аптечной организации и их заместителей без документа о высшем профессиональном образовании и документов о повышении или переквалификации по соответствующим дополнительным профессиональным программам повышения квалификации и переподготовки.
_______________________________________________________________________
1 URL: http://publication.pravo.gov.ru/Document/View/0001202212050043 (дата обращения: 18.04.2023).
2 URL: https://docs.cntd.ru/document/902312609 (дата обращения: 18.04.2023).
3 URL: https://docs.cntd.ru/document/902247618 (дата обращения: 18.04.2023).
4 URL: https://docs.cntd.ru/document/902209774 (дата обращения: 18.04.2023).
5 URL: https://docs.cntd.ru/document/499011838 (дата обращения: 18.04.2023).
6 URL: https://grls.rosminzdrav.ru/GRLS.aspx (дата обращения: 18.04.2023).
7 URL: https://docs.cntd.ru/document/350167126 (дата обращения: 18.04.2023).
8 URL: https://docs.cntd.ru/document/565649073 (дата обращения: 18.04.2023).
9 Постановление Правительства РФ от 29 ноября 2022 г. № 2164 «О внесении изменений в Положение о лицензировании фармацевтической деятельности». URL: https://docs.cntd.ru/document/1300069176 (дата обращения: 18.04.2023).
10 URL: https://docs.cntd.ru/document/573068716 (дата обращения: 18.04.2023).
11 Приказ Минздрава России от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность». URL: https://docs.cntd.ru/document/420313316 (дата обращения: 18.04.2023).
12 Приказ Минтруда России от 09.03.2016 № 91н «Об утверждении профессионального стандарта «Провизор». URL: https://docs.cntd.ru/document/420346038 (дата обращения: 18.04.2023).
13 Приказ Минздрава России от 26.10.2015 № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность». URL: https://docs.cntd.ru/document/420313316 (дата обращения: 18.04.2023).
14 Основы формирования единой гармонизированной системы нормативного правового регулирования в области обращения лекарственных препаратов, изготавливаемых аптечными организациями: Монография / И.А. Наркевич, В.С. Фисенко, З.М. Голант, Д.С. Юрочкин, Д.Д. Мамедов, С.Э. Эрдни-Гаряев, А.А. Лешкевич. – СПб.: Медиапапир, 2023. – 292 с. – ISBN 978-5-00110-344-8 – EDN PZEVDF.
15 Приказ Минздрава России от 02.05.2023 № 205н «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников». URL: http://publication.pravo.gov.ru/document/0001202306010052 (дата обращения: 02.06.2023).
