PHARMACOVIGILANCE
Safety of COVID-19 RNA-dependent RNA polymerase inhibitors according to spontaneous reports
1 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.
2 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.
3 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.
4 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.; State Budgetary Institution of Healthcare of the City of Moscow “O.M. Filatov City Clinical Hospital no. 15 of the Moscow Department of Healthcare”, 23, Veshnyakovskaya st., Moscow, 111539, Russian Federation.
5 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.
6 — Federal State Budgetary Educational Institution of Further Professional Education Russian Medical Academy of Continuous Professional Education of Ministry of Healthcare of the Russian Federation, 2/1, Barrikadnaya st., Moscow, 125993, Russian Federation.
To analyze the cases of adverse events (AE) when using three antiviral drugs for etiotropic therapy of COVID-19: favipiravir, remdesivir, and molnupiravir. The analysis was performed considering the following characteristics of AE: severity and expectedness. The authors analyzed data entered into the state automated information system “Pharmacovigilance 2.0” of Roszdravnadzor. Clinical data were studied, and specific patterns of adverse events were identified. Results. The main clinical manifestations of AE of molnupiravir (2 reports), remdesivir (24 reports) and favipiravir (453 records) were determined. A Weber effect was detected in the analysis of reporting dynamics for favipiravir. The authors found no statistically significant differences between groups of patients with AE stratified by gender and age. The automated system “Pharmacovigilance” of Roszdravnadzor is a valuable information resource that provides detection of serious and unexpected AE and therefore development and implementation of measures for further risk minimization.
Keywords: coronavirus infection, COVID-19, pharmacotherapy, adverse reactions, favipiravir, remdesivir, molnupiravir
This work was carried out with the financial support of the Ministry of Health of the Russian Federation.
Background.
В соответствии с актуальными временными методическими рекомендациями для врачей по профилактике, диагностике и лечению COVID-19, выделены несколько этиотропных препаратов, которые могут быть использованы при лечении COVID-19: фавипиравир, молнупиравир, ремдесивир, нирматрелвир/риторавир, синтетическая малая интерферирующая двуцепочечная рибонуклеиновая кислота (миРНК), умифеновир и интерферон-альфа1. Особый интерес представляют синтетические соединения, взаимодействующие с РНК-зависимой РНК полимеразой вируса-возбудителя COVID-19 – SARS-nCoV-2, а именно фавипиравир, ремдесивир и молнупиравир (представлены в порядке государственной регистрации в Российской Федерации). Эти соединения объединяет схожий механизм действия, заключающийся в встраивании своих активных метаболитов в РНК, способствующий нарушению функций полимеразы, накоплению мутаций и обрыву цепи, т.е. к прекращению репликации вирусов [8, 12, 14].
В настоящий момент накоплены противоречивые данные об эффективности препаратов этой группы, в т.ч. отличаются друг от друга и результаты клинических исследований и систематических обзоров [4, 6, 7, 9, 10]. Следует отметить, что накопление доказательной базы эффективности применения является прежде всего вопросом времени. При этом проблема безопас ного применения фавипиравира, ремдесивира и молнупиравира в условиях ограниченных клинических данных и высокой потребности населения и систем здравоохранения в противовирусных средствах становится еще более актуальной. Все три указанных препарата в настоящий момент зарегистрированы на территории Российской Федерации2 и используются в медицинских организациях страны, а фавипиравир с 17 сентября 2020 г. назначается и амбулаторным пациентам. Следует добавить, что все указанные противовирусные средства являются препаратами рецептурного отпуска.
Одним из наиболее информативных и доступных методов сбора информации по безопасности лекарственных средств является метод спонтанных сообщений. В Российской Федерации организована и функционирует государственная система фармаконадзора, в которой все субъекты обращения лекарственных препаратов могут, а некоторые (медицинские работники, держатели регистрационных удостоверений, например) должны, сообщать о развившихся осложнениях фармакотерапии в соответствующий уполномоченный орган исполнительной власти, которым является Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор). С 2008 года в стране функционирует государственная база данных спонтанных сообщений «Фармаконадзор», поддержка которой осуществляется Росздравнадзором3,4 [15].
Цель работы
Целью нашей работы явилось изучение безопасности фавипиравира, ремдесивира и молнупиравира по данным спонтанных сообщений, поступивших в Автоматизированную информационную систему «Фармаконадзор 2.0» Росздравнадзора.
Материалы и методы
В качестве объекта исследования нами были выбраны спонтанные сообщения, присланные субъектами обращения лекарственных средств согласно требованиям законодательства, и внесенные в Автоматизированную информационную систему «Фармаконадзор 2.0» Росздравнадзора. Выбор лекарственных препаратов (ЛП) в системе осуществлялся по международному непатентованному названию (МНН): «ремдесивир», «молнупиравир», «фавипиравир»), а также по коду анатомо-химическотерапевтической классификации ВОЗ (АТХ): J05AX27 – для фавипиравира, J05AB16 – для ремдесивира, а для молнупиравира поиск осуществляли по коду четвертого уровня J05A, т.к. на момент проведения исследования полный семизначный код для этого лекарственного средства официально не присвоен. Сообщения импортировались из АИС Росздравнадзора в виде электронных таблиц MS Excel, после чего анализировались их основные характеристики. Кодирование проявлений нежелательных явлений (НЯ) / нежелательных реакций (НР), отмеченных в извещениях, осуществлялось в MedDRA 25.0, дополнительно определялись системно-органные классы (SOC). При анализе распределений ориентировались на первичный системно-органный класс (Primary SOC). Период поиска – с 1 января 2020 года по 31 мая 2022 года. Оценка проводилась независимо тремя экспертами, спорные случаи обсуждались совместно с другими участниками исследования. Исследователями принималось во внимание, что одно извещение могло содержать несколько критериев серьезности и указание на несколько наблюдаемых источником исходов неблагоприятного события. Для статистической обработки данных использовали программное обеспечение PaST 4.11 (г. Осло, Норвегия) и R 4.2.0.
Результаты и их обсуждение
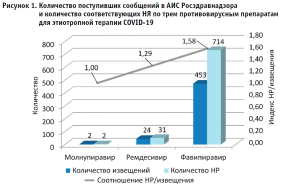
Всего за период 01.01.2020 – 31.05.2022 гг. в АИС «Фармаконадзор 2.0» Росздравнадзора поступило 479 спонтанных сообщений, из которых в двух сообщалось о развитии НР при применении молнупиравира (торговое название представлено одним лекарственным препаратом (ЛП)), в 24 – ремдесивира (три ЛП разных держателей регистрационных удостоверений (ДРУ)) и в 453 – фавипиравира (пять ЛП разных ДРУ). Такое малое количество сообщений о НЯ/НР молнупиравира мы объясняем недавним сроком регистрации этого препарата на территории РФ. Принимая во внимание, что в одном извещении может содержаться информация о нескольких НР, общее количество зарегистрированных НР составило 747 (молнупиравир – 2, ремдесивир – 31 и фавипиравир – 714). Среднее количество репортируемых явлений в одном сообщении, соответственно, составляет 1 для молнупиравира, 1,29 – для ремдесивира и 1,58 – для фавипиравира (рис. 1).
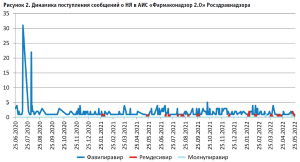
Примечательна динамика поступлений сообщений (рис. 2). В то время как для ремдесивира и молнупиравира она не имеет выраженных особенностей и примерно монотонна с момента регистрации, для фавипиравира наблюдается рост количества поступивших извещений в июне и июле 2020 года. Это совпадает с датами государственной регистрации первых ЛП фавипиравира на российском рынке. Таким образом, можно констатировать, что для фавипиравира в Российской Федерации наблюдался известный специалистам по фармаконадзору «эффект Вебера» – увеличение количества сообщений в первые месяцы после регистрации. Отличием наблюдаемого нами эффекта от «классического» является его непродолжительность (1–2 месяца вместо периода от 6-9 месяцев до двух лет) [2, 5].
При анализе распределения отобранных случаев по полу и возрасту было обнаружено, что большинство реакций развивалось у пациентов женского пола. Так, в группе фавипиравира о случаях НЯ, развившихся у женщин, было получено 267 сообщений (58,94%; 95% ДИ 54,25: 63,51), в группе ремдесивира таких было 14 (58,33%; 95% ДИ 36,64: 77,89), а в группе молнупиравира оба случая были зарегистрированы у пациентов мужского пола. Статистически значимых отличий между группами в распределении изученных случаев по полу не обнаружено (χ^2 = 2,85; P = 0,24; Pточного теста Фишера-Фримена-Гальтона = 0,335).
На следующем этапе мы проанализировали распределение известных случаев по возрасту пациентов, у которых регистрировались НЯ. Средний возраст пациентов, у которых были зафиксированы НЯ при применении молнупиравира, составил 42 года (95% ДИ 0-92,82), ремдесивира – 53 года (95% ДИ 44,58-60,0), а фавипиравира – 50 лет (95% ДИ 49,58-52,65).
Для 14 пациентов в последней группе возраст был не указан. Распределение по возрастным периодам риска для всех изученных групп и в целом по препаратам этиотропной терапии приведено на рисунке 3 (представлены средняя арифметическая, границы 1-го и 3-го квартилей, диапазон данных и особенности распределения по возрастным группам – чем толще диаметр фигуры по горизонтальной оси, тем больше количество пациентов в данной возрастной подгруппе).

Следует отметить, что статистически значимых отличий между группами при этом выявлено не было (TКраскела-Уоллиса = 0,705; P = 0,703). Наши данные подтверждают наблюдения арабских и китайских исследователей, не нашедших подтверждения взаимосвязи пола и возраста и риска развития НР у пациентов с COVID-19 [1, 11]. Источники сообщений о НЯ/НР изучаемых ЛП представлены на рисунке 4.
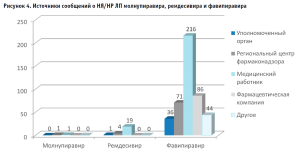
Анализ различий с использованием точного теста Фишера-Фримана-Гальтона обнаружил отличие на уровне статистической значимости P = 0,021. Отличие между группой ремдесивира и фавипиравира (P = 0,009) можно объяснить большим сроком регистрации фавипиравира на российском рынке и его использованием в амбулаторной практике.
Клинические проявления НР/НЯ молнупиравира проявлялись брадикардией (SOC: нарушения со стороны сердца) и ангионевротическим отеком (SOC: нарушения со стороны кожи и подкожной клетчатки). Оба случая были расценены источником как клинически значимое событие, т.е. отвечали принятым в ЕАЭС критериям серьезности, и завершились с улучшением состояния пациентов.
Наиболее частыми проявлениями НЯ/ НР ремдесивира являются симптомы поражения печени (12 проявлений) и реакции гиперчувствительности (7 терминов). Все проявления гиперчувствительности и поражения печени, равно как и инфузионные осложнения (гипотензия) были расценены нами как предвиденные. Обращает на себя внимание случай зарегистрированного острого панкреатита, сопровождавшийся увеличением уровня амилазы и болями в верхних отделах живота. Оценить степень достоверности причинно-следственной связи с применением ремдесивира в данном случае оказалось невозможно, т.к. имела место значительная полипрагмазия и тяжелое течение основного заболевания.
Ретроспективно оценить значение информации о двух случаях повышения уровня креатинина в крови у пациентов, принимавших ремдесивир, достаточно сложно, т.к. данный симптом мог быть как проявлением основного заболевания, так и симптомом лекарственного поражения почек. Два недавних масштабных исследования безопасности ремдесивира с использованием баз данных ВОЗ и FAERS выявили ассоциацию между острой почечной недостаточностью и применением ремдесивира [3, 13]. Поражение почек в момент проведения нашего исследования не включено в инструкции по медицинскому применению ремдесивира ни в одной из стран обращения этого средства.
На основании опубликованных анализов баз данных Росздравнадзором был сформирован новый сигнал по безопасности, окончательное решение по которому будет принято после завершения дополнительных клинических исследований и анализа новых данных о пострегистрационном использовании ремдесивира. Также к заслуживающим дополнительного внимания событиям мы отнесли гипертензию, петехии и гипестезию в месте инфузии.
На следующем этапе мы проанализировали распределение сообщений с подозреваемым препаратом “Ремдесивир” по критериям серьезности. Преобладали сообщения о серьезных НЯ/НР (89%). Жизнеугрожающая ситуация была ассоциирована с гипотензией, обусловленной инфузией ремдесивира. Дополнительной информации по случаю источником представлено не было.
Исходы случаев были в большей части благоприятными. Улучшение состояния пациентов наблюдалось в 12 случаях, выздоровление без последствий – в четырех, состояние без изменений отмечено в двух случаях и в шести извещениях исход неблагоприятного события был определен как «неизвестно».
Клинические проявления НЯ/НР ЛП, содержащих фавипиравир намного разнообразнее, что можно объяснить значительно большим количеством сообщений в АИС «Фармаконадзор». Как и в случае с ремдесивиром, на первое место среди проявлений вышли признаки лекарственного поражения печени (253 проявления; 35,43%), из которых абсолютное большинство было представлено случаями развития гипертрансаминаземий. Проявления реакций гиперчувствительности разного типа, в т.ч. тяжелые и жизнеугрожающие (ангионевротический отек с отеком гортани, анафилактический шок, токсический эпидермальный некролиз) отмечались в 102 (14,29%) случаях проанализированных НЯ/НР. Гиперурикемия, которая считается некоторыми авторами ведущим по частоте осложнением терапии фавипиравиром, встречалась только в 3,64% (26 НР) случаев, однако в одном извещении сообщалось о развитии подагры.
Особое внимание обращает на себя группа сообщений о НЯ со стороны сердечно-сосудистой системы, а именно о нарушении ритма (22). Со стороны крови НЯ (18 проявлений) развивались в виде цитопении, лейкопении, нейтропении, тромбоцитопении, лейкоцитоза, моноцитоза, тромбоцитоза. Наблюдались и извещения о проявлениях расстройств коагуляции (10):
- гематохезия;
- снижение уровня фибриногена в крови;
- увеличение времени кровотечения;
- гематемезис;
- повышение международного нормализованного отношения (МНО);
- кровоизлияние в глаз.
Как и в случае применения ремдесивира, в группе НЯ/НР, ассоциированных с приемом фавипиравира, нами были зарегистрированы проявления, не указанные в ИМП ЛП фавипиравира на момент его регистрации в РФ, в т.ч. психической сферы – сомнолентность, спутанность сознания, тревожность (по два случая), тремор (два случая), алопеция (два случая), а также со стороны других органов и систем – панкреатит (один случай), неуточненное повреждение почек (один случай), неуточненное расстройство зрения и уменьшение остроты зрения (по одному случаю), икота (один случай), галлюцинации, нервозность, и дезориентация (по одному случаю).
Особое внимание было уделено случаям применения фавипиравира у беременных женщин и соблюдению мер минимизации риска наступления беременности, которые были введены в отношении данного ЛП и которые предполагают проведение теста на беременность до и после курса терапии фавипиравиром и соблюдение метода двойной контрацепции. В анализируемой нами выборке обнаружено восемь сообщений о наступлении беременности, исход которой источником не сообщался, а также один случай самопроизвольного аборта. Примечательно, что о всех случаях информация в Росздравнадзор поступила от представителей фармацевтических компаний. На наш взгляд, это может свидетельствовать о зрелости систем фармаконадзора ДРУ на ЛП фавипиравир.
На этапе анализа извещений о НЯ/ НР по критериям серьезности было выявлено, что более половины всех внесенных в АИС случаев были расценены первоисточником как серьезные (55%). Таким образом, в группе фавипиравира по сравнению с ремдесивиром статистически значимо более часто репортировались несерьезные явления (χ^2 = 9,769; P = 0,002; Pточного теста Фишера = 0,0008). Улучшение состояния пациентов после НЯ/НР наблюдалось в 205 случаях, выздоровление без последствий – в 108, состояние без изменений отмечено в 58 случаях и в 76 извещениях исход события был определен как «неизвестно».
Выводы
Результаты нашей работы свидетельствуют, что изучение безопасности противовирусных препаратов, используемых для этиотропной терапии COVID-19, а именно ингибиторов РНК-зависимой РНК-полимеразы, посредством анализа базы данных спонтанных сообщений является доступным и информативным методом. АИС «Фармаконадзор 2.0» Росздравнадзора содержит необходимые данные для выявления основных характеристик и закономерностей развития НЯ/НР препаратов этой группы, а также позволяет определить основные направления дальнейшей активности в направлении минимизации рисков.
Авторам представляется целесообразным постоянный мониторинг и углубленный анализ поступающих в государственную базу данных по безопасности сообщений, а в отношении новых данных по безопасности – проведение дополнительных пострегистрационных исследований безопасности, которые должны быть в том числе посвящены вопросам взаимодействия этиотропных средств с препаратами других групп.
______________________________________________________________________
1 Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) 16-е изд., Москва: Министерство здравоохранения Российской Федерации, 2022. 249 c.
2 Государственный реестр лекарственных средств [Электронный ресурс]. URL: https://grls.rosminzdrav.ru/ (дата обращения: 24.09.2020).
3 Приказ Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
4 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (последняя редакция) / КонсультантПлюс [Электронный ресурс]. URL: http://www.consultant.ru/document/cons_doc_LAW_99350/ (дата обращения: 29.02.2020).
- Alshehail B. [et al.] Incidence and risk factors of adverse drug reactions in patients with coronavirus disease 2019: A pharmacovigilance experience utilizing an ADR trigger tool // Saudi Pharmaceutical Journal. – 2022. – № 4 (30). – P. 407–413.
- Arora A., Jalali R., Vohora D. Relevance of the Weber effect in contemporary pharmacovigilance of oncology drugs // Therapeutics and Clinical Risk Management. – 2017. – Vol.13. – P. 1195–1203.
- Ge’rard A.O. [et al.] Remdesivir and Acute Renal Failure: A Potential Safety Signal from Disproportionality Analysis of the WHO Safety Database // Clinical Pharmacology & Therapeutics. – 2021. – № 4 (109). – P. 1021–1024.
- Hassanipour S. [et al.] The efficacy and safety of Favipiravir in treatment of COVID-19: a systematic review and meta-analysis of clinical trials // Scientific reports. – 2021. – № 1 (11). – P. 11022.
- Hoffman K.B. [et al.] The Weber effect and the United States Food and Drug Administration’s Adverse Event Reporting System (FAERS): analysis of sixty-two drugs approved from 2006 to 2010 // Drug safety. – 2014. – № 4 (37). – P. 283–94.
- Manabe T. [et al.] Favipiravir for the treatment of patients with COVID-19: a systematic review and meta-analysis // BMC infectious diseases. – 2021. – № 1 (21). – P. 489.
- Mart nez V.G., Salas A.A., Ballest n S.S. Antiviral Therapeutic Approaches for SARS-CoV-2 Infection: A Systematic Review // Pharmaceuticals (Basel, Switzerland). – 2021. – № 8 (14). – P. 736.
- Matveev A.V., Kiselev Yu.Yu., Sychev D.A. The possibility and prospects of using the drug favipiravir in patients with COVID-19 // Kachestvennaya klinicheskaya praktika. – 2020. – № 4S. – C. 106–114. (In Russ.).
- Qomara W.F. [et al.] Effectiveness of Remdesivir, Lopinavir/ Ritonavir, and Favipiravir for COVID-19 Treatment: A Systematic Review // International journal of general medicine. – 2021. № 14. – P. 8557–8571.
- Shrestha D.B. [et al.] Favipiravir versus other antiviral or standard of care for COVID-19 treatment: a rapid systematic review and meta-analysis // Virology journal. – 2020. – № 1 (17). – P. 141.
- Sun J. [et al.] Incidence of Adverse Drug Reactions in COVID-19 Patients in China: An Active Monitoring Study by Hospital Pharmacovigilance System // Clinical Pharmacology & Therapeutics. – 2020. – № 4 (108). – P. 791–797.
- Tsvetov V.M., Mirzaev K.B., Sychev D.A. Possibilities and prospects of using the drug remdesivir in patients with COVID-19 // Kachestvennaya klinicheskaya praktika. – 2020. –№ 4. – P. 99–102. (In Russ.).
- Wu B. [et al.] Acute Kidney Injury Associated with Remdesivir: A Comprehensive Pharmacovigilance Analysis of COVID-19 Reports in FAERS // Frontiers in Pharmacology. – 2022. – № 13. – P. 692828
- Zhirnov O.P., Chernyshova A.I. Favipiravir: the hidden danger of mutagenic action // Zhurnal mikrobiologii, epidemiologii i immunobiologii. – 2021. – № 2 (98). – P. 213–220. (In Russ.).
- Kolbin A.S. Farmakonadzor / A.S. Kolbin, S.K. Zyryanov, D.Y. Belousov, L.I. Loginovskaya, O.A. Karpenko, A.V. Matveev [et al.]. – Moscow: OKI: Buki-Vedi, 2019. – 248 p. (In Russ.).
