QUALITY CONTROL OF MEDICINES
А comparative study of two analytical methods of polysorbate-20’s assay in the formulations with recombinant proteins
1 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orsid.org/0000-0002-9667-1014
2 — Federal State Budget Institution “Information and Methodological Center for Expertise, Stocktaking and Analysis of Circulation of Medical Products” of Federal Service for Surveillance in Healthcare, 4, bld.1, Slavyanskaya Square, Moscow, 115172, Russian Federation.
ORCID: https://orcid.org/0000-0001-5637-8836
The paper compares the methods of quantitative determination of polysorbate-20 in the composition of a drug that is a monoclonal antibody. The method of determination of alkaline hydrolysis products with subsequent derivatization and the method of micelle fluorescence analysis (FMA) were used for the study. The main attention was paid to determining the convergence of the results obtained in the case of using one method, comparing the results obtained by different methods on similar preparations or model mixtures, as well as assessing the degree of influence of the active substance on the determination of polysorbate-20 in each of the methods used.
Keywords: polysorbate-20, monoclonal antibodies, quantitative determination
Background.
Лаборатории контроля качества лекарственных средств ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» («ИМЦЭУАОСМП») Росздравнадзора в рамках полномочий по государственному контролю (надзору) или вводу в гражданский оборот лекарственных препаратов проводят испытания большого спектра лекарственным средств, в том числе и препаратов моноклональных антител (ОФС.1.7.1.0014.18). Действующими веществами в данных препаратах являются белковые молекулы сложной структуры. При производстве таких лекарственных средств производитель сталкивается с тем, что белок имеет свойство агрегировать при хранении или механическом воздействии, или денатурировать при лиофилизации или транспортировке, а также имеет способность сорбироваться на стенках емкости, из-за чего снижается его биологическая активность. Для решения этой проблемы используются неионогенные поверхностно-активные вещества, способные стабилизировать молекулы белка в растворе.
Примером таких веществ являются полисорбаты – безопасный класс соединений, проявляющих свои свойства даже в крайне малых концентрациях. К числу таких соединений относится полисорбат-20. Его молекула состоит из гидрофобной части, представленной ядром сорбитана с полиоксиэтиленовыми цепями, а также гидрофильная часть – остаток лауриновой кислоты (рис. 1). Полисорбат-20 является наиболее гидрофильным соединением в ряду применяемых полисорбатов [1]. Полисорбаты мало сорбируются на поверхности белка и обладают незначительным противовирусным действием, что делает их эффективным стабилизатором для пептидных и белковых препаратов и особенно для препаратов, получаемых с использованием культур клеток. Роль стабилизатора крайне важна при производстве и хранении лекарственных средств, поэтому также важно контролировать их содержание [2, 8].
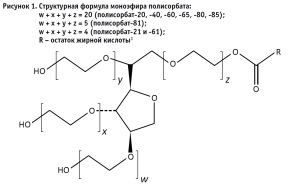
Государственная фармакопея Российской Федерации и Фармакопея Евразийского экономического союза не дают указаний на единый метод количественного определения полисорбатов и, в частности, полисорбата-20. Главными проблемами контроля соединений данной группы являются следующие:
- соединения не имеют хромофорных групп, то есть не могут быть определены прямым детектированием на спектральных детекторах;
- содержатся в низких концентрациях в лекарственном препарате, то есть требуют применения высокочувствительных методик;
- создают с молекулами белка комплекс, из которого сложно выделить исследуемое вещество.
По этим причинам невозможно использовать стандартные методы количественного определения. Для решения данной проблемы исследователями были предложены несколько подходов, позволяющих в той или иной степени разрешить указанные противоречия. Заявленные производителями методы определения можно условно разделить на две большие подгруппы: определение непосредственно полисорбата и определение продуктов его гидролиза [2, 3, 10].
Для определения интактного полисорбата чаще всего в нормативной документации встречаются методы обращенно-фазовой хроматографии с детектором заряженного аэрозоля (CAD), испарительным детектором по светорассеянию (ELSD), спектрофотометрическое определение после реакции с кобальта тиоционат аммонием и последующей экстракцией в органическую фазу [9, 10]. Эти методы занимают много времени, сложны в воспроизведении, а также, в случае с хроматографией, требуют наличия дорогостоящих узкопрофильных детекторов.
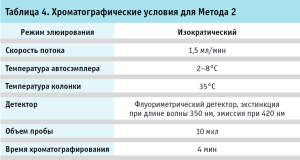
Еще одним способом количественного определения непосредственно полисорбата является проточно-инжекционный метод с анализом флуоресценции мицелл (FMA). Данный метод выполняется с помощью хроматографа, но не требует использования колонки для разделения, вместо этого используется реакционная петля, в которой происходит образование мицелл полисорбата с N-фенил-1-нафтиламином, входящим в состав подвижной фазы. Участвующий в реакции краситель практически не флуоресцирует в водной среде, но хорошо делает это в гидрофобной среде, в данном случае после того, как встраивается в гидрофобное ядро образовавшихся мицелл полисорбата [4, 5, 11, 12]. Анализ проводится с помощью флуориметрического детектора, не требует специфической пробоподготовки образца и занимает короткое время.
В случае с определением продуктов гидролиза полисорбата проводят анализ обращенно-фазовой хроматографией со спектрофотометрическим детектором образовавшихся жирных кислот, либо их дериватов. Данный подход требует длительной, многоступенчатой пробоподготовки. Дополнительной сложностью является то, что из-за особенностей синтеза, серии полисорбата могут иметь различия в своем составе, например, иметь отличающееся соотношение эфиров полиоксиэтиленсорбитана и различных жирных кислот, например, содержание лауриновой кислоты в полисорбате-20 может быть от 40 до 60% [13]. По этой причине в методах контроля с применением гидролиза необходимо в качестве стандарта использовать полисорбат той же серии, которая была задействована при производстве лекарственного препарата [6].
В данной работе проведено сравнение методов количественного определения полисорбата-20 в составе лекарственного препарата, представляющего собой моноклональное антитело. Для исследования были использованы метод определения продуктов щелочного гидролиза с последующей дериватизацией и метод анализа флуоресценции мицелл (FMA). Основное внимание было уделено определению сходимости полученных результатов в случае использования одного метода, сравнению результатов, полученных различными методами на аналогичных препаратах или модельных смесях, а также оценке степени влияния активного вещества на определение полисорбата-20 в каждом из используемых методов.
Материалы и методы
Объект исследования и сравнения. В качестве объекта исследования использовался лекарственный препарат, представляющий собой моноклональное антитело и содержащий в составе полисорбат-20 в качестве стабилизатора. В роли стандартного образца использовался полисорбат-20 производства PanReac (кат. № 142312), с содержанием воды 2,4%.
Оборудование и реактивы. Анализ методом обращенно-фазовой высокоэффективной жидкостной хроматографии с предварительным гидролизом и дериватизацией (Метод 1) проводился с использованием следующего оборудования: твердотельный термостат TDB-120, центрифуга MiniSpin Plus, хроматограф жидкостный высокоэффективный Ultimate 3000, оборудованный спектрофотометрическим детектором с диодной матрицей. Для разделения продуктов реакции была использована хроматографическая колонка YMC-Pack ODS-AQ, 150 4,6 мм, 3 мкм. Реактивы: ацетонитрил, фосфорная кислота концентрированная, калия гидроксид, муравьиная кислота, триэтиламин, 4-бромометил-7-метоксикумарин, N,N-диметилформамид.
Анализ проточно-инжекционным методом с измерением флуоресценции мицеллы (Метод 2) проводился с использованием следующего оборудования: хроматограф жидкостный высокоэффективный Agilent 1200, оборудованный флуориметрическим детектором и реакционной петлей Knitted reactor coil, 5м 0,5мм, объемом 9,8 мл. Реактивы: ацетонитрил, кислота хлористоводородная, натрия хлорид, Brij 35, трис(гидроксиметил)аминометан, N-фенил-1-нафтиламин.
Для приготовления раствора плацебо использовали следующие реактивы: L-гистидина моногидрохлорид моногидрат, L-гистидин, -трегалозы дигидрат. Все используемые реактивы имели квалификацию «химически чистые» (х.ч.) или «чистые для анализа» (ч.д.а.). Все используемое оборудование на момент проведения испытаний имело действующие сертификаты поверки.
Подготовка растворов. Раствор плацебо: 0,56 г L-гистидина моногидрохлорида моногидрата, 0,36 г L-гистидина, 22,7 г , -трегалозы дигидрата растворяли в 900 мл воды очищенной в стеклянном стакане, контролировали значение рН (рН = 6,01). Затем переносили полученный раствор в мерную колбу вместимостью 1000 мл и доводили водой очищенной до метки. Фильтровали полученный раствор через нейлоновый мембранный фильтр с диаметром пор 0,22 мкм. Раствор хранили при температуре от 2 до 8 °C (срок хранения – 6 месяцев).
Раствор 5М калия гидроксида для проведения гидролиза (Метод 1): около 5 мл воды очищенной помещали в химический стакан вместимостью 10 мл и небольшими порциями при постоянном перемешивании добавляли 2,8 г калия гидроксида, тщательно перемешивая до полного растворения навески. Полученный раствор количественно переносили в мерную колбу вместимостью 10 мл, после чего доводили объем раствора до метки водой очищенной и перемешивали. Раствор использовали свежеприготовленным.
Дериватизирующий реагент (Метод 1): к 50 мг триэтиламина прибавляли 1,25 мл ацетонитрила и сразу же тщательно перемешивали. К 30 мг 4-бромометил-7-метоксикумарина прибавляли 3,0 мл N,N-диметилформамида и тщательно перемешивали до полного растворения. Далее к 2,0 мл раствора 4-бромометил-7-метоксикумарина прибавляли 1,0 мл приготовленного раствора триэтиламина и перемешивали. Раствор использовали свежеприготовленным. 4% раствор муравьиной кислоты (Метод 1): 5,0 мл воды очищенной помещали в мерную колбу вместимостью 10 мл, прибавляли 400 мкл муравьиной кислоты, перемешивали, после чего доводили объем раствора до метки водой очищенной и еще раз перемешивали. Раствор использовали свежеприготовленным.
Раствор N-фенил-1-нафтиламина 10 мМ (Метод 2): в мерную колбу объемом 50 мл помещали 0,11 г N-фенил-1-нафтиламина, растворяли в ацетонитриле и доводили до метки этим же растворителем.
Раствор Brij 35 3% (Метод 2): 3,0 г Brij 35 помещали в мерную колбу объемом 100 мл, растворяли в 40 мл воды, после чего доводили до метки тем же растворителем. Подвижная фаза А (Метод 1): использовали ацетонитрил.
Подвижная фаза Б (Метод 1): около 100 мл воды очищенной помещали в мерную колбу вместимостью 500 мл, затем прибавляли 5,0 г фосфорной кислоты концентрированной, затем доводили объем раствора водой очищенной до метки, после чего перемешивали. Раствор использовали в течение 1 суток при хранении при температуре от 15 до 25 °С.
Подвижная фаза В (Метод 2): в мерную колбу объемом 2000 мл помещали 17,5 г натрия хлорида и 12,1 г трис(гидроксиметил)аминометана, растворяли данные навески в 1800 мл воды, после чего доводили значение рН раствора хлористоводородной кислотой концентрированной до рН = 8,0, далее добавляли в мерную колбу 100 мл ацетонитрила и доводили до метки водой. Раствор фильтровали через мембранный фильтр с диаметром пор 0,45 мкм, после чего к полученному раствору прибавляли 1 мл 10 мМ раствора N-фенил-1-нафтиламина и 1 мл 3% раствора Brij 35, тщательно перемешивали полученный раствор.
Подготовка стандартных и испытуемых образцов. Исходные растворы стандартных образцов: готовили два раствора – первый использовали для приготовления контрольного раствора стандартного образца, второй – для приготовления калибровочных стандартных растворов.
Раствор 1: 106,3 мг полисорбата-20 помещали в химический стакан вместимостью 25 мл, затем прибавляли около 10 мл воды очищенной и перемешивали с помощью магнитной мешалки до полного растворения навески. Раствор количественно переносили в мерную колбу вместимостью 100 мл, доводили объем раствора до метки водой очищенной и перемешивали. Контрольный раствор стандартного образца с концентрацией 0,1 мг/мл готовили в двух экземплярах – на водной основе и с раствором плацебо, в качестве растворителя. Для этого в мерную колбу вместимостью 25 мл помещали 2,410 мл Раствора 1, после чего доводили водой очищенной, либо раствором плацебо до метки. Растворы использовались свежеприготовленными.
Раствор 2: 102,2 мг полисорбата-20 помещали в химический стакан вместимостью 25 мл, затем прибавляли около 10 мл воды очищенной и перемешивали с помощью магнитной мешалки до полного растворения навески. Раствор количественно переносили в мерную колбу вместимостью 100 мл, доводили объем раствора до метки водой очищенной и перемешивали.
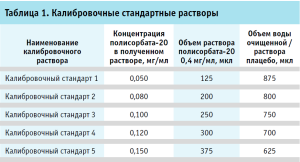
Далее готовили раствор полисорбата-20 с концентрацией 0,4 мг/мл в двух экземплярах – на водной основе и с раствором плацебо в качестве растворителя. Для этого в мерную колбу вместимостью 25 мл помещали 10,025 мл Раствора 2, после чего доводили водой очищенной либо раствором плацебо до метки. Из полученного раствора готовили калибровочные стандартные растворы в пластиковых пробирках вместимостью 1,5 мл, как указано в таблице 1.
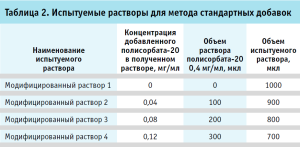
Испытуемые растворы. Во флакон с лиофилизатом препарата вносили 6,0 мл воды для инъекций. Теоретическая концентрация полисорбата-20 во флаконе составляла при этом 0,1 мг/мл. Восстановленный раствор использовали свеже приготовленным. Отдельно готовили испытуемые растворы для метода стандартных добавок. Для этого к испытуемому раствору добавляли раствор полисорбата-20 с концентрацией 0,4 мг/мл (табл. 2).
Подготовка испытуемых, контрольных и калибровочных растворов. Для Метода 1 гидролиз проводится в чистых пластиковых пробирках объемом 0,5 мл. 100 мкл 5 М раствора калия гидроксида смешивали с 100 мкл растворов образцов и инкубировали полученные растворы при температуре 80°С в течение 60 мин. Центрифугировали микропробирки с образцами при 9000 g в течение 1 мин для полного удаления конденсата с внутренней поверхности крышек и стенок микропробирок. Добавляли 50 мкл 5 М раствора калия гидроксида и 200 мкл ацетонитрила. Перемешивали с помощью вибромешалки в течение 5 минут для достижения полного перехода гидролизата полисорбата-20 (лауриновой кислоты) в ацетонитрил. Центрифугировали образцы при 9000 g в течение 1 мин.
В новые пластиковые пробирки помещали 100 мкл дериватизирующего реагента, после чего добавляли по 100 мкл верхнего слоя образцов (ацетонитрил). Перемешивали с помощью вибромешалки, затем центрифугировали при 9000 g в течение 1 мин.
Инкубировали полученные растворы при температуре 60°С в течение 60 мин, после чего центрифугировали при 9000 g в течение 1 мин.
Добавляли ко всем образцам 66 мкл 4% раствора муравьиной кислоты и перемешивали для нейтрализации среды проб после щелочного гидролиза.
Для Метода 2 испытуемый, контрольный и калибровочный растворы использовались без дополнительной пробоподготовки.
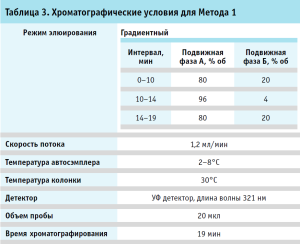
Хроматография. Хроматографические условия для Метода 1 и 2 приведены в таблицах 3, 4.
Результаты и обсуждение
Для Метода 1 в качестве пика полисорбата-20 принимали пик деривата лауриновой кислоты (4-лауроилоксиметил-7-метоксикумарин), время удерживания около 9,1 мин.
По полученным данным строили калибровочный график, откладывая по оси абсцисс содержание полисорбата-20 в разведениях калибровочных стандартных образцов (в мг/мл), а по оси ординат – площадь пика деривата лауриновой кислоты для Метода 1 и площадь пика полисорбата-20 для Метода 2 (в единицах подсчета площади) (рис. 2–5).
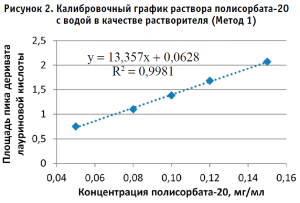
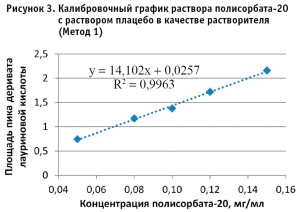
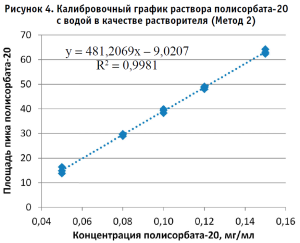
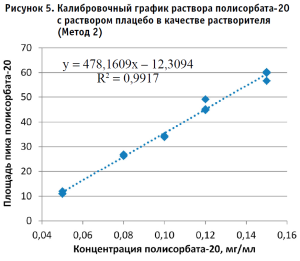
Методом наименьших квадратов рассчитывали уравнение, описывающее зависимость вида:
y = kx + b,
где:
y – это площадь аналита;
x – концентрация полисорбата-20 (мг/мл);
k – угол наклона;
b – отрезок, отсекаемый по оси Y.
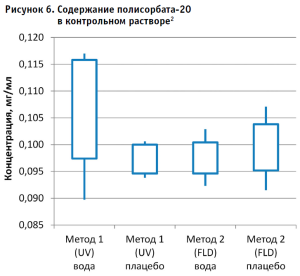
Далее рассчитывали содержание полисорбата-20 в контрольном растворе (рис. 6) по каждому из полученных уравнений, используя формулу:
Концентрация полисорбата-20 = (площадь пика аналита b) / k
Рассчитывали стандартное отклонение и доверительный интервал 95% (± 2 стандартных отклонения от среднего значения).
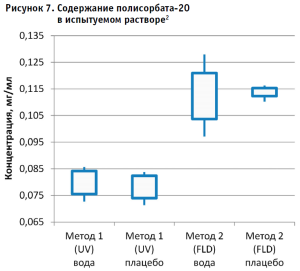
Затем аналогичным образом обрабатывали результаты для испытуемого образца, используя для расчета построенные калибровочные графики (рис. 2–5, 7). По результатам проведенных экспериментов можно сделать следующие заключения:
- Использование раствора плацебо без действующего вещества в качестве растворителя при приготовлении калибровочных и контрольных растворов не оказывает значительного влияния на полученные результаты, что позволяет пренебречь данным раствором и использовать вместо него воду очищенную для упрощения и ускорения проведения анализа. Следует отметить, что данные результаты относятся к использованию раствора плацебо указанного состава.
- Наиболее интересным результатом эксперимента следует признать тот факт, что результаты содержания полисорбата-20 в испытуемом образце, полученные разными методами, достоверно отличаются и не перекрывают доверительные интервалы 95% между собой. В то же время результаты контрольного раствора, не содержащего белка, находятся в одном диапазоне значений.
- Литературные данные свидетельствуют, что полисорбаты обладают невысокой, но ненулевой адсорбцией на белках, поэтому пренебрегать таким явлением не следует. Особенно это важно для лекарственных композиций, в которых белок составляет значительную долю состава. Различия в степени адсорбции также могут быть вызваны структурой целевого белка, в том числе его зарядом и другими физико-химическими характеристиками. Так как белок, находящийся в препарате, сорбирует на себе полисорбат, можно сделать заключение, что это может влиять на прохождение гидролиза и полноту извлечения лауриновой кислоты, в связи с чем могли быть получены различия в результатах.
После обсуждения было принято решение повторить эксперимент, прибегнув к методу стандартных добавок [7]. При обработке результатов, полученных при использовании метода стандартных добавок, обращает на себя внимание тот факт, что при применении Метода 2 (без дериватизации), полученные значения концентраций полисорбата-20 в испытуемых растворах с добавками соответствуют теоретическим ожиданиям. (табл. 5). В то же время практические значения, полученные Методом 1, для всех растворов с внесенными добавками были ниже теоретических, причем не имело значения, на воде очищенной или растворе плацебо был приготовлен испытуемый раствор. Для более точной оценки полученных результатов для Метода 1 был построен график зависимости в координатах аналитический сигнал – концентрация добавленного стандартного раствора полисорбата-20 (рис. 8) В соответствии с рекомендациями по использованию расчетов по методу стандартных добавок, отрезок, отсекаемый полученной прямой по оси Х, равен концентрации полисорбата-20 в растворе без добавок и составляет 0,10 мг/мл, что является значением, близким к теоретическому.
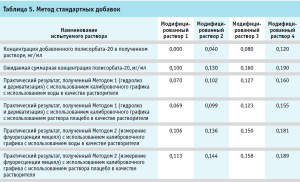
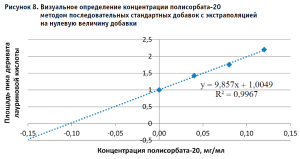
Такой результат позволяет предположить, что в исходном растворе испытуемого лекарственного средства существуют условия, исходно препятствующие полному гидролизу полисорбата-20, что соответствует имеющимся литературным данным о характере поведения аналитов, адсорбирующихся на белковых молекулах.
При этом показано, что использование метода стандартных добавок в данном случае позволяет решить возникающую проблему и нивелировать степень влияния на получаемые результаты систематической ошибки, возникающей вследствие частичной адсорбции полисорбата-20 на белке.
Conclusion.
В результате проведенных экспериментов было показано, что при сравнительном использовании метода определения продуктов щелочного гидролиза с последующей дериватизацией и метода анализа флуоресценции мицелл для определения концентрации полисорбата-20 в растворе лекарственного препарата, содержащем белковые молекулы, не удается добиться сходимых результатов в том случае, если предложенный дизайн метода дериватизации предполагает оценку результатов испытания только по одному вводу испытуемого раствора, что связано с возможным неполным гидролизом молекул полисорбата-20, адсорбированных на белковых молекулах. В то же время, использование данного метода в модификации метода стандартных добавок позволяет получить правильные результаты, что позволяет рекомендовать использование именно такого дизайна испытания для определения количественного содержания полисорбата-20 в растворах лекарственных средств, содержащих белковые молекулы.
Для уточнения данных рекомендаций авторами запланирована серия дальнейших экспериментов.
_______________________________________________________________________
1 например, лауриновой – в случае с полисорбатом-20.
2 Примечание: «усы» – 95% доверительного интервала, границы ящика – минимальное и максимальное значения полученных концентраций.
- Evaluation Report of Food Additives “Polysorbate 20, Polysorbate 60, Polysorbate 65 and Polysorbate 80”. Food Safety Commission. Office Location of the FSC: Japan. Tokyo. 2007.
- Degterev M.B. Method of measuring the amount of polysorbate-80 using alkaline hydrolysis of the sample followed by HPLC. 2018. (In Russ.)
- Grokhovskiy V.I. Determination of polysorbate in biotech drugs / V.I. Grokhovskiy, A.A. Bendryshev, S.V. Shvets, D.A. Orlov, O.A. Vaganova // Drug development & registration. 2017; (2): 160–165. (In Russ.)
- Mahle H.C., Ravuri S.K.K. Pharmaceutical formulation for proteins. November 22. 2012. US Patent App. 13/574,071.
- Tomlinson A. et al. Polysorbate 20 degradation in biopharmaceutical formulations: quantification of free fatty acids, characterization of particulates, and insights into the degradation mechanism // Molecular pharmaceutics. 2015; Vol. 12 (11): 3805–3815.
- Dang H.V. Eccleston. Composition analysis of two batches of polysorbate 60 using MS and NMR techniques / H.V. Dang, A.I. Gray, D. Watson, C.D. Bates, P. Scholes, G.M. // Journal of Pharmaceutical and Biomedical Analysis. 2006; Vol. 40 (I.5): 1155–1165.
- ЗZenkevich I.G., Morozova T.E. Features of the standard additive method for quantitative determination of analytes in complex matrices with sorption properties // Analytics and Control. 2010; (3): 164–171. (In Russ.)
- Weber A. et al. Method for determining polysorbate. 2016. (In Russ.)
- Lippold S. et al. Impact of mono-and poly-ester fractions on polysorbate quantitation using mixed-mode HPLC-CAD/ELSD and the fluorescence micelle assay // Journal of Pharmaceutical and Biomedical Analysis. 2017; Vol. 132: 24–34.
- Askretkov A.D. Determination of polysorbates by spectrophotometry in drugs based on recombinant proteins / A.D. Askretkov, P.M. Isaykina, S.A. Cherepushkin, N.V. Orlova // Development and registration of medicines. 2017; (3): 124–129. (In Russ.)
- Khossravi M. et al. Analysis methods of polysorbate 20: A new method to assess the stability of polysorbate 20 and established methods that may overlook degraded polysorbate 20 // Pharmaceutical research. 2002; Vol. 19 (5): 634–639.
- Lapelosa M., Patapoff T. W., Zarraga I. E. Molecular simulations of micellar aggregation of polysorbate 20 ester fractions and their interaction with N-phenyl-1-naphthylamine dye //Biophysical chemistry. 2016; Vol. 213: 17–24.
- Rowe R. C., Sheskey P., Quinn M. Handbook of pharmaceutical excipients. – LibrosDigitales-Pharmaceutical Press, 2009.
