REGULATION OF CIRCULATION OF MEDICAL DEVICES
The article is devoted to the preparation of the registration dossier in order to amend the registration documents in connection with the entry into force of the Decree of the Government of the Russian Federation dated 01.04.2022 No. 552 “On approval of the specifics of circulation, including the specifics of state registration, of medical devices in case of their defect or risk of defect in connection with the introduction of economic restrictive measures against the Russian Federation”.
1 — Federal Service for Surveillance in Healthcare, 4, bld. 1, Slavyanskaya Square, Moscow, 109074, Russian Federation.
The article is devoted to the preparation of the registration dossier in order to amend the registration documents in connection with the entry into force of the Decree of the Government of the Russian Federation dated 01.04.2022 No. 552 “On approval of the specifics of circulation, including the specifics of state registration, of medical devices in case of their defect or risk of defect in connection with the introduction of economic restrictive measures against the Russian Federation”.
Keywords: medical devices, features of the circulation of medical devices in the event of a defect, making changes to the registration dossier, features of state registration of medical devices
Особенностями обращения (включая особенности государственной регистрации) медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера, утвержденными постановлением Правительства Российской Федерации от 01.04.2022 № 552 (далее соответственно – Особенности, Постановление), определены особенности обращения медицинских изделий, в том числе особенности государственной регистрации медицинских изделий, а также порядок внесения изменений в документы, содержащиеся в регистрационном досье, на:
- медицинские изделия, указанные в перечне медицинских изделий, подлежащих обращению в соответствии с Постановлением (далее – Перечень), формируемом в соответствии с п. 4 Особенностей;
- медицинские изделия с низкой степенью потенциального риска их применения (за исключением медицинских изделий, выпускаемых в стерильном виде), включенные в Перечень (далее – медицинские изделия с низкой степенью потенциального риска);
- медицинские изделия отечественного производства.
Порядок внесения изменений в документы, содержащиеся в регистрационном досье на медицинское изделие, включенное в Перечень, в соответствии с Особенностями и Правилами государственной регистрации медицинских изделий, утвержденных постановлением Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий» (далее – Правила), приведен в таблице 1.
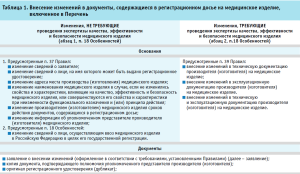

Особенности внесения изменений в документы, содержащиеся в регистрационном досье медицинского изделия с низкой степенью потенциального риска
Постановлением также утверждены Особенности государственной регистрации медицинских изделий с низкой степенью потенциального риска (пункты 23-29 Особенностей).
Вместе с тем, согласно п. 28 Особенностей, внесение изменений в документы, содержащиеся в регистрационном досье медицинского изделия с низкой степенью потенциального риска, осуществляется после принятия решения о государственной регистрации медицинского изделия в соответствии с Правилами.
Особенности внесения изменений в документы, содержащиеся в регистрационном досье на медицинское изделие отечественного производства
В соответствии с Особенностями, под медицинским изделием отечественного производства понимается медицинское изделие, в регистрационном удостоверении на которое, либо в заявлении о государственной регистрации которого в качестве производителя (изготовителя) указано юридическое лицо или физическое лицо, зарегистрированное в качестве индивидуального предпринимателя, являющееся резидентом Российской Федерации, а также имеющее место производства (производственную площадку) на территории Российской Федерации (далее – медицинское изделие отечественного производства). При этом регистрационное удостоверение должно быть выдано в соответствии с Особенностями или Правилами.
К изменениям, вносимым в документы, содержащиеся в регистрационном досье на медицинское изделие отечественного производства, зарегистрированное в соответствии с Особенностями или Правилами, требующими проведения экспертизы качества, эффективности и безопасности медицинского изделия, относятся:
- изменение сведений о покупных изделиях, сырье, материалах и комплектующих;
- изменение сведений о составных частях, запасных частях и принадлежностях.
Для внесения изменений в документы, содержащиеся в регистрационном досье, заявитель не позднее чем через 30 рабочих дней со дня изменения соответствующих данных, представляет в Росздравнадзор:
- заявление;
- копию документа, подтверждающего полномочия уполномоченного представителя производителя (изготовителя);
- документы и сведения о соответствующих изменениях, в том числе документы, подтверждающие изменения и свидетельствующие о том, что внесение этих изменений не влечет за собой изменения свойств и характеристик медицинского изделия, влияющих на его безопасность, качество и эффективность, или совершенствует его свойства и характеристики при неизменности функционального назначения и (или) принципа действия медицинского изделия;
- оригинал регистрационного удостоверения (дубликат);
- документы производителя и (или) организаций, осуществляющих проведение технических испытаний, токсикологических исследований, клинических испытаний (результаты соответствующих испытаний), подтверждающие, что внесение заявленных изменений не влечет изменения свойств и характеристик, влияющих на качество, эффективность и безопасность медицинского изделия, или совершенствует свойства и характеристики при неизменности функционального назначения и (или) принципа действия медицинского изделия, а также позволяющие оценить применяемые методы (методики) и перечень используемого испытательного оборудования;
- опись документов с указанием раздела Особенностей (раздел IV), в соответствии с которым планируется прохождение процедуры внесения изменений в документы, содержащиеся в регистрационном досье.
В случае, если указанные документы составлены на иностранном языке, они представляются с заверенным в установленном порядке переводом на русский язык.
Сроки принятия решения о внесении изменений в документы, содержащиеся в регистрационном досье для регистрационного удостоверения, оформленного в соответствии с Особенностями или Правилами, приведены в таблице 2.

Необходимо отметить, что в соответствии с п. 30 раздела IV Особенностей, возможно осуществление процедуры внесения изменений в документы, содержащиеся в регистрационном досье медицинского изделия отечественного производства, прошедшего государственную регистрацию не только в соответствии с Особенностями, но и в соответствии с Правилами. При внесении изменений в бланк регистрационного удостоверения, оформленного в соответствии с Правилами («бессрочного»), выдается также «бессрочное» регистрационное удостоверение.
Для отечественных производителей медицинских изделий Особенностями предусмотрена возможность при внесении изменений, связанных со сведениями о покупных изделиях, сырье, материалах и комплектующих и о составных частях, запасных частях и принадлежностях, сократить сроки проведения экспертизы до 5 рабочих дней с возможностью представления собственных результатов испытаний.
Кроме того, введение Особенностями положения, позволяющего производителю (изготовителю) или уполномоченному представителю производителя (изготовителя) заверять документы производителя (изготовителя) (при условии наличия и представления в Росздравнадзор документа, подтверждающего полномочия по заверению документов и вступившего в силу до оформления документов), также снижает сроки подготовки регистрационного досье в связи с отсутствием необходимости заверения документов в стране производителя.
Таким образом, Постановлением сформированы подходы к процедуре внесения изменений в регистрационное досье медицинского изделия, позволяющие сократить сроки принятия решения о внесении изменений в документы, содержащиеся в регистрационном досье, по сравнению с Правилами.
