ИННОВАЦИОННЫЕ МЕДИЦИНСКИЕ ТЕХНОЛОГИИ
Взаимодействие Новосибирского НИИТО им. Я.Л. Цивьяна с промышленным партнером по направлению аддитивных технологий в нейрохирургии
1 — ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России, 630091, Российская Федерация, г. Новосибирск, ул. Фрунзе, д. 17.
ORCID: https://orcid.org/0000-0001-9231-5891
2 — ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России, 630091, Российская Федерация, г. Новосибирск, ул. Фрунзе, д. 17.
ORCID: https://orcid.org/0000-0002-0903-7278
3 — ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России, 630091, Российская Федерация, г. Новосибирск, ул. Фрунзе, д. 17.
ORCID: https://orcid.org/0000-0003-1065-1248
4 — ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России, 630091, Российская Федерация, г. Новосибирск, ул. Фрунзе, д. 17.
ORCID: https://orcid.org/0000-0003-1572-0089
5 — ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России, 630091, Российская Федерация, г. Новосибирск, ул. Фрунзе, д. 17.
ORCID: https://orcid.org/0000-0003-1911-9741
Опыт Новосибирского НИИТО может послужить одним из примеров, демонстрирующих возможности трансфера новых технологий от идеи до внедрения в практику путем взаимодействия научной медицинской организации и промышленного партнера в интересах решения приоритетного направления «Персонализированная медицина, высокотехнологичное здравоохранение и технологии здоровьесбережения»1. Благодаря современным технологиям применения 3D-печати в медицине, появилась возможность производства индивидуальных имплантатов, позволяющих закрывать посттрепанационные дефекты любой сложности и площади. В Новосибирском НИИТО в рамках выполнения темы государственного задания, а также клинической апробации была разработана методика восстановления дефектов костей черепа. К настоящему времени специалистами учреждения накоплен опыт более 150 реконструктивных операций с применением индивидуальных титановых имплантатов, полученных с помощью аддитивных технологий. В статье прослежен путь от идеи применения 3D-технологии, проведения этапов исследования, регистрации патентного права на способы лечения, проведения клинической апробации до последующего внедрения в практику с механизмом передачи ее использования промышленному партнеру согласно лицензионному соглашению.
Ключевые слова: инновационные медицинские технологии, трансфер медицинских технологий, промышленный партнер, 3D-печать в медицине, индивидуальные титановые имплантаты, восстановление дефектов костей черепа, аддитивные технологии, клиническая апробация, медицинское изделие, высокотехнологичная медицинская помощь, нейрохирургия, краниопластика, научная деятельность, научная организация
Введение
В Российской Федерации в соответствии со ст. 2 Федерального закона от 23 августа 1996 г. № 127-ФЗ «О науке и государственной научно-технической политике» категории «научно-исследовательская деятельность» и «научная деятельность» рассматриваются как тождественные [1]. Научная деятельность – это деятельность, направленная на получение и применение новых знаний. Закон признает три формы научной деятельности:
- фундаментальные научные исследования – экспериментальная или теоретическая деятельность, направленная на получение новых знаний об основных закономерностях строения, функционирования и развития человека, общества, окружающей среды;
- прикладные научные исследования – исследования, направленные преимущественно на применение новых знаний для достижения практических целей и решения конкретных задач;
- поисковые научные исследования – исследования, направленные на получение новых знаний в целях их последующего практического применения (ориентированные научные исследования) и/или на применение новых знаний (прикладные научные исследования) и проводимые путем выполнения научно-исследовательских работ [1].
Целью научной деятельности является получение научного результата – нового знания, приобретенного в процессе фундаментальных или прикладных научных исследований и зафиксированного на носителях научной информации в форме отчета, научной статьи, научного доклада, научного сообщения о проведенной научно-исследовательской работе, научного открытия, опубликованной монографии. Если речь идет о научно-прикладном результате, то это новое конструктивное или технологическое решение, экспериментальный образец, законченное испытание, разработка, которая внедрена или может быть внедрена в практику. Научно-прикладной результат может быть представлен в форме отчета, эскизного проекта, конструкторской или технологической документации на научно-техническую продукцию, натурного образца. Научный результат может быть конечным, промежуточным и побочным [1].
В современных условиях в РФ с точки зрения прикладного значения научная медицинская деятельность трактуется как совокупность процессов, позволяющих получать научный результат с помощью государственных или иных инвестиций. Результатом такой научной деятельности является научное знание, оформленное в виде патента, научной статьи (публикации), научного отчета, квалификационной научной работы (диссертации). С точки зрения практического применения (внедрения) от научных организаций сегодня также требуется доводить все полученные научные разработки (экспериментальные образцы) до какого-либо продукта или медицинского изделия, которое может быть передано для промышленного производства2. Однако осуществить это невозможно без взаимодействия научной организации с промышленным партнером.
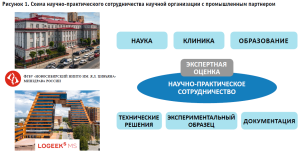
На рис. 1 представлены основные виды деятельности научной организации и ее промышленного партнера. При этом отмечается, что зона ответственности научной организации лежит в выполнении научных исследований и разработок (получение совместно с промышленным партнером экспериментальных образцов), в проведении клинических апробаций и формировании научных кадров, а зона ответственности промышленного партнера состоит в том, чтобы вывести экспериментальный образец на этап промышленного производства. Кроме того, сотрудники научной организации также выполняют функции экспертов на всех этапах подготовки экспериментального и/или опытного образца, а промышленный партнер предлагает технические решения и готовит техническую документацию.
Актуальность медицинского аспекта. Проблема восстановления черепа после различных видов нарушений его целостности остается актуальной по сей день. Дефекты костей черепа могут носить врожденный и приобретенный характер [2]. Наибольшей по численности является группа приобретенных или послеоперационных дефектов (синонимы: посткраниоэктомические, посттрепанационные). Как показали собственные эпидемиологические исследования [3] на примере города Новосибирска ежегодно формируются порядка 165 вновь образованных посттрепанационных дефектов, что соответствует 10,5 случаям на 100 000 населения в год. Наиболее распространенной причиной формирования послеоперационных дефектов костей черепа является черепно-мозговая травма, показатели которой не имеют тенденции к снижению [4–8]. Чаще всего пациенты с приобретенными дефектами костей черепа – люди трудоспособного возраста, вынужденные из-за имеющихся последствий находиться на инвалидности [9–11]. Скорейшая реабилитация и возврат их к трудовой деятельности являются важной социальной и экономической задачей медицины.
Операции по закрытию дефектов костей черепа – краниопластики – можно разделить на две группы: с использованием индивидуальных, заблаговременно изготовленных имплантатов, и с применением стандартных заготовок – титановых сеток или полимерных смесей, которые моделируются и формуются непосредственно во время оперативного вмешательства. С внедрением в практику CAD/CAM-подходов активное развитие получило индивидуальное медицинское производство, суть которого сводится к изготовлению имплантата для конкретного пациента с конкретным дефектом костей черепа на основе цифровых томографических данных. Указанная методика позволяет наиболее точно восстановить анатомию утраченной части черепа, поскольку не существует двух одинаковых пациентов с идентичными дефектами костей черепа.
Коллектив нейрохирургического отделения Новосибирского НИИТО им. Я.Л. Цивьяна накопил существенный опыт в применении индивидуальных имплантатов для закрытия дефектов костей черепа, пройдя путь от применения опосредованных методик создания изделий с применением пресс-форм и анатомических моделей черепа до использования имплантатов из титанового сплава, полученных путем трехмерной металлопечати. Этапы научно-практической работы от идеи до внедрения в практику можно проследить на примере разработки новой медицинской технологии в нейрохирургии.
На начальном этапе в Новосибирском НИИТО было выполнено исследование в рамках государственного задания (номер регистрации – 115071510022) на тему «Разработка персонализированных имплантатов из биосовместимого полимерного материала на основе метода трехмерного моделирования (3D) и печати для проведения реконструктивных операций на костях лицевого и мозгового отделов черепа» (руководитель – профессор В.В. Ступак).
Цель исследования: разработка образцов персонализированных имплантатов из биосовместимого материала для восстановления утраченной структуры костей черепа на основе методов трехмерного компьютерного моделирования с применением методов 3D-печати.
В результате проведенного исследования была создана системная технология разработки и производства индивидуального имплантата для проведения реконструктивных операций на костях лицевого и мозгового отделов черепа из биосовместимых материалов, которая объединяет все стадии производства имплантата в единый цикл, начиная от разработки 3D-модели и заканчивая непосредственным созданием искомого имплантата методом трехмерной печати.
Далее на основе разработанной технологии была запланирована и проведена клиническая апробация3 с применением индивидуальных титановых имплантатов, полученных методом DMLS (Direct Metal Laser Sintering) и порошка титанового сплава (Ti64Eli) на установке аддитивного производства EOS 290.
В ходе проведенных научных исследований и клинической апробации было зарегистрировано 9 патентов на способы хирургического лечения и полезные модели. В последующем при взаимодействии с промышленным партнером (ООО «Логикс») был заключен лицензионный договор № РД 0434124 на право использования нижеприведенных результатов интеллектуальной деятельности (рис. 2):
- Способ хирургической коррекции мальформации Киари I типа и имплантат для пластики дефектов основания черепа / Мишинов С.В., Ступак В.В., Панченко А.А. Патент на изобретение RU 2715454 C1, 28.02.2020. Заявка № 2019107695 от 18.03.2019.
- Имплантат для пластики дефектов основания черепа / Мишинов С.В., Ступак В.В., Панченко А.А. Патент на полезную модель RU 193742 U1, 13.11.2019. Заявка № 2019107687 от 18.03.2019.

Подходы к применению персонализированных краниальных имплантатов начали разрабатываться и внедряться более тридцати лет назад [12].
Сотрудниками Новосибирского НИИТО с 2014 года были исследованы основные методы изготовления индивидуальных изделий для закрытия дефектов костей черепа:
- первый – применение титановых имплантатов, сформованных по пластиковым анатомическим моделям;
- второй – использование полимерных материалов (полиметилметакрилата), отливаемых в пресс-формы;
- третий – оперативные вмешательства с применением титановых имплантатов, получаемых путем трехмерной печати.
Во всех случаях первично на основании компьютерных томографических данных выполнялось построение цифровой трехмерной модели черепа с дефектом, далее в виртуальной среде создавался прототип имплантата, закрывающего имеющийся дефект. В первом случае прототип имплантата служил основой поверхности для формуемого по модели имплантата из титановой сетки, во втором – на основе прототипа создавались пресс-формы, в которые помещался медицинский полимер и после затвердевания представлял собой копию прототипа из биосовместимого пластика, то есть сам по себе являлся искомым имплантатом. В последнем – третьем случае, модель черепа и имплантата получали путем трехмерной печати, методом селективного спекания. Для анатомической модели использовали полиамид, а для имплантата – порошок титанового сплава (Ti64Eli). Таким образом, лишь в последнем случае искомый имплантат получали, минуя промежуточные изделия, анатомические модели или пресс-формы. Данная методика в ходе теоретических исследований была признана оптимальной для проведения реконструктивных нейрохирургических вмешательств, что послужило основой для проведения дальнейших исследований.
За период с 2016 по 2022 годы на базе нейрохирургического отделения Новосибирского НИИТО им. Я.Л. Цивьяна было выполнено 151 хирургическое вмешательство (в том числе и в рамках клинической апробации № 40-1) с применением индивидуальных титановых имплантатов, полученных методом DMLS (Direct Metal Laser Sintering) и порошка титанового сплава (Ti64Eli) на установке аддитивного производства EOS 290. Исходы оперативных вмешательств сравнивались с проводимыми в аналогичный период времени краниопластиками с применением стандартных сеток из титанового сплава у 123 пациентов.
В ходе проводимого исследования не было получено значимых различий между исследуемыми подгруппами в частоте хирургических осложнений и количеству потерь имплантатов. Оперативные вмешательства с применением индивидуальных изделий статистически достоверно выполнялись быстрее и требовали меньшего количества винтов для фиксации.
Примеры реконструкции дефектов костей черепа при выполнении клинической апробации по применению пластин для краниопластики (апробация № 40-1) и внешнего вида трансплантатов приведены на рис. 3–4.
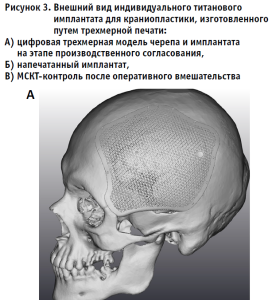
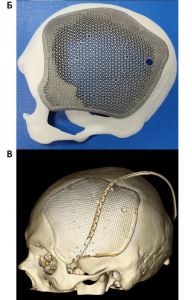
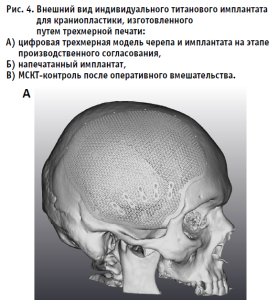
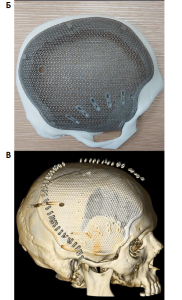
Помимо указанных выше преимуществ, индивидуальные имплантаты для краниопластики имеют ряд уникальных свойств, потенциально способных улучшать исходы хирургических вмешательств. Так, одним из частых явлений является развивающаяся в отдаленном послеоперационном периоде атрофия височной мышцы на стороне дефекта. Изменение кривизны имплантата и компенсация за счет этого утрачиваемой массы мышцы позволяет нивелировать данное состояние и достигать хороших косметических исходов оперативных вмешательств [13].
В дизайн имплантатов, получаемых путем трехмерной печати, можно добавлять различные дополнительные элементы (направляющие для позиционирования имплантата, дополнительные дренажные или фиксирующие отверстия, ребра жесткости и т.п.). Подобные конструктивные составляющие возможно получить только на установках аддитивного производства.
Трехмерная печать позволяет создавать как индивидуальные конструкции, так и мелкосерийные партии изделий, имеющих сложную геометрию. В ходе исследований, проведенных сотрудниками Новосибирского НИИТО, была предложена концепция реконструкции задней черепной ямки при мальформации Киари I типа у взрослых с применением специального титанового имплантата, получаемого путем трехмерной печати. Пилотное исследование продемонстрировало хорошие исходы оперативных вмешательств [14], а разработанная концепция была предложена для проведения клинической апробации метода.
Рассмотрев детально медицинский аспект деятельности по разработке новой медицинской технологии следует отметить, что для внедрения новшества приходится проделывать достаточно кропотливую и длительную работу, основные этапы которой наглядно представлены на рис. 5.
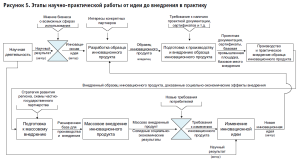
Основные этапы внедрения новой технологии (разработки) включают в себя следующее: изготовление опытного образца изделия медицинского назначения; получение разрешения на проведение доклинических и клинических испытаний; доклинические испытания; клинические испытания; регистрация в Росздравнадзоре; лицензирование вида деятельности; сертификация по ГОСТ; регистрация технологии; организация производства; массовое внедрение.
При этом следует различать зоны компетенций научной медицинской организации и промышленного партнера, а отсутствие их взаимодействия, как правило, приводит к существенному увеличению сроков выпуска новой технологии или разработки, готовой к внедрению в практическое здравоохранение [15].
Заключение
На примере производства индивидуальных имплантатов, использующего современные возможности 3D-печати в медицине для краниопластики при посттрепанационных дефектах любой сложности и площади, прослежен путь от выполнения этапов научного исследования, регистрации патентного права на полученные результаты исследований и проведения клинической апробации до этапа внедрения инновационной технологии в практику с механизмом передачи ее использования промышленному партнеру.
Опыт работы Новосибирского НИИТО им. Я.Л. Цивьяна демонстрирует возможности трансфера новых технологий от идеи до внедрения их в практику при условии тесного взаимодействия с промышленным партнером в интересах внедрения приоритетного направления «Персонализированная медицина, высокотехнологичное здравоохранение и технологии здоровьесбережения».
_____________________________________________________________________
1 URL: http://government.ru/news/39053/
2 Распоряжение Правительства Российской Федерации от 20 мая 2023 г. № 1315-р. URL: http://publication.pravo.gov.ru/document/0001202305250050 (дата обращения: 21.09.2021).
3 Приказ Минздрава России от 10.07.2015 № 433н «Об утверждении Положения об организации клинической апробации методов профилактики, диагностики, лечения и реабилитации и оказания медицинской помощи в рамках клинической апробации методов профилактики, диагностики, лечения и реабилитации (в том числе порядка направления пациентов для оказания такой медицинской помощи), типовой формы протокола клинической апробации методов профилактики, диагностики, лечения и реабилитации» (ред. от 14.01.2016).
- Большая Российская Энциклопедия. URL: https://bigenc.ru/c/nauchnaia-deiatel-nost-d3b3c3 (дата обращения: 21.09.2023).
- Потапов А.А., Кравчук А.Д., Лихтерман Л.Б. и др. Реконструктивная хирургия дефектов черепа. Клинические рекомендации. М., 2015. 22 с.
- Этиология и эпидемиология приобретенных дефектов костей черепа, полученных при различной патологии центральной нервной системы, и число больных, нуждающихся в их закрытии, на примере крупного промышленного города / Н.А. Копорушко, В.В. Ступак, С.В. Мишинов [и др.] // Современные проблемы науки и образования. – 2019. – № 2. – С. 120.
- Capizzi A. Traumatic brain injury: an overview of epidemiology, pathophysiology, and medical management / A. Capizzi, J. Woo, M. Verduzco-Gutierrez // Medical Clinics of North America. – 2020. – Vol. 104, № 2. – P. 213–238. – DOI.: 10.1016/j.mcna.2019.11.001.
- Epidemiology of traumatic brain injuries at a rural-serving Level II trauma center, 2004 – 2016 / C. A. McCarty, C. M. Renier, T.A. Woehrle [et al] // Brain Injury. – 2022. – Vol. 36, № 1. – P. 87–93. DOI: 10.1080/02699052.2022.2034948.
- Epidemiology of traumatic brain injury in Europe: a living systematic review/ A. Brazinova, V. Rehorcikova, M.S. Taylor [et al] // Journal of Neurotrauma. – 2021. – Vol. 38, № 10. – P. 1411–1440. DOI 10.1089/neu.2015.4126.
- Prospective observational cohort study on epidemiology, treatment and outcome of patients with traumatic brain injury (TBI) in German BG hospitals / P. Schwenkreis, A. Gonschorek, F. Berg [et al.] // BMJ Open. – 2021. – Vol. 11, № 6. – e 045771. DOI: 10.1136/bmjopen-2020-045771.
- Toccalino D. Update on the epidemiology of work-related traumatic brain injury: a systematic review and meta-analysis / D. Toccalino, A. Colantonio, V. Chan // Occupational and Environmental Medicine. – 2021. – Vol. 78, № 10. – P. 769–776. DOI: 10.1136/oemed-2020-107005.
- Фейгин А.В., Золотенкова Г.В., Горелкин Д.Г., Романько Н.А., Тархнишвили Г.С. Конструкционные переломы свода черепа с резко выраженными дегенеративными изменениями костной ткани // Судебная медицина. 2015. Т. 1. №. 1. С. 35–38.
- Виноградов А.А., Андреев, И.В., Орзулова Е.В., Бондаренко О.В. Краниотопография теменной кости свода черепа человека // Вестник Луганского национального университета им. Тараса Шевченко. Биологические науки. 2013. № 19 (1). С. 79–85.
- Moon J.W., Hyun D.K. Decompressive Craniectomy in Traumatic Brain Injury: A Review Article. Korean journal of neurotrauma. 2017. Vol. 13. no. 1. P. 1–8.
- Ono I., Gunji H., Kaneko F., Numazawa S., Kodama N., Yoza S. Treatment of extensive cranial bone defects using computerdesigned hydroxyapatite ceramics and periosteal flaps. Plast Reconstr Surg. 1993; 92(5): 819–830. PMID: 8415963.
- Патент № 2740567 C1 Российская Федерация, МПК A61F2/28, A61B 17/80. Способ изготовления имплантата для замещения дефектов костей черепа при грубых косметических дефектах в височной области и имплантат для замещения дефектов костей черепа при грубых косметических дефектах в височной области : № 2020107411 : заявл. 18.02.2020 : опубл. 15.01.2021 / Н.А. Копорушко, В.В. Ступак, С.В. Мишинов ; заявитель Федеральное государственное бюджетное учреждение «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Министерства здравоохранения Российской Федерации.
- A titanium implant for Chiari malformation Type 1 surgery / S. Mishinov, V. Stupak, A. Samokhin, A. Panchenko // Surgical Neurology International. 2021. Vol. 12. No. 42. DOI 10.25259/SNI_960_2020.
- Кирилова И.А., Садовой М.А., Подорожная В.Т., Мамонова Е.В., Аронов А.М. Этапы формирования инновационного продукта на примере лаборатории «Банк биотканей» // Хирургия позвоночника. 2013. № 1. С. 89–93.
