ЛЕКАРСТВЕННОЕ ОБЕСПЕЧЕНИЕ
Тенденции и проблемные аспекты в деятельности фармацевтических дистрибьюторов Свердловской области
1 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Свердловской области, 620014, Российская Федерация, г. Екатеринбург, ул. Попова д. 30.
2 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 620028, Российская Федерация, Свердловская обл., г. Екатеринбург, ул. Репина, д. 3.
3 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Свердловской области, 620014, Российская Федерация, г. Екатеринбург, ул. Попова д. 30.
Обращение лекарств на этапе дистрибуции является важным этапом в обеспечении качества медикаментов. С целью формирования подходов к профилактической деятельности проанализирована деятельность территориального органа Росздравнадзора по Свердловской области в отношении фармацевтических оптовых организаций в период с начала 2018 года по I квартал 2024 года.
В результате установлено, что дистрибьюторами уделяется недостаточное внимание в отношении организации входных групп; состояния помещений; валидации процесса перевозки. Набирает актуальность проблема, связанная с формализованным подходом к разработке системы менеджмента качества.
Выявленные по результатам анализа контрольные точки целесообразно адаптировать к профилактической и информационной деятельности территориального органа Росздравнадзора.
Ключевые слова: оптовые фармацевтические организации, фармацевтическая деятельность, лекарственные средства, федеральный государственный контроль
Введение
Оптовые фармацевтические организации играют ключевую роль как посредники между производителями и конечными потребителями фармацевтической продукции. Роль дистрибьюторов не ограничивается исключительно поставкой товаров от производителей к аптекам или медицинским организациям, они также выполняют важные функции по обеспечению качества продукции посредством организации надлежащего приемочного контроля, хранения и транспортировки лекарственных препаратов (ЛП).
Надежные дистрибьюторы способствуют укреплению цепочки поставок ЛП, обеспечивая пациентам доступ к качественным и безопасным медикаментам. Их роль в обеспечении эффективного движения лекарств от производства до конечного потребителя неоценима для стабильного развития фармацевтической отрасли [1].
Стандарты качества работы фармацевтических дистрибьюторов выдвигают четкие требования к условиям транспортировки и хранения ЛП, направленные на обеспечение безопасности при их применении [2]. Соблюдение утвержденных требований в сфере обращения ЛП организациями оптовой торговли контролируется Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами в рамках федерального государственного контроля (надзора) в сфере обращения лекарственных средств посредством проведения контрольно-надзорных (далее – КНМ) и профилактических мероприятий (далее – ПМ).
За последние годы особая роль возложена на осуществление ПМ в отношении субъектов обращения ЛП.
Однако для формирования эффективных подходов к планированию и проведению ПМ в существующем широком спектре утвержденных требований необходимо сформировать представление о ключевых проблемных вопросах относительно деятельности подконтрольных организаций на территории региона.
Цель работы
Определить ключевые проблемные точки в деятельности фармацевтических организаций оптовой торговли лекарственными средствами посредством анализа результатов контрольно-надзорной деятельности территориального органа Росздравнадзора по Свердловской области (ТО Росздравнадзора по СО) за период с начала 2018 года по I квартал 2024 года.
Материалы и методы
Информационной базой исследования служили результаты КНМ, проведенных ТО Росздравнадзора по СО в рамках федерального государственного контроля (надзора) в сфере обращения лекарственных средств в период с начала 2018 года по I квартал 2024 года включительно в отношении фармацевтических организаций оптовой торговли.
Всего за указанный период состоялось 54 проверочных мероприятия (за исключением мероприятий по выборочному контролю) в отношении оптовых фармацевтических организаций, из них: 23 плановых и 31 внеплановых проверки; 19 документарных и 35 выездных КНМ.
Таким образом, в рамках исследования было проанализировано 54 акта проверки и сопровождающие их протоколы осмотра.
Дополнительно проведена оценка деятельности ТО Росздравнадзора по СО в отношении мероприятий по выборочному контролю (далее – ВК) качества ЛП, отобранных для экспертизы в оптовых фармацевтических организациях, посредством анализа локальных журналов ТО Росздравнадзора по СО по регистрации результатов ВК, а также протоколов испытаний и экспертных заключений по результатам проведенных экспертиз.
Сведения о всех проведенных КНМ размещены в соответствующих федеральных государственных информационных системах с соблюдением цифровых компетенций надзорным органом: до 1 июля 2021 года (за исключением выборочного контроля) размещены в Едином реестре проверок; после 1 июля 2021 года – в Едином реестре контрольных (надзорных) мероприятий с присвоением QR-кода, обеспечивающим переход на страницу в сети «Интернет», содержащую запись о КНМ.
Сбор и обработка данных проведена с использованием инструментов MS Exel 2010.
Результаты и обсуждение
Согласно Единому реестру лицензий, лицензия на фармацевтическую деятельность в части осуществления работ и услуг по оптовой торговле лекарственными средствами (ЛС) имеется у 78 организаций, чьи объекты осуществления деятельности размещены на территории Свердловской области.
ТО Росздравнадзора по СО в период с начала 2018 года по март 2024 года проведено 54 проверочных мероприятия федерального государственного контроля (надзора) в сфере обращения ЛС (без учета мероприятий по выборочному контролю), из них:
- 19 документарных (35,2%) и 35 выездных КНМ (64,8%);
- 23 плановых проверки (42,6%) и 31 внеплановая проверка (57,4).
В большинстве случаев (64,5%) поводом для инициирования внепланового КНМ служило истечение срока исполнения решения контрольного (надзорного) органа об устранении выявленного нарушения обязательных требований; в остальных случаях (35,5%) КНМ инициировались в связи с поступлением в ТО Росздравнадзора по СО сведений о причинении вреда или об угрозе причинения вреда охраняемым законом ценностям, выявляемых в рамках рассмотрения обращений граждан и организаций или сведений, поступивших от органов государственной власти.
Количественное соотношение проведенных КНМ и проверок, в рамках которых были выявлены нарушения, наглядно отражены на рисунке 1.
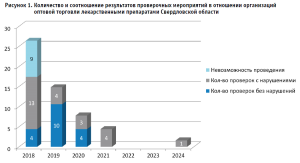
Как следует из рисунка 1, в 2022 и 2023 гг. в отношении оптовых фармацевтических организаций ТО Росздравнадзора по СО КНМ (за исключением ВКК ЛС) не проводились в связи с особенностями организации и осуществления государственного контроля (надзора), определенными постановлением Правительства РФ от 10.03.2022 № 336.
Также имеется очевидная тенденция на сокращение КНМ в отношении оптовых организаций ЛС, вместе с тем отмечается повышение их эффективности ввиду увеличения процента выявляемых нарушений от общего количества проведенных КНМ.
Такая динамика объясняется реформированием контрольно-надзорной деятельности, что предусматривает переход на риск-ориентированный подход с концентрацией проверок там, где выше риски для безопасности граждан и усиление мер по профилактике нарушений.
Проведение КНМ в рамках федерального государственного контроля (надзора) в сфере обращения ЛС до 1 июля 2021 года регулировалось Федеральным законом от 26.12.2008 № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» и постановлением Правительства Российской Федерации от 15.10.2012 № 1043 «Об утверждении Положения о федеральном государственном надзоре в сфере обращения лекарственных средств»; после 1 июля 2021 года – Федеральным законом от 31.07.2020 № 248-ФЗ «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации» и постановлением Правительства РФ от 29.06.2021 № 1049 «О федеральном государственном контроле (надзоре) в сфере обращения лекарственных средств».
В рамках представляемого анализа, изложенные в актах проверок нарушения были условно разделены на следующие группы:
- проблемы, связанные с высокими рисками негативного воздействия окружающих факторов на ЛП;
- вопросы эксплуатации оборудования, оказывающего влияние на хранение и перевозку ЛС;
- функционирование СМК;
- зонирование помещений склада;
- организация перевозки;
- работа с ЛП, подлежащими предметно-количественному учету;
- оформление товарно-сопроводительной документации;
- наличие квалифицированного персонала;
- внесение данных в систему мониторинга движения лекарственных препаратов (ФГИС МДЛП).
Результаты анализа актов проверочных мероприятий в отношении фармацевтических организаций оптовой торговли Свердловской области отражены на рисунке 2 и 3.
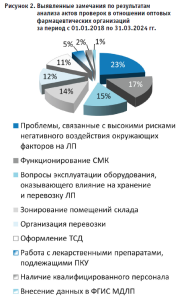
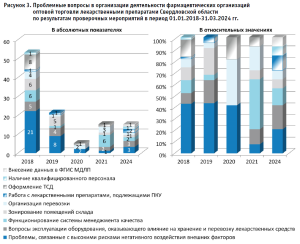
Нарушения, связанные с высокими рисками негативного воздействия окружающих факторов на ЛП, прежде всего, выражались в ненадлежащей организации входных групп, что влечет за собой высокие риски негативного воздействия на ЛП перепадов температур и атмосферных осадков при проведении погрузочно-разгрузочных работ; состоянии зон хранения и приемки ЛП, провоцирующим нарушение санитарного состояния помещений; отклонениях температурного режима в зонах хранения медикаментов и отсутствии ежедневной фиксации параметров температуры и влажности.
Вопросы эксплуатации оборудования, оказывающего влияние на хранение и перевозку ЛС, проявлялись в отсутствии: температурного картирования и оборудования для его проведения; системы и устройств для оперативного выявления нарушений условий хранения; неправильной эксплуатации средств измерения параметров воздуха; отсутствии валидированной системы допуска и т.д.
При оценке зонирования также выявлялись случаи отсутствия специально оборудованных зон для хранения огнеопасных ЛП (при наличии на складе таковых), зоны приемки, зон для изолирования выявленных фальсифицированных, недоброкачественных, контрафактных ЛП и т.д.
Также отмечается недостаточное внимание организаций оптовой торговли на состояние и применимость СМК. Формализованный подход к СМК может быть ярко продемонстрирован следующими ситуациями:
- в стандартных операционных процедурах фигурирует используемое в отношении ряда процессов оборудование, однако, фактически такое оборудование на складе отсутствует и ранее не приобреталось;
- в локальных документах указана необходимость заполнения перечня документов, однако фактически формы в работу организации не внедрены;
- перед передачей деятельности (по перевозке) на аутсорсинг не осуществляется оценка организации на предмет возможности им выполнения такой деятельности; не осуществляется периодический контроль организации, которой передана деятельность на аутсорсинг;
- персонал, принимающий участие в процессах при работе с ЛП, с соответствующими процедурами не ознакомлен.
Относительно новой контрольной точкой можно назвать необходимость повышенного внимания со стороны дистрибьютора в отношении актуальности и достоверности сведений, вносимых в ФГИС МДЛП. Применение информационной системы является важнейшей составляющей в деятельности территориальных органов Росздравнадзора. Использование ФГИС МДЛП позволяет как оценивать запасы ЛП, так и осуществлять контроль за случаями передачи медикаментов, оборот которых приостановлен или прекращен [3,4]. В связи с чем дистрибьютору особенно важно освоить работу в ФГИС МДЛП и грамотно ее использовать для достоверного и своевременного внесения данных о движении ЛП.
Помимо проверочных мероприятий, ТО Росздравнадзора по СО реализуется выборочный контроль (ВК) ЛП, в том числе в организациях оптовой торговли. КНМ представляет собой мероприятие по отбору определенных позиций ЛС для их последующей передачи в экспертную организацию с целью проведения экспертизы с применением неразрушающих и разрушающих методов анализа.
С 1 июля 2021 года ВК осуществлялся как отдельный вид КНМ в рамках Федерального закона от 31.07.2020 № 248-ФЗ. Как правило, основанием для включения ВК или КНМ в спектр осуществляемых контрольно-надзорных действий, при проведении которых осуществляются «отбор образцов» и «экспертиза», являются: программа проверок, план проверок, поступление сведений о причинении вреда или об угрозе причинения вреда охраняемым законом ценностям, выявляемых в ходе рассмотрения обращений граждан и организаций или сведений, поступивших от органов государственной власти.
Как следует из рисунка 4, каждый третий выезд с целью проведения ВК ЛС осуществляется в организациях оптовой торговли ЛС. Отбор более половины образцов (в период с 01.01.2018 по 31.12.2023) ТО Росздравнадзора по СО был произведен именно на складах дистрибьюторов.
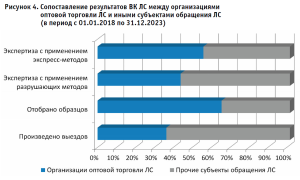
Значительные объемы и разнообразие медикаментов, хранящихся в оптовых фармацевтических организациях, позволяют осуществить отбор широкого ассортимента ЛС для проведения экспертизы качества, и при необходимости принять меры по предотвращению их дальнейшего перемещения в медицинские и аптечные организации.
Выводы
Исходя из вышеизложенного можно сделать выводы о повышении эффективности проводимых надзорных мероприятий ТО Росздравнадзора по СО в отношении организаций оптовой торговли ЛП за анализируемый период, что выражается в сокращении КНМ и росте процента организаций, в которых по результатам проверок были выявлены нарушения установленных требований.
В результате оценки результатов проведенных КНМ выявлено, что в настоящее время наблюдается недостаточное внимание со стороны фармацевтических дистрибьюторов в отношении организации процессов загрузки и разгрузки; состояния складских помещений и транспортировки медикаментов. В последнее время также отмечается, что оптовые компании не уделяют должного внимания разработке и внедрению СМК, а также достоверному и своевременному внесению данных в ФГИС МДЛП. Все вышеперечисленные аспекты в той или иной мере могут повлиять не только на качество осуществления фармацевтической деятельности, но и, как следствие, способствовать снижению качества реализуемой продукции.
Кроме того, ТО Росздравнадзора по СО уделяется особое внимание оптовым фармацевтическим организациям при организации мероприятий по контролю качества ЛС: каждый третий выезд с целью проведения экспертизы продукции осуществляется именно в отношении дистрибьюторов.
Обнаруженные по результатам исследования контрольные точки могут быть использованы как организациями оптовой торговли ЛС, так и контрольными органами в целях формирования эффективных подходов к развитию профилактической деятельности.
Так, по результатам исследования, целесообразно разработать стратегии/ сценарии или чек-листы для проведения профилактических визитов, а также контент-план информационной деятельности контрольного органа, которые ориентированы, прежде всего, на характерные для региона проблемные точки в функционировании оптовых организаций.
- Халатян С.Г. Развитие оптовых структур фармацевтического рынка ЮФО: логистический аспект / С.Г. Халатян // Региональная экономика: теория и практика. – 2012. – № 4 (235). – С. 51–56.
- Колипова Ю. Российская дистрибьюция: особый путь развития? / Ю. Колипова // Ремедиум. – 2003. – № 12. – С. 71–73.
- Самойлова А.В., Кудрявцева Е.М. Федеральная государственная информационная система мониторинга движения лекарственных препаратов для медицинского применения – цифровой инструмент в сфере контроля за обращением лекарственных средств // Вестник Росздравнадзора. – 2022. – № 3. – С. 6–15.
- Полинская Т.А., Шишов М.А. Роль информационной системы мониторинга движения лекарственных препаратов в деятельности территориального органа Росздравнадзора // Вестник Росздравнадзора. – 2023. – №4. – С. 75–79.
