ИНФОРМАЦИОННЫЕ ТЕХНОЛОГИИ И ЦИФРОВИЗАЦИЯ ЗДРАВООХРАНЕНИЯ
Стратегии цифровизации фармаконадзора ЕАЭС в 2020–2030 годы: автоматизация мониторинга, сбора и анализа информации по безопасности лекарственных препаратов
1 — Научное медицинское агентство «Литобзор», 117036, Российская Федерация, г. Москва, ул. Профсоюзная, д. 3.
2 — Государственное бюджетное учреждение здравоохранения Московской области «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», 129110, Российская Федерация, г. Москва, ул. Щепкина, д. 61/2.
3 — Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109074, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр. 1.
4 — Научное медицинское агентство «Литобзор», 117036, Российская Федерация, г. Москва, ул. Профсоюзная, д. 3.
5 — Федеральное государственное автономное образовательное учреждение высшего образования «Российский университет дружбы народов имени Патриса Лумумбы», 117198, Российская Федерация, г. Москва, Миклухо-Маклая ул., д. 6.
В Российской Федерации внедрена комплексная программа цифровой трансформации, которая реализуется в рамках стратегических инициатив, закрепленных в ключевых указах Президента Российской Федерации В.В. Путина: № 203 «О Стратегии развития информационного общества в Российской Федерации на 2017-2030 годы» и № 309 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года». Эти нормативные акты формируют концептуальную основу для системного подхода к цифровизации различных сфер общественной жизни, что является важным элементом государственной политики в области инновационного развития и повышения конкурентоспособности страны. Государственные программы направлены на внедрение информационно-коммуникационных технологий во всех формах собственности, развитие электронного документооборота, обеспечение кибербезопасности, управление большими данными, применение искусственного интеллекта и создание платформ для эффективного сбора информации и прозрачного взаимодействия граждан и отраслевых участников.
В статье рассмотрены основные стратегии цифровизации фармаконадзора ЕАЭС: цифровизация и бизнес-процессы в фармаконадзоре, компьютеризированные системы для критических процессов фармаконадзора и др. Анализируются трудности, связанные с внедрением информационных технологий в бизнес-процессы, и подчеркивается, что, несмотря на препятствия, инвестиции в компьютеризированные системы способствуют значительному улучшению качества фармаконадзора на предприятии.
Ключевые слова: фармаконадзор, цифровизация процессов фармаконадзора, компьютеризированные системы для критических процессов фармаконадзора, автоматизированные системы фармаконадзора
Введение
Цифровизация или цифровая трансформация является закономерным этапом развития деятельности общественных институтов. Цифровизацию стоит определять как процесс внедрения и использования современных информационных и вычислительных технологий с целью оптимизации бизнес-процессов, улучшения предоставляемых услуг, увеличения производительности и конкурентоспособности организаций и общества в целом.
Принятие и реализация цифровых стратегий развития являются глобальным трендом как на уровне международных организаций (таких, как ООН), так и на уровне отдельных государств. Так, на уровне ООН на данный момент сформулирована и реализуется цифровая стратегия развития 2022-2025, которая служит одной из инфраструктурных составляющих реализации целей устойчивого развития. На уровне Российской Федерации также реализуется концепция цифровой трансформации во исполнение указов Президента Российской Федерации В.В. Путина от 09.05.2017 № 203 «О Стратегии развития информационного общества в Российской Федерации на 2017–2030 годы» и от 07.05.2018 № 309 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года». В Казахстане существует аналогичная программа с горизонтом планирования на 2023–2029 годы. Аналогичные программы реализуются на территории всех стран-участниц ЕАЭС.
Основными направлениями в рамках подобных программ является реализация на государственном уровне задач по внедрению информационно-коммуникационных технологий в учреждениях различных форм собственности, развитие электронного обмена между учреждениями, кибербезопасность, управление большими данными, внедрение искусственного интеллекта и создание государством платформ для обеспечения эффективного сбора данных и прозрачного взаимодействия граждан и отраслевых участников между собой.
Стоит отметить, что, как орган контрольно-надзорной деятельности, Росздравнадзор является ролевой моделью для многих аналогичных учреждений в других отраслях, так как существенно усовершенствована система лабораторного анализа лекарственных препаратов, создана и успешно функционирует система для сбора, анализа и обмена информацией в E2BR3 формате между участниками рынка и уполномоченным органом, а последний с использованием этого формата обменивается данными с Центром мониторинга Уппсалы (база данных VigiBase)[5]. Таким образом, на уровне государства последовательно реализуется политика по внедрению цифровых средств для обмена информацией между участниками рынка и уполномоченным органом.
Однако на уровне самих учреждений-держателей регистрационных удостоверений внедрение цифровых решений для реализации рутинных процедур фармаконадзора зачастую сталкивается не только с проблемами организационного характера, но и кадровой укомплектованности, низкой осведомленности специалистов фармаконадзора о порядке внедрения программных решений и осуществления жизненного цикла данных по безопасности лекарственных препаратов.
Цифровизация и бизнес-процессы в фармаконадзоре
Усилия международного научного сообщества в области безопасности и эффективности лекарственных препаратов превратили мониторинг в последовательный, воспроизводимый и результативный процесс.
Вред, который приносят потенциально опасные лекарственные препараты, был угрозой общественному здоровью на протяжении долгих лет, однако с учетом развития законодательства в сфере фармаконадзора, особенно с 2010 года (Directive 2010/84/EU; Regulation (EU) No 1235/2010), удалось создать ключевой документ – GVP (надлежащая практика фармаконадзора). С 2014 года документ стал обязательным для стран-участниц ЕАЭС, в 2022 году документ претерпел вторую редакцию в Союзе.
Надлежащая практика фармаконадзора пронизана процессным подходом, с рекомендациями по составу процедур, ответственными ролями и ожидаемыми результатами. Таким образом, процедуры в рамках надлежащей практики фармаконадзора стали логичным компонентом систем менеджмента качества в традициях ГОСТ 9001 и пр. Как таковую систему можно успешно реализовать даже без использования каких-либо электронных сервисов, однако такой подход не является масштабируемым и при выведении новых продуктов в организации или изначально большом количестве лекарственных препаратов ведет к накоплению ошибок и потере данных [10].
Практически весь процесс фармаконадзора, от выявления спонтанных сообщений до различного рода отчетности и идентификации сигналов по безопасности, возможно автоматизировать [11].
При этом стоит учитывать, что основными источниками информации о профиле безопасности лекарственных препаратов являются сами потребители медицинских продуктов, медицинские и фармацевтические работники, клинические исследования различных фаз, рутинная клиническая практика, уполномоченные органы и литературные источники [2]. С развитием цифровизации большое значение приобретают различного рода электронные базы данных (Real-World Data, RWD) [2].
Компьютеризированные системы для критических процессов фармаконадзора
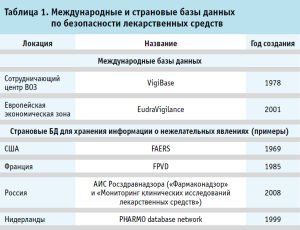
Для понимания трендов внедрения компьютеризированных систем (КС) в фармаконадзоре стоит выделить общие исторические этапы развития контроля качества лекарственных препаратов. Потребность в КС появилась относительно недавно в общей исторической перспективе. Таким этапом развития стала гармонизация надлежащих практик GxP между крупными наднациональными и национальными центрами, взаимное сближение стандартов ICH, элементов стандартов ISO и практик надлежащей деятельности [4, 17]. Помимо национальных центров мониторинга нежелательных явлений под эгидой Всемирной организации здравоохранения был создан отдельный сотрудничающий центр (англ. – collaborative centre) Центр мониторинга Уппсалы (англ. – Uppsala Monitoring Center, UMC) (Швеция), ответственный с 1978 года за ведение базы данных нежелательных явлений. На данный момент UMC – самая крупная международная профильная инициатива, объединяющая 110 государств-членов, в том числе и Российскую Федерацию. С 1991 года информационная система UMC стала доступна для онлайн-доступа, с 2004 года стартовал VigiBase online project (теперь – VigiFlow).
Примеры страновых и международных инициатив представлены в таблице 1.
Внедрение надлежащих практик фармаконадзора, а также необходимость удобного формата обмена с регуляторными органами способствовали развитию внутренних баз нежелательных явлений ДРУ, сочетающих в себе такой функционал, как: заведение случая, поиск сигналов, версионирование, контроль изменений, защита записей и прочее [1].
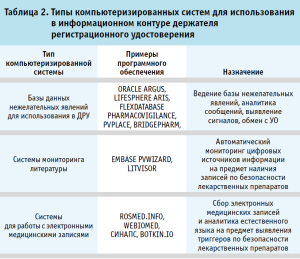
Также существуют специально разработанные системы автоматизированного мониторинга научной медицинской информации. Системы позволяют в промышленных масштабах выявлять, оценивать и фиксировать спонтанные сообщения из источников медицинской литературы (библиографические базы данных, научные журналы) и других интернет-ресурсов (сайты регуляторных агентств, социальные сети, медицинские форумы и др.), обнаруживать информацию для поиска сигналов по безопасности и эффективности лекарственных препаратов.
Также современные системы позволяют собирать и анализировать данные в виде естественного языка из различного рода электронных медицинских записей, обнаруживая потенциально рисковые паттерны с точки зрения общественного и индивидуального здоровья [15].
Обобщенный перечень с примерами подобных систем представлен в таблице 2.
Эффективной практикой является также привлечение к сбору информации самих пациентов не только в рамках активного репортирования (напрямую ДРУ и в регуляторные органы), но и за счет сбора данных из социальных сетей (vk.ru), форумов и блогов, например, irecommend, otzovik, PatientsLikeMe, MedMD, AskAPatient [3].
Наличие эффективного электронного обмена дает возможность использования мобильных медицинских приложений и устройств беспроводного мониторинга состояния пациента, которые могут иметь полезные функции, включая информацию о заболеваниях, дневники симптомов, журналы приема лекарств и напоминания, дневники питания и пр. [9].
Носимые устройства и мобильные приложения для здоровья измеряют физическое состояние и физиологические параметры и могут помочь в планировании приема лекарств. Некоторые из популярных медицинских устройств, которые используют пациенты, включают потребительские товары для мониторинга здоровья (например, Fitbit и Apple Watch), носимые внешние медицинские устройства (например, портативные инсулиновые помпы) и встроенные медицинские устройства (например, кардиостимуляторы). Носимые устройства могут генерировать динамические данные в реальном времени, которые поставщики могут оценивать с помощью программных приложений на компьютерах, планшетах или смартфонах [13]. Результаты быстро доступны и позволяют поставщикам услуг более эффективно вносить соответствующие коррективы, не дожидаясь результатов лабораторных исследований.
Однако исследования с использованием электронных инструментов здравоохранения на базе Интернета и смартфонов для мониторинга приема лекарств больше фокусируются на соблюдении режима приема лекарств, мониторинге и лечении хронических заболеваний, при этом примеров использования этих инструментов для выявления или профилактики НР меньше [18].
Этапы технологического развития держателя регистрационного удостоверения в контексте фармаконадзора
Автоматизированные системы могут выступать сильным акселератором развития системы фармаконадзора предприятия, однако такого рода улучшения стоит проводить на определенных этапах развития ДРУ. На большинстве предприятий ДРУ в ЕАЭС остро и первоочередно на данный момент стоит вопрос кадровой укомплектованности отделов фармаконадзора, исходя из реальной оцененной нагрузки на отдел. Только в случае наличия обученного коллектива можно планировать различные внедрения компьютеризированных систем и быть уверенным, что они приживутся, а именно баз для хранения данных по безопасности лекарственных препаратов и развития автоматических систем мониторинга. Таким образом, в верхнеуровневом контексте в рамках ДРУ в пострегистрационном фармаконадзоре у ДРУ можно наблюдать ряд закономерных этапов развития (табл. 3).
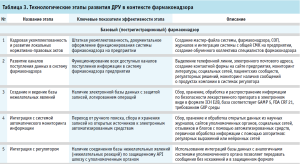
На начальном этапе основной задачей является кадровая укомплектованность и разработка локальных нормативных актов, что включает создание мастерфайла системы фармаконадзора, стандартных операционных процедур (СОП), журналов и интеграцию системы фармаконадзора с общей системой менеджмента качества на предприятии. Это обеспечивает правильное документальное оформление функционирования системы и формирует основу для эффективной работы специалистов внутри отдела фармаконадзора [1].
Второй шаг – развитие каналов поступления данных. Этап предполагает организацию разнообразных каналов для сбора информации о безопасности продукции, таких как выделенные телефонные линии, электронные адреса, контактные формы на сайте предприятия, а также мониторинг научной литературы, социальных сетей и пациентских сообществ.
Третий этап затрагивает создание и ведение базы данных нежелательных явлений (НЯ), что включает сбор, хранение, обработку и распространение информации по безопасности препаратов в электронном виде, что требует соответствия международным стандартам и нормам безопасности данных.
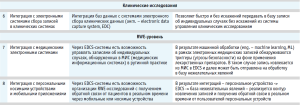
Четвертый этап включает интеграцию системы с автоматическими мониторинговыми системами для сбора и обработки данных из открытых источников (при достаточном объеме молекул в портфеле ДРУ), что позволяет перейти от ручного сбора информации к более эффективным автоматизированным методам, обеспечить воспроизводимость и масштабируемость процесса.
Логичным также оказывается этап интеграции с регуляторными органами через защищенные API-шлюзы, что обеспечивает надежную и безопасную передачу данных о нежелательных явлениях. Метод удовлетворяет требованиям по защите записи, логированию и прослеживаемости. При наличии клинических исследований должна быть предусмотрена возможность электронного обмена баз данных НЯ с системами электронного сбора клинических данных (EDC), что позволяет эффективно управлять данными об индивидуальных случаях без искажений [14].
Также актуальным представляется сбор и анализ данных из реальной клинической практики (RWE), возможная интеграция с медицинскими электронными системами и персональными носимыми устройствами для расширения возможностей сбора и анализа данных о безопасности лекарственных препаратов в реальном времени [8]. Таким образом, развитие фармаконадзора на предприятии требует комплексного подхода, начиная от формирования нормативной базы и кадровой политики до внедрения современных технологий для сбора, обработки и анализа данных, что позволяет не только соответствовать требованиям регуляторных органов, но и способствует повышению безопасности и эффективности лекарственных средств.
В рамках отраслевого исследования 2022 года было проведено исследование рынка, объектами которого являлись крупные российские производители и локальные представительства международных компаний [3]. С октября 2021 по октябрь 2022 года было проанализировано 57 компаний-производителей ЛС с различным количеством препаратов в портфеле (Me = 46 [31; 87]). В портфеле компаний количество оригинальных продуктов ограничивалось 5%, количество брендированных (уникальных наименований) – 15,2% (95% ДИ: 9,0; 21,4). В исследование вошли только те компании, которые не пользуются услугами аутсорсинга фармаконадзора.
По результатам исследования кадровой обеспеченности фармацевтических компаний было обнаружено только 30% (N = 17) компаний, которые имеют в штате двух и более специалистов по фармаконадзору, включая УЛФ (уполномоченное лицо по фармаконадзору); 47% (N = 27) имеют только одного специалиста по фармаконадзору и УЛФ; в единственном лице представлен УЛФ у 23% компаний (N = 13). При этом 25% УЛФ среди опрошенных компаний (N = 14) совмещают деятельность с другим функционалом в компании. Самым популярным способом получения сведений о препаратах являлась электронная почта (92%), на втором месте – выделенная телефонная линия (у 74%); замыкает тройку лидеров заполнение контактной формы на сайте компании-производителя, которая есть лишь у 65% ДРУ. Предпочтение для хранения информации многие ДРУ отдают программе MS Excel (N = 68%); в специализированном программном обеспечении информация хранится только у четверти опрошенных респондентов (N = 14 или 24,56%).
Таким образом, технологическое развитие отделов фармаконадзора в фармацевтических компаниях проходит через закономерные этапы, начиная с кадрового обеспечения и заканчивая внедрением автоматизированных систем мониторинга. Несмотря на законодательные требования к назначению уполномоченных лиц и формированию соответствующего штата специалистов, компании имеют ограниченный штат профильных специалистов, что подчеркивает проблему недостаточной кадровой обеспеченности в отрасли. Вопросы построения эффективной базы данных для хранения и анализа информации о препаратах остаются актуальными, учитывая, что большинство компаний использует простые табличные редакторы вместо специализированного ПО. Такая ситуация может сказываться на качестве фармаконадзора, так как сбор и анализ данных являются критически важными для управления рисками и обеспечения безопасности лекарственных средств.
Автоматизация процессов с помощью компьютеризированных систем является следующим шагом и может быть реализована только после полного удовлетворения кадровых и технологических потребностей на предыдущих этапах становления системы фармаконадзора предприятия.
Ограничения внедрения программного обеспечения в информационный контур держателя регистрационного удостоверения
Внедрение новых программных продуктов в информационный контур фармацевтического предприятия сопровождается рядом существенных ограничений и рисков, связанных с обеспечением соответствия высоким стандартам качества и безопасности отрасли.
Компании-производители на этапе внедрения цифровых технологий на предприятии сталкиваются с требованиями GXP-комплаенса, который состоит из пяти главных составляющих, объединяющих нормативные требования, как национальные, так и отраслевые, а также надлежащие практики [16]:
- Соответствие организации требованиям GMP, GSP, GVP, GCP, которые содержат указания к жизненному циклу компьютеризированных систем на предприятии. Такая ситуация предполагает строгий контроль за исполнением процессов эксплуатации ПО, что, в свою очередь, требует от предприятий значительных ресурсов на поддержание и актуализацию системы управления качеством.
- Вторым важным элементом выступает валидация процессов по GAMP5 (англ. – Good Automated Manufacturing Practice, версия 5), сокращение от «Надлежащая практика автоматизированного производства версии 5», является жизненно важной основой в фармацевтической и биофармацевтической промышленности. GAMP 5 подчеркивает важность риск-ориентированного подхода при разработке, валидации и использовании автоматизированных систем. Несоответствие этим требованиям может привести к серьезным последствиям, вплоть до отзыва продукции [6].
- Третьей важной составляющей внедрения процессов, использующих компьютеризированные системы на предприятии, является целостность и безопасность данных по стандарту 21 CFR 11. Этот стандарт определяет критерии достоверности электронных записей и их взаимозаменяемости с бумажными документами, а также критерии валидности электронных подписей. Нарушение данных принципов может подвергнуть компанию юридическим и финансовым рискам [7].
- Для обеспечения прозрачности и понятности документации на предприятии должны существовать СОПы. Данная документация (СОП, англ. SOP, Standard Operating Procedure) представляет собой набор пошаговых инструкций для однотипного выполнения последовательности каких-либо действий. Отсутствие четко оформленных СОПов может привести к ошибкам в процессах, а также к затруднениям при проведении аудитов и инспекций.
- У многих сотрудников возникает непонимание в работе с многочисленными требованиями и стандартами. В связи с этим неотъемлемой составляющей является развитие компетенций и обучение персонала компании-производителя ЛС. Недостаточный уровень обучения и компетенций персонала может стать серьезным барьером для успешного внедрения и последующей эксплуатации новых программных продуктов [12].
В совокупности, эти ограничения и риски требуют от фармацевтических компаний тщательного планирования, адаптации процессов и постоянного мониторинга для обеспечения соответствия нормативным требованиям и поддержания высокого уровня качества продукции, что подразумевает внедрение комплексного подхода к управлению качеством, безопасностью данных и обучению персонала. Такой подход в конечном итоге способствует повышению эффективности и конкурентоспособности ЛС на рынке.
Выводы
На уровне международных и государственных институтов внедрение компьютеризированных систем стало закономерным этапом накопления большого массива цифровых данных, стремления к удобному межсекторальному обмену этими данными и развитию технологических мощностей. Компьютеризированные системы повышают качество данных, уменьшая вероятность человеческой ошибки. Они способствуют получению более точных результатов обработки данных, экономя ресурсы людей и организации, а также формируют цифровой след, предоставляя возможность продемонстрировать регулирующим органам, что сбор данных производился и осуществлялся на предприятии регулярно. При накоплении большого количества данных о препарате цифровизация помогает налаживать взаимодействие между разными системами хранения информации.
Однако работа с разнородным потоком данных в фармаконадзоре прежде всего требует достаточной укомплектованности отделов фармаконадзора ДРУ, высокой квалификации специалистов таких отделов, умения анализировать и сопоставлять данные. Использование многочисленных электронных систем при проведении скрининга информации о лекарственных препаратах позволяет обеспечить полноту, целостность и воспроизводимость данных о НР ЛП. Однако переход на бизнес-процессы с использованием информационных технологий сопровождается и целым рядом трудностей, с которыми приходится сталкиваться ДРУ на этапе внедрения автоматизированных систем. Само по себе последнее не является критичным препятствием, а инвестиции в развертывание компьютеризированных систем существенно повышают качество фармаконадзора на предприятии.
- Вельц Н.Ю. [и др.]. Представление документов о системе фармаконадзора в составе регистрационного досье в рамках процедур ЕАЭС: анализ требований и типичных ошибок // Безопасность и риск фармакотерапии. 2024. № 3 (12). C. 331–340.
- Крашенинников А.Е., Матвеев А.В., Егорова Е.А. Разработка и внедрение в систему фармаконадзора информационных баз данных нежелательных реакций и их значение в повышении и безопасности лекарственных средств // Вестник Волгоградского государственного медицинского университета. 2018. № 3 (67). C. 8–12.
- Нежурина Е.П., Мильчаков К.С, Абрамова А.А. Социальные сети как источник информации о нежелательных реакциях в пострегистрационном фармаконадзоре: обзор // Безопасность и риск фармакотерапии. 2024; 12(4): 432–443.
- Чукреева Н.В. Исторические этапы эволюции систем обеспечения и контроля качества лекарственных средств // Ремедиум. Журнал о российском рынке лекарств и медицинской технике. 2016. № 6. C. 44–50.
- Шубникова Е.В. Пострегистрационный фармаконадзор: обзор открытых источников получения данных по безопасности лекарственных препаратов // Безопасность и риск фармакотерапии. 2024. № 3 (12). C. 309–330.
- Alosert H. [и др.]. Data integrity within the biopharmaceutical sector in the era of Industry 4.0 // Biotechnology Journal. 2022. № 6 (17). C. e2100609.
- Bansal A. [и др.]. A 21 CFR Part 11 compliant graphically based electronic system for clinical research documentation // Journal of Medical Systems. 2012. № 3 (36). C. 1661–1672.
- Chen W.-W. [и др.]. Using real-world evidence for pharmacovigilance and drug safety-related decision making by a resource-limited health authority: 10 years of experience in Taiwan // Pharmacoepidemiology and Drug Safety. 2020. № 11 (29). C. 1402–1413.
- Edrees H. [и др.]. Intelligent Telehealth in Pharmacovigilance: A Future Perspective // Drug Safety. 2022. № 5 (45). C. 449–458.
- Ghosh R. [и др.]. Automation Opportunities in Pharmacovigilance: An Industry Survey // Pharmaceutical Medicine. 2020. № 1 (34). C. 7–18.
- Kassekert R. [и др.]. Industry Perspective on Artificial Intelligence/Machine Learning in Pharmacovigilance // Drug Safety. 2022. № 5 (45). C. 439–448.
- Kumar R. [и др.]. Training and education in pharmacovigilance: The experience from the Pharmacovigilance Programme of India // Indian Journal of Pharmacology. 2024. № 5 (56). C. 348–357.
- Lancaster K. [и др.]. The Use and Effects of Electronic Health Tools for Patient Self-Monitoring and Reporting of Outcomes Following Medication Use: Systematic Review // Journal of Medical Internet Research. 2018. № 12 (20). C. e294.
- Lu Z. Technical challenges in designing post-marketing eCRFs to address clinical safety and pharmacovigilance needs // Contemporary Clinical Trials. 2010. № 1 (31). C. 108–118.
- Luo Y. [и др.]. Natural Language Processing for EHR-Based Pharmacovigilance: A Structured Review // Drug Safety. 2017. № 11 (40). C. 1075–1089.
- Ronninger S. [и др.]. Considerations on Auditing and GxP Requirements along the Product Lifecycle // PDA journal of pharmaceutical science and technology. 2012. № 5 (66). C. 396–402.
- Sauer F. [Major milestones for European pharmaceutical policy] // Revue D’histoire De La Pharmacie. 2014. № 381 (62). C. 61–74.
- Wilson L.S., Maeder A.J. Recent Directions in Telemedicine: Review of Trends in Research and Practice // Healthcare Informatics Research. 2015. № 4 (21). C. 213–222.
