ГОСУДАРСТВЕННЫЙ КОНТРОЛЬ И НАДЗОР
Совершенствование системы государственного контроля качества, эффективности и безопасности лекарственных средств
1 — Федеральная служба по надзору в сфере здравоохранения, 109074, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр. 1.
2 — Федеральная служба по надзору в сфере здравоохранения, 109074, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр. 1.
Статья посвящена обзору работы Росздравнадзора по развитию государственного контроля качества, эффективности и безопасности лекарственных средств, совершенствованию системы фармаконадзора, использованию информационных систем при контрольных (надзорных) мероприятиях Росздравнадзора, а также результатам международной деятельности.
Ключевые слова: выборочный контроль качества лекарственных средств, федеральные лабораторные комплексы, ввод в гражданский оборот лекарственных препаратов, противодействие незаконному обороту лекарственных средств, информационные системы, система мониторинга движения лекарственных препаратов, доклинические исследования, клинические исследования, фармаконадзор, мониторинг безопасности, нежелательные реакции, сбор и анализ извещений о нежелательных реакциях лекарственных препаратов
С момента создания Федеральной службы по надзору в сфере здравоохранения одной из ключевых задач является контроль качества лекарственных средств, находящихся в обращении, поскольку качество препарата имеет первостепенное значение при оказании медицинской помощи пациентам, обеспечении эффективного процесса лечения и профилактики заболеваний.
Требования к организации и проведению контрольных (надзорных) мероприятий регламентированы положениями Федерального закона от 31.07.2020 № 248-ФЗ «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации», вступившими в силу с 01.07.2021; постановления Правительства Российской Федерации от 29.06.2021 № 1049 «О федеральном государственном контроле (надзоре) в сфере обращения лекарственных средств», вступившими в силу с 01.07.2021; постановления Правительства Российской Федерации от 10.03.2022 № 336 «Об особенностях организации и осуществления государственного контроля (надзора), муниципального контроля».
В настоящее время плановые проверки в соответствии с постановлением № 336 проводятся только в отношении организаций чрезвычайно высокого и высокого риска. Вместе с тем выборочный контроль качества лекарственных средств всегда носит внеплановый характер и проводится на основании программы проверок.
Программа проверок формируется ежегодно по результатам выборочного контроля качества лекарственных средств за предыдущие периоды; данным о выявлении недоброкачественных и фальсифицированных лекарственных средств; данным, в обязательном порядке предоставляемым субъектами обращения лекарственных средств, о сериях, партиях лекарственных средств, поступающих в гражданский оборот в Российской Федерации; поступившим сведениям по фармаконадзору о серьезных нежелательных реакциях; сведениям, поступившим от граждан, организаций и из средств массовой информации.
Программа проверок включает как отдельные группы лекарственных препаратов, сформированные по анатомо-терапевтической-химической классификации, так и препараты конкретных международных непатентованных наименований.
В ходе проведения выборочного контроля могут осуществляться следующие контрольные (надзорные) действия: осмотр, опрос (при проведении проверки), получение письменных объяснений, истребование документов, отбор образцов лекарственных средств, инструментальное обследование, испытание, экспертиза на соответствие установленным требованиям к качеству.
С целью усиления ответственности производителей и дистрибьюторов за качество производимых, ввозимых и реализуемых препаратов с 2019 года в Российской Федерации действует обновленный порядок ввода лекарственных препаратов в гражданский оборот. С вступлением в силу Федерального закона от 28.11.2018 № 449-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросу ввода в гражданский оборот лекарственных препаратов для медицинского применения», лекарственные средства были выведены из-под действия Федерального закона от 27.12.2002 № 184-ФЗ «О техническом регулировании», отменено обязательное подтверждение соответствия лекарственных препаратов в форме декларирования и сертификации.
Таким образом, была усилена ответственность производителей и дистрибьюторов за качество производимых, ввозимых и реализуемых препаратов.
Особый порядок, гармонизированный с международными подходами и рекомендациями Всемирной организации здравоохранения, был введен для контроля за выпуском и обращением иммунобиологических лекарственных препаратов (ИЛП). Каждая серия ИЛП перед поступлением в гражданский оборот должна быть проконтролирована производителем по всем показателям качества нормативной документации, утвержденной при регистрации в составе регистрационного досье. Затем качество вакцин проверяется в одном из федеральных лабораторных комплексов, находящихся в ведении Министерства здравоохранения Российской Федерации или Росздравнадзора по всем показателям качества. При этом лабораторные комплексы должны иметь аккредитацию на право проведения испытаний ИЛП в национальной системе аккредитации.
Введение описанной процедуры позволило уверенно работать в период пандемии новой коронавирусной инфекции и своевременно обеспечивать граждан качественными вакцинами. По данным автоматизированной информационной системы Росздравнадзора, за период с 2019 года по 2023 год было выдано 13 035 разрешений на ввод в гражданский оборот иммунобиологических лекарственных препаратов.
В современном мире сложно представить оперативный сбор сведений со всей территории Российской Федерации и своевременное принятие управленческих решений без использования цифровых технологий.
Имеющиеся в распоряжении Росздравнадзора системы позволяют нам оперативно мониторировать и детально анализировать данные в масштабах страны.
В своей повседневной деятельности мы используем системы, разработанные внутри Росздравнадзора, а также активно обмениваемся цифровой информацией с другими ведомствами. Это позволяет, с одной стороны, значительно сокращать сроки предоставления услуг, с другой – получать полную оперативную информацию, необходимую для срочного реагирования и принятия управленческих решений.
Система мониторинга движения лекарственных препаратов для медицинского применения
Одним из эффективных механизмов противодействия незаконному обороту медицинской продукции является введение полной прослеживаемости движения лекарственных препаратов от производителя, дистрибьютора до конечного получателя.
С 2017 года, с момента начала эксперимента по маркировке лекарственных препаратов контрольными (идентификационными) знаками, отработан функционал федеральной государственной информационной системы мониторинга движения лекарственных препаратов для медицинского применения (ФГИС МДЛП) которая на сегодняшний день помогает Росздравнадзору и нашим территориальным органам оперативно выполнять целый ряд задач.
Система мониторинга в автоматизированном режиме отслеживает движение по товаропроводящей цепочке каждой отдельной упаковки вплоть до вывода из оборота конкретной аптечной или медицинской организацией (продажа, выдача в лечебное отделение, выдача пациенту).
В настоящее время в системе ФГИС МДЛП зарегистрированы 97 814 участников, 51 755 товарных позиций лекарственных препаратов, производителями эмитировано 29,9 млрд кодов маркировки.
Росздравнадзору и территориальным органам через личный кабинет контролирующего органа обеспечен доступ к информации, содержащейся в системе мониторинга, в рамках установленных полномочий.
Автоматизированная информационная система Росздравнадзора функционирует во взаимодействии с ФГИС МДЛП. При проведении выборочного контроля качества лекарственных препаратов ФГИС МДЛП используется Росздравнадзором для подтверждения нахождения в гражданском обороте лекарственных препаратов, которые включены в программу проверок.
Из системы мониторинга в целях обеспечения осуществления федерального государственного контроля (надзора) в сфере обращения лекарственных средств в Росздравнадзор передаются также сведения об уничтожении лекарственных препаратов.
Функционал ФГИС МДЛП также позволяет отслеживать сроки годности лекарственных препаратов, профилактировать дефектуру, мониторировать минимальный ассортимент препаратов в аптечных организациях, а также анализировать цены на жизненно необходимые и важнейшие лекарственные препараты.
Следует отметить большой вклад, который вносит ФГИС МДЛП в вопрос мониторинга лекарственного обеспечения населения, что было особенно важно в период пандемии.
Она позволяет проводить постоянный мониторинг наличия лекарственных препаратов в субъектах Российской Федерации, получать информацию об имеющихся остатках в целях принятия оперативного решения по поставкам лекарственных препаратов в регионы.
При этом следует отметить, что система ФГИС МДЛП адаптируется к современным потребностям как потребителей, так и контролирующих ведомств.
Так, с 1 сентября 2023 года отменен уведомительный режим: аптечные и медицинские организации обязаны принимать лекарственные препараты на баланс по данным системы ФГИС МДЛП и только после этого осуществлять розничную продажу либо использовать их для медицинского применения.
Первоочередной задачей системы ФГИС МДЛП является защита потребителя от недоброкачественных и контрафактных лекарственных препаратов.
В целях снижения негативных последствий от применения лекарственных средств, не отвечающих установленным требованиям к качеству, Росздравнадзором совместно с правоохранительными и следственными органами и с использованием системы маркировки проводятся мероприятия в сфере обращения лекарственных средств.
Благодаря уникальным кодам маркировки можно оперативно установить законных владельцев препаратов при подозрениях в краже из медицинских организаций. Таким образом система позволяет совместно с правоохранительными органами предотвращать повторное поступление в обращение лекарственных препаратов, ранее выведенных из ФГИС МДЛП.
Так, благодаря функционированию системы маркировки количество выявленных в обращении фальсифицированных препаратов сократилось с 12 серий в 2019 году до 2 серий в 2022 году. Что касается недоброкачественных препаратов, при выявлении фактов несоответствия требований к качеству происходит блокировка движения препарата в системе МДЛП, и он не попадает к потребителю. Росздравнадзором в 2022 году приняты решения по блокировке 145 серий 56 торговых наименований недоброкачественных лекарственных препаратов, в 2023 году – 449 серий 60 торговых наименований недоброкачественных лекарственных препаратов.
Цифровая платформа мониторинга контроля и надзора в Российской Федерации
В ходе реформы контрольно-надзорной деятельности в Российской Федерации создается цифровая платформа мониторинга контроля и надзора – все существующие сейчас информационные системы, задействованные в ней, будут связаны. Платформа объединит информационные системы органов, участвующих в контрольно-надзорной деятельности, будет обеспечивать аналитическую обработку информации в режиме реального времени на территории всей страны. Цифровая платформа охватывает как функции контрольно-надзорных органов, так и государственные услуги.
Юридические лица через личный кабинет на Едином портале государственных и муниципальных услуг (функций) (ЕПГУ) имеют доступ ко всей информации, а также возможность подачи заявлений на получение необходимых государственных услуг.
1 июля 2021 года в России заработал Единый реестр видов государственного контроля (надзора). В него включена информация о всех видах контроля (надзора) федерального, регионального и муниципального уровней, а также их описание. Кроме того, в реестре указано, какие надзорные органы осуществляют конкретный вид контроля. Доступность информации позволит бизнесу изучить подробное описание каждого вида контроля, а также узнать, с какой периодичностью будут осуществляться проверки в отношении их деятельности.
Реестр обязательных требований – это единая платформа, на которой собрана информация обо всех обязательных требованиях к бизнесу, которые проверяются в рамках контроля (надзора) и при выдаче разрешений. За методическое обеспечение наполнения Реестра отвечает Минэкономразвития России.
В рамках функций и оказываемых услуг Росздравнадзор наполняет реестр обязательных требований соответствующими нормативными правовыми актами и обязательными требованиями.
С 1 июля 2021 года введена в промышленную эксплуатацию федеральная государственная информационная система «Единый реестр контрольных (надзорных) мероприятий (ФГИС ЕРКНМ). Оператор системы – Генеральная прокуратура Российской Федерации. Все мероприятия – контрольно-надзорные (в том числе выборочный контроль качества) и профилактические – вносятся в ФГИС ЕРКНМ.
Организация проведения контроля качества лекарственных средств
Контроль качества лекарственных средств невозможен без современных лабораторных комплексов, оснащенных с учетом актуальных требований.
На сегодняшний день в подведомственном учреждении Росздравнадзора – ФГБУ «ИМЦЭУАОСМП» – функционируют 13 лабораторных комплексов. Совершенствование системы государственного контроля качества лекарственных средств позволило Росздравнадзору ежегодно обеспечить возрастающий объем проведения контроля качества лекарственных средств, находящихся в обращении, с 15 212 в 2013 году до 40 458 экспертиз/испытаний в 2023 году. Лабораторные комплексы оснащены передвижными экспресс-лабораториями, которые позволяют проводить контроль качества лекарственных препаратов непосредственно в лечебных и аптечных учреждениях.
Скрининг качества лекарственных средств в передвижных экспресс-лабораториях проводится с использованием неразрушающих методов БИК-спектроскопии и РАМАН-спектроскопии.
Росздравнадзором с 2014 года проводилось практическое изучение метода рамановской спектроскопии в качестве экспресс-метода анализа лекарственных средств, в первую очередь, фармацевтических субстанций и жидких форм лекарственных препаратов. В результате данной работы совместно со специалистами Казанского федерального университета был разработан программно-аппаратный комплекс «Мини-Рам 532» и программное обеспечение для обработки спектров комбинационного рассеяния и создания базы данных моделей Q-Lab, после чего начато использование данного скринингового метода при проведении контрольных мероприятий Росздравнадзора.
В 2020 году в практику контроля был внедрен принципиально новый метод оперативного испытания качества медицинского кислорода, который проводится в мобильных лабораториях с использованием портативного газохроматографического комплекса «ПИА» отечественного производства. Это стало особенно востребовано в период пандемии в связи с масштабным использованием систем искусственной вентиляции легких.
Одним из важнейших достижений недавних лет является создание Центра масс-спектрометрического анализа на базе Ярославского филиала ФГБУ «ИМЦЭУАОСМП» Росздравнадзора.
Центр оснащен уникальным оборудованием, позволяющим обнаруживать и идентифицировать примеси в следовых и даже ультра-следовых концентрациях.
Также на базе Ярославского филиала в 2022 году сформирован первый в России Центр анализа лекарственного растительного сырья, который позволяет проводить анализ данных препаратов по всем показателям качества, включая «содержание мышьяка», «определение содержания остаточных пестицидов», «определение содержания радионуклидов», «содержание тяжелых металлов».
Ранее подобными методами исследования частично обладали некоторые негосударственные лаборатории. Популярные у населения травяные сборы теперь будут проверяться в одном месте по всем показателям с помощью новейшего оборудования. Оснащение центра позволяет контролировать качество всех фармацевтических субстанций на основе растительного лекарственного сырья и всех лекарственных препаратов растительного происхождения, находящихся на сегодняшний день в обращении в Российской Федерации по данным АИС Росздравнадзора.
Созданная Росздравнадзором система государственного контроля качества лекарственных средств постоянно развивается, что позволяет не только проводить испытания лекарственных средств, но и своевременно выявлять и изымать из обращения находящиеся в незаконном обороте лекарственные средства.
В 2023 году сохранена динамика снижения количества изъятых из обращения серий лекарственных средств, качество которых не отвечает требованиям, установленным при регистрации (283 серий), что составляет 0,09% от общего количества серий, введенных в гражданский оборот (2019 г. – 738 серий).
Контроль за проведением доклинических и клинических исследований лекарственных средств
Доклинические и клинические исследования лекарственных средств являются неотъемлемым этапом жизненного цикла любого современного эффективного и безопасного лекарственного препарата. В целях обеспечения населения Российской Федерации эффективными и безопасными лекарственными препаратами для медицинского применения осуществляется государственный контроль за организацией и проведением доклинических и клинических исследований лекарственных препаратов для медицинского применения. Проведение проверок по данному виду контроля началось в 2005 году и за весь период существования Росздравнадзора было осуществлено 1360 контрольно-надзорных мероприятий в рамках государственной функции.
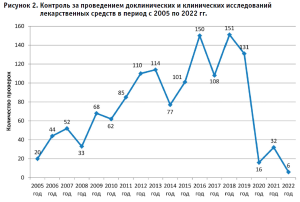
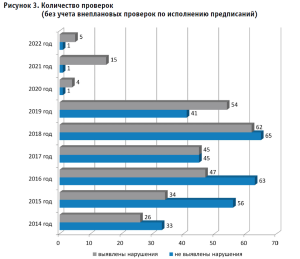
За последние 10 лет (2014–2023 гг.) количество проверок по контролю за проведением доклинических и клинических исследований лекарственных препаратов возросло на 31% в сравнении с предыдущим периодом и составило 772 проверки; 567 проверок было проведено в плановом режиме, 205 – во внеплановом, из которых 31 проверка – в связи с поступлением информации о риске причинения вреда жизни и здоровью граждан, участвующих в клинических исследованиях.
Было проанализировано выполнение требований 790 протоколов клинических исследований лекарственных препаратов для медицинского применения и доклинических исследований лекарственных средств. Нарушения обязательных требований действующего законодательства были выявлены в результате проведения 292 контрольно-надзорных мероприятий (49%). Общее количество нарушений обязательных требований составило 1839.
Развитие системы фармаконадзора
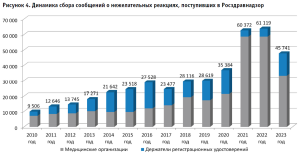
Росздравнадзор постоянно осуществляет сбор и анализ извещений о нежелательных реакциях лекарственных препаратов, количество которых стабильно возрастает. Работа по фармаконадзору крайне важна, поскольку любая нежелательная реакция может быть основанием для пересмотра профиля безопасности лекарственного препарата и принятия различных регуляторных решений, вплоть до приостановки его медицинского применения.
(R3), позволяющая автоматически принимать сообщения из программных ресурсов по фармаконадзору отечественных и зарубежных разработок, поддерживать информационный обмен анонимизированными данными с ВОЗ в рамках программы международного мониторинга безопасности лекарственных средств.
За период с начала функционирования баз данных по сбору сообщений о нежелательных реакциях «Фармаконадзор» и «Фармаконадзор 2.0» Росздравнадзором получено и проанализировано более 370 тыс. сообщений о нежелательных реакциях, произошедших на территории Российской Федерации.
Получено и проверено более 45 тыс. периодически обновляемых отчетов по безопасности лекарственных препаратов. Направлено более 340 писем в Минздрав России с рекомендациями по внесению изменений в инструкции и общие характеристики лекарственных препаратов, касающиеся безопасности фармакотерапии. В рамках выборочного контроля качества лекарственных средств проведено порядка 1 тыс. экспертиз качества лекарственных препаратов, из которых выявлено 85 серий лекарственных препаратов, не соответствующих качеству по показателям, утвержденным нормативной документацией данных лекарственных препаратов. На сайте Росздравнадзора опубликовано более 1 тыс. писем, посвященных новым данным безопасности применения лекарственных препаратов.
Росздравнадзор рассматривает сообщения, поступающие от всех заинтересованных лиц: от медицинских организаций , пациентов и держателей регистрационных удостоверений . Именно совместное участие позволяет сделать работу эффективнее, а лекарства – безопаснее.
Международное сотрудничество с зарубежными регуляторными органами и профильными международными организациями
Одним из условий успешной работы по обеспечению качества, эффективности и безопасности медицинской продукции является постоянный обмен знаниями, опытом и передовыми практиками с зарубежными коллегами. Гармонизация задач, требований, подходов – одна из функций Росздравнадзора, осуществляемых на благо российских пациентов.
В целях развития сотрудничества с зарубежными регуляторными органами с 2009 года Росздравнадзором подписаны меморандумы и протоколы о сотрудничестве и налажено устойчивое взаимодействие с рядом зарубежных ведомств, осуществляющих регулирование обращения медицинской продукции и контроль ее качества, например, Национальным управлением по контролю за медицинской продукцией КНР (NMPA); Агентством по лекарственным средствам и медицинским изделиям Сербии (ALIMS); Национальным агентством по надзору в сфере здравоохранения Бразилии (ANVISA); Организацией по контролю пищевых продуктов и лекарственных средств Исламской Республики Иран; Государственным центром по контролю лекарственных средств и медицинских изделий Кубы (CECMED); Федеральной комиссией по защите санитарных рисков Мексики (COFEPRIS).
Одним из недавних подписанных документов стал обновленный меморандум о взаимопонимании между Росздравнадзором и Центральной организацией по контролю за соблюдением стандартов лекарственных средств (CDSCO) Республики Индия, подписанный 26 декабря 2023 года в присутствии Заместителя Председателя Правительства Российской Федерации – министра промышленности и торговли Российской Федерации Дениса Мантурова и министра иностранных дел Республики Индия Субраманьяма Джайшанкара. Первый меморандум между Росздравнадзором и регуляторным ведомством Индии был подписан в декабре 2011 года. В рамках действующих соглашений осуществляется информационный обмен по вопросам качества, эффективности и безопасности лекарственных средств и медицинских изделий в целях противодействия обращению фальсифицированной и недоброкачественной медицинской продукции.
В рамках международного сотрудничества в сфере противодействия обращению фальсифицированной и контрафактной медицинской продукции специалисты Росздравнадзора принимают участие в работе Механизма государств-членов по некондиционной и фальсифицированной медицинской продукции ВОЗ, рабочей группы правоохранительных органов глав регуляторных агентств (WGEO), в системе обмена быстрыми оповещениями по вопросам, возникшим из-за дефектов качества лекарственных препаратов Схемы сотрудничества фармацевтических инспекций (PIC/S), а также других международных инициативах, в том числе на площадках БРИКС и ШОС.
В декабре 2023 года, осознавая необходимость слаженной международной работы по противодействию обращению недоброкачественной и фальсифицированной медицинской продукции, страны-члены БРИКС подписали Меморандум о взаимопонимании по вопросам сотрудничества в сфере нормативно-правового регулирования медицинской продукции для медицинского применения. Документ готовился и тщательно обсуждался на протяжении нескольких лет. Подписантами от Российской Федерации выступили Минздрав России, Минпромторг России и Росздравнадзор. Реализация комплекса мер, предусмотренных документом, позволит обеспечить доступ граждан стран БРИКС к качественной, эффективной и безопасной медицинской продукции и будет в целом способствовать развитию сотрудничества в сфере здравоохранения между странами БРИКС.
С 2011 года Росздравнадзор ежегодно участвует в международной операции «Пангея», организуемой под эгидой Генерального секретариата Интерпола совместно с Всемирной Таможенной Организацией. Операция направлена на пресечение оборота фальсифицированных и контрафактных лекарственных средств и медицинских изделий, реализуемых через Интернет, и объединяет представителей полиции, таможенных и регуляторных органов из более 100 стран мира. Ежегодно по результатам операции «Пангея» выявляются и блокируются интернет-сайты, содержащие нелегальные предложения о продаже лекарственных препаратов и медицинских изделий, изымается потенциально опасная медицинская продукция, принимаются меры административного и уголовного преследования. В 2023 году территориальные органы Росздравнадзора провели 233 контрольных мероприятия в рамках операции (в том числе совместно с правоохранительными органами). В 34 регионах страны на базе передвижных лабораторий ФГБУ «ИМЦЭУАОСМП» Росздравнадзора проведена экспертиза лекарственных средств, находящихся в обращении, с использованием метода БИК-спектроскопии (566 образцов) и метода РАМАН-спектроскопии (86 образцов). В результате проведенных мероприятий фальсифицированные лекарственные препараты на территории Российской Федерации не выявлены.
Росздравнадзор участвует в инициативах Всемирной организации здравоохранения (ВОЗ), направленных на укрепление регуляторных систем, повышение осведомленности пациентов и обеспечение доступа к качественной, эффективной и безопасной медицинской продукции. Росздравнадзор регулярно принимает участие в мероприятиях ВОЗ по проблеме устойчивости к противомикробным препаратам как контролирующий орган, который стоит на страже защиты прав пациентов с момента своего основания.
По приглашению ВОЗ руководитель Росздравнадзора А.В. Самойлова приняла участие в Первом глобальном совместном саммите регуляторов лекарственных средств и ветеринарных препаратов, прошедшем 4-5 мая 2023 года в Женеве, Швейцария, и выступила с докладом о российском опыте противодействия нелегальному обращению лекарственных средств, представила информацию о действующей в России системе МДЛП, об эксперименте по онлайн-продаже рецептурных препаратов и других законодательных инициативах.
Саммит был организован Четырехсторонним объединенным секретариатом по устойчивости к противомикробным препаратам (Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО), Программа Организации Объединенных Наций по окружающей среде (ЮНЕП), Всемирная организация здравоохранения (ВОЗ) и Всемирная организация здоровья животных (МЭБ)) и посвящен укреплению сотрудничества в области регулирования обращения лекарственных средств, правоприменительных мер и решений для поэтапного отказа от безрецептурных продаж антибиотиков в здравоохранении и ветеринарии, в рамках комплексной работы по преодолению антимикробной резистентности.
В 2023 году Росздравнадзор традиционно присоединился к инициативе Уппсальского центра мониторинга безопасности лекарственных средств ВОЗ (UMC) – 8-й ежегодной информационной кампании «Неделя безопасности фармакотерапии MedSafetyWeek». В рамках кампании MedSafetyWeek национальные регуляторные органы по контролю за лекарственными средствами из более 80 стран мира призывают медицинских и фармацевтических работников, а также пациентов сообщать о нежелательных реакциях, связанных с применением лекарственных препаратов. При этом крайне важна грамотная дифференциация возможной нежелательной реакции, её правильная фиксация и направление специалистам Росздравнадзора. Безопасность пациентов является главным приоритетом работы регуляторных органов всего мира. Работая вместе и обмениваясь информацией, мы можем сделать лекарственные препараты безопаснее для всех.
Деятельность Росздравнадзора всегда направлена на предотвращение потенциального ущерба и угрозы здоровью населения путем обеспечения качества, эффективности и безопасности находящейся в обращении медицинской продукции, что достигается, в том числе в результате изучения и внедрения передового международного опыта, современных методик и практик в контрольно-надзорную и лабораторную деятельность.
