АКТУАЛЬНЫЙ АСПЕКТ
Совершенствование государственной системы контроля качества лекарственных средств в Российской Федерации
1 — Федеральная служба по надзору в сфере здравоохранения, Российская Федерация, 109074, Москва, Славянская площадь, д. 4, стр. 1.
ORCID: https://orcid.org/0000–0002–9142–8808
2 — Федеральная служба по надзору в сфере здравоохранения, Российская Федерация, 109074, Москва, Славянская площадь, д. 4, стр. 1.
В статье представлен обзор работы Федеральной службы по надзору в сфере здравоохранения в рамках совершенствования системы государственного контроля качества лекарственных средств: развития лабораторных комплексов Росздравнадзора, внедрения федеральной государственной информационной системы мониторинга движения лекарственных препаратов для медицинского применения, организации проведения фармаконадзора в Российской Федерации.
Ключевые слова: контроль качества лекарственных средств, федеральные лабораторные комплексы, ввод в гражданский оборот лекарственных препаратов, противодействие незаконному обороту лекарственных средств, мониторинг безопасности и эффективности лекарственных препаратов, фармаконадзор
Введение
Одним из приоритетных направлений деятельности Росздравнадзора является государственный контроль качества лекарственных средств, находящихся в обращении, так как качество лекарственных средств в значительной мере определяет эффективность оказания медицинской помощи населению.
Росздравнадзором создана система государственного контроля качества лекарственных средств, находящихся в легальном обороте, которая позволяет своевременно выявлять и изымать из обращения недоброкачественные, фальсифицированные и контрафактные лекарственные средства. Элементами государственной системы контроля качества лекарственных средств, обеспечивающими ее эффективное функционирование, являются Росздравнадзор и его территориальные органы, а также федеральные лабораторные комплексы по контролю качества лекарственных средств.
Развитие федеральных лабораторных комплексов по контролю качества лекарственных средств
Совершенствование системы лекарственного обеспечения населения неразрывно связано с внедрением новейших достижений в области разработки лекарственных средств. Появление новых химических продуктов, синтез активных метаболитов и их изомеров, создание пролонгированных лекарственных форм, использование альтернативных методов доставки действующих компонентов (например, трансдермальных систем), внедрение современных направлений биотехнологии (генной инженерии), а также модернизация производства иммунобиологических препаратов1 требуют постоянного улучшения и модернизации работы системы государственного контроля за качеством лекарственных средств. Основа этой системы – федеральные лабораторные комплексы (рис. 1).
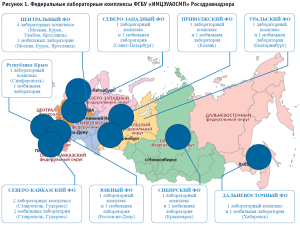
Федеральные лабораторные комплексы ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора (далее – «ИМЦЭУАОСМП») на текущий момент являются одними из самых оснащенных центров испытаний качества лекарственных препаратов с регулярно обновляющейся материально-технической базой в соответствии с требованиями как российской, так и зарубежных фармакопей. В феврале 2021 года была получена аккредитация новой 13-й лаборатории Росздравнадзора по контролю качества лекарственных средств в г. Ярославль. Одним из последних нововведений явилось создание Центра масс-спектрометрического анализа на базе Ярославского филиала ФГБУ «ИМЦЭУАОСМП». Масс-спектрометрия в настоящее время является безальтернативным методом, утвержденным в качестве основного или дополнительного метода испытаний для ряда важнейших препаратов, включая лекарственные препараты синтетического происхождения (низкомолекулярные), препараты растительного происхождения, иммунобиологические лекарственные средства. В Государственной фармакопее Российской Федерации XIV издания утвержден ряд общих и частных фармакопейных статей, включающих данный метод анализа.
Одним из примеров использования масс-спектрометрических методов является обнаружение и количественное определение генотоксичных примесей в лекарственных препаратах и активных фармацевтических субстанциях (примеси нитрозаминов). Основной опасностью данного типа примесей является их способность оказывать токсическое воздействие на организм в очень низких пределах содержания. Помимо этого, как и остаточные органические растворители, примеси нитрозаминов способны накапливаться в жировой и печеночной тканях, что способствует нанесению постоянного повреждающего воздействия гепатобилиарной системе и возможной малигнизации ее ткани. Присутствуя в ряде широко распространенных препаратов в ультранизких концентрациях (ppb), ранее эти вещества чрезвычайно трудно обнаруживались, что вызывало значительные сложности и с контролем их содержания. Применение методов масс-спектрометрии, в том числе и высокого разрешения, позволяет с успехом решать не только задачу поиска известных примесей, но также проводить скрининг ранее не обнаруженных и не задекларированных производителем нежелательных веществ в лекарственных препаратах и фармацевтических субстанциях.
Помимо анализа примесей, масс-спектрометрия высокого разрешения применяется для испытаний иммунобиологических лекарственных средств, например, для пептидного картирования с целью идентификации белков, особенно получаемых методом рекомбинантных ДНК, а также ряда других биологических препаратов, например, моноклональных антител и ферментов, применяемых в терапии лейкоза у детей. В соответствии с действующей редакцией Государственной фармакопеи Российской Федерации, метод высокоэффективной жидкостной хроматографии-масс-спектрометрии (ВЭЖХ-МС) является наиболее информативным для решения подобных задач.
Скрининг качества лекарственных средств с использованием неразрушающих методов проводится Росздравнадзором на базе одиннадцати передвижных лабораторий (рис. 2).

За период 2014–2020 гг. библиотека БИК-спектров лекарственных средств расширена до 3036, что в 3,7 раза превышает уровень 2014 года – 810.
Росздравнадзором с 2014 года на базе отдельного структурного подразделения ФГБУ «ИМЦЭУАОСМП» Росздравнадзора проводилось практическое изучение метода Рамановской спектроскопии в качестве экспресс-метода анализа лекарственных средств, в первую очередь, фармацевтических субстанций и жидких лекарственных форм лекарственных препаратов. В результате данной работы совместно со специалистами Казанского федерального университета был разработан программно-аппаратный комплекс «Мини-Рам 532» (рис. 2) и программное обеспечение для обработки спектров комбинационного рассеяния и создания базы данных моделей Q-Lab, после чего начато использование данного скринингового метода при проведении контрольных мероприятий Росздравнадзора. В 2020 году библиотека Раман-спектров увеличена до 1501 спектра лекарственных средств, что в 5 раз выше уровня 2014 года – 295.
В 2020 году внедрен в практику новый фармакопейный метод контроля кислорода медицинского, позволяющий контролировать качество кислорода передвижными лабораториями Росздравнадзора непосредственно в медицинских организациях. Продолжена практика скрининга качества медицинского кислорода с использованием газохроматографического комплекса «ПИА» (рис. 2) при проведении контрольных мероприятий Росздравнадзора.
В результате работы, проведенной в 10 регионах, проверено 49 образцов кислорода медицинского, использовавшегося в 15 медицинских организациях; по девяти образцам получены заключения о несоответствии требованиям нормативной документации.
Возможности газохроматографического комплекса «ПИА» использованы также при проверке кислорода в рамках совместных контрольных мероприятий правоохранительных органов и Росздравнадзора в I квартале 2020 года в Республике Татарстан, в IV квартале 2020 года в Костромской области и Кировской области.
В целом объем скрининга качества лекарственных средств неразрушающими методами в 2020 году вырос на 21% к уровню 2019 года, что обусловлено планомерным расширением применения неразрушающих экспресс-методов контроля качества лекарственных средств в рамках государственного контроля качества лекарственных средств.
Все лабораторные комплексы, помимо аккредитации в национальной системе аккредитации на соответствие требованиям ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий», прошли международную аккредитацию.
Так, Московская лаборатория по контролю качества лекарственных средств ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, осуществляющая посерийный контроль иммунобиологических лекарственных препаратов перед их вводом в гражданский оборот, также входит в сеть ВОЗ национальных лабораторий по контролю за качеством биологических препаратов.
Красноярская лаборатория с 2017 года является ассоциированным членом Общеевропейской сети официальных лабораторий по контролю качества лекарственных средств (OMCL).
Специалисты российских лабораторий работают в экспертных группах Европейской фармакопеи и, в частности, принимали участие в разработке рекомендаций EDQM по контролю вакцин против COVID-19.
В настоящее время аккредитацию ANAB (ANSI-ASQ National Accreditation Board) на соответствие международному стандарту ISO/IEC 17025-2005 имеют лабораторные комплексы ФГБУ «ИМЦЭУАОСМП» Росздравнадзора в г. Ростов-на-Дону, г. Красноярск, г. Хабаровск и г. Екатеринбург. ANAB является участником Международного форума по аккредитации (International Accreditation Forum (IAF)) и участником многосторонних соглашений о признании Международного сотрудничества по аккредитации лабораторий (International Laboratory Accreditation Cooperation (ILAC)). Кроме того, ANAB подписаны соглашения о взаимном признании с такими международными организациями по аккредитации американского и тихоокеанского регионов, как IAAC (Inter-American Accreditation Cooperation) и APLAC (Asia-Pacific Accreditation Cooperation (APLAC).
Сотрудники Росздравнадзора, Минздрава России и подведомственных учреждений, в том числе лабораторий, входят в состав экспертных групп ICH. В настоящее время Российская Федерация является наблюдателем ICH, рассматривается вопрос получения членства. Также сотрудники Росздравнадзора, Минздрава России и подведомственных учреждений, в том числе лабораторий, входят в состав экспертных групп IPRP, ICMRA.
Существенные изменения в систему государственного контроля качества лекарственных средств были внесены с введением выборочного контроля качества лекарственных средств. Ежегодно утверждаемая программа выборочного контроля качества лекарственных средств формируется с учетом потенциального риска для пациента и включает как отдельные фармако-терапевтические группы лекарственных препаратов, так и лекарственные средства конкретных международных непатентованных наименований.
Кроме того, выборочный контроль качества лекарственных средств ввел для субъектов обращения лекарственных средств обязательность предоставления сведений о сериях, партиях лекарственных средств, поступающих в гражданский оборот в Российской Федерации. С целью реализации этой функции были созданы специальные информационные ресурсы в автоматизированной информационной системе Росздравнадзора, которые позволили формировать аналитические данные о лекарственных препаратах, поступающих в гражданский оборот.
Развитие материально-технической базы лабораторных комплексов Росздравнадзора, внедрение выборочного контроля качества лекарственных средств позволили Росздравнадзору ежегодно обеспечивать возрастающий объем контроля качества лекарственных средств, находящихся в обращении, с 15 212 в 2013 году до 36 500 экспертиз/испытаний в 2020 году.
Информирование потребителей о лекарственных препаратах, поступающих в гражданский оборот
Важной задачей является максимальная открытость деятельности путем информирования потребителей о лекарственных препаратах, поступающих в гражданский оборот. Для этого на официальном сайте Росздравнадзора www.roszdravnadzor.ru в разделе «Лекарственные средства» открыты электронные сервисы: «Сведения о лекарственных средствах, поступивших в гражданский оборот в Российской Федерации», «Поиск писем по контролю качества лекарственных средств», «Поиск изъятых из обращения лекарственных средств».
Новый порядок ввода лекарственных препаратов в гражданский оборот
Для развития фармацевтического рынка важным является законодательная среда и отсутствие излишних барьеров. В этой связи необходимо отметить отмену с 29 ноября 2019 года обязательного подтверждения соответствия лекарственных препаратов в рамках технического регулирования, что позволило снять существующие до этой даты дополнительные барьеры и высвободить фармацевтическим предприятиям как финансовые, так и кадровые ресурсы и направить их на развитие бизнеса.
Федеральным законом от 28.11.2018 № 449-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросу ввода в гражданский оборот лекарственных препаратов для медицинского применения» был введен новый порядок выпуска лекарственных препаратов в гражданский оборот, который повысил ответственность производителей и импортеров за качество вводимых в гражданский оборот на территории Российской Федерации лекарственных препаратов.
С 29 ноября 2019 года в отношении лекарственных препаратов для медицинского применения не требуется проведение обязательной процедуры декларирования (сертификации). Ввод в оборот лекарственных препаратов для медицинского применения осуществляется после испытаний качества на соответствие требованиям, установленным при государственной регистрации, в службе качества производителя и на основании подтверждения уполномоченным лицом производителя (представителем импортера, уполномоченным иностранным производителем лекарственных средств) соответствия лекарственного препарата требованиям, установленным при его государственной регистрации.
Новый порядок ввода лекарственных препаратов в гражданский оборот полностью реформировал порядок подтверждения качества иммунобиологических лекарственных препаратов, в первую очередь вакцин, применяемых для иммунопрофилактики широкого круга населения. Установлено государственное регулирование ввода иммунобиологических препаратов в гражданский оборот путем выдачи соответствующего разрешения Росздравнадзора на основании протокола испытаний каждой серии или партии иммунобиологического лекарственного препарата, проведенных в государственных лабораториях, подведомственных Минздраву России и Росздравнадзору. В 2020 году Росздравнадзором выданы 2780 разрешений на ввод в гражданский оборот иммунобиологических лекарственных препаратов.
Слаженная работа федеральных лабораторий Росздравнадзора с внедрением нового порядка ввода иммунобиологических лекарственных средств в гражданский оборот позволила своевременно обеспечить проведение вакцинации населения в соответствии с календарем профилактических прививок, а также посерийный контроль лекарственных препаратов, зарегистрированных по ускоренной процедуре в соответствии с Постановлением Правительства Российской Федерации от 03.04.2020 № 441 «Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для организации оказания медицинской помощи лицам, пострадавшим в результате чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов» в условиях сложной эпидемиологической ситуации.
В настоящее время Росздравнадзором ведется интенсивная работа по контролю качества и своевременному выпуску в гражданский оборот вакцин против коронавирусной инфекции.
Введение нового порядка выпуска лекарственных препаратов в гражданский оборот без подтверждения качества третьей стороной не повлияло на качество лекарственных препаратов на российском фармацевтическом рынке. Доказательством этому служат результаты государственного контроля, который осуществляется Росздравнадзором.
Результаты государственного контроля качества лекарственных средств в 2020 году
Всего в рамках государственного контроля (надзора) в сфере обращения лекарственных средств Росздравнадзором в 2020 году проверено качество 36 500 образцов лекарственных средств (рис. 3), что составило около 11,5% от количества серий, поступивших в обращение в 2020 году (по данным АИС Росздравнадзора – 316 530 серий). Следует отметить, что контроль качества лекарственных препаратов, находящихся в обращении, и работа лабораторных комплексов Росздравнадзора, проводящих испытания, не прекращались даже в периоды карантина.
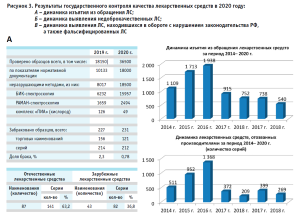
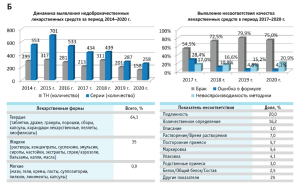
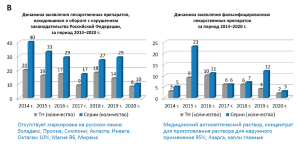
В 2020 году изъято из обращения 540 серий лекарственных средств, качество которых не отвечает установленным требованиям, что составляет 0,17% от общего количества серий, вводимых в гражданский оборот в Российской Федерации в 2020 году, в том числе: 158 торговых наименований 258 серий недоброкачественных лекарственных средств, 8 торговых наименований 10 серий лекарственных препаратов, находившихся в обращении с нарушением установленных законодательством требований, 2 торговых наименования 3 серий фальсифицированных лекарственных препаратов.
Для сравнения: в 2019 году при таком же количестве проверенных образцов выявленный брак составил 0,25%.
В ходе осуществления выборочного контроля качества лекарственных средств в 2020 году:
в связи с повторным выявлением несоответствия лекарственных средств установленным требованиям на посерийный выборочный контроль качества переведено 44 торговых наименования лекарственных средств;
снято с посерийного выборочного контроля качества 28 торговых наименований лекарственных средств.
В настоящее время при контроле качества лекарственных средств выявляется большое количество несоответствий по невоспроизводимости методик и ошибок в расчетных формулах утвержденной нормативной документации. С 1 января 2021 года в Российской Федерации регистрация лекарственных средств осуществляется по единым правилам Евразийского экономического союза. Есть возможность при процедуре приведения в соответствие регистрационного досье внести необходимые изменения в методики и формулы. Росздравнадзором в 2020 году обеспечен контроль за уничтожением субъектами обращения лекарственных средств 6 550 280 упаковок (шт.) лекарственных средств, качество которых не соответствовало установленным требованиям.
Несмотря на тенденцию снижения, не удалось добиться полного исчезновения с фармацевтического рынка недоброкачественных и фальсифицированных лекарственных средств, а также лекарственных средств, выпущенных с нарушением действующего законодательства.
В целях снижения негативных последствий от применения лекарственных средств, не отвечающих установленным требованиям к качеству, в 2020 году Росздравнадзором совместно с правоохранительными и следственными органами проведено 677 совместных мероприятий в сфере обращения лекарственных средств, в том числе в рамках международной операции «Пангея», направленной на борьбу с фальсификацией лекарственных препаратов.
В результате проведенной работы изъята из оборота продукция, качество которой не соответствует установленным требованиям, включая незарегистрированные, фальсифицированные и недоброкачественные лекарственные средства на общую сумму 4 111 433,58 руб., тем самым устранена угроза причинения вреда жизни и здоровью граждан. По фактам выявления незарегистрированных, фальсифицированных, недоброкачественных лекарственных средств возбуждено 11 уголовных дел по ст. 238.1 Уголовного кодекса Российской Федерации.
Внедрение Федеральной государственной информационной системы мониторинга движения лекарственных препаратов для медицинского применения
Одним из эффективных механизмов противодействия незаконному обороту медицинской продукции является введение маркировки лекарственных препаратов.
В целях обеспечения эффективного контроля качества лекарственных препаратов, находящихся в обращении, и борьбы с их фальсификацией пунктом 5 перечня поручений Президента Российской Федерации от 04.02.2015 № Пр-285 было поручено разработать и внедрить автоматизированную систему мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки и идентификации упаковок лекарственных препаратов. Система была создана в 2017 году.
С 1 февраля 2017 года по 31 декабря 2019 года на территории Российской Федерации проводился эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения.
В соответствии с Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» с 1 июля 2020 года введена обязательная маркировка для всех лекарственных препаратов для медицинского применения. Субъекты обращения лекарственных средств должны были с этой даты вносить сведения о маркированных лекарственных препаратах и обо всех операциях с ними в систему мониторинга (рис. 4).

Росздравнадзором проведена организационно-методическая работа по регистрации субъектов обращения лекарственных средств к системе мониторинга.
С 2017 года в Росздравнадзоре действует рабочая группа, участниками которой являются представители федеральных органов исполнительной власти, операторы системы, профильные фармацевтические ассоциации, оптовые, розничные и медицинские организации, отечественные и зарубежные производители лекарственных препаратов. Члены рабочей группы активно участвуют в развитии федеральной государственной информационной системы мониторинга движения лекарственных препаратов.
Нестабильная работа системы в сентябре-октябре 2020 года привела к затовариванию производственных, оптовых и аптечных складов, складов временного хранения лекарственными препаратами, в том числе лекарственными препаратами, включенными в перечень жизненно необходимых и важнейших лекарственных препаратов, что привело к задержке сроков поставки лекарственных препаратов конечному потребителю.
Правительство Российской Федерации упростило порядок работы с системой мониторинга лекарственных препаратов2. В настоящее время упрощенный порядок работы в системе мониторинга действует до 1 февраля 2022 года.
В связи с возможностью ввода в оборот немаркированных лекарственных препаратов до 31 декабря 2020 года, в гражданском обороте на территории Российской Федерации в настоящее время находится большое количество немаркированных лекарственных препаратов. Однако по сведениям автоматизированной информационной системы Росздравнадзора процент маркированных лекарственных препаратов, вводимых в гражданский оборот, на текущий момент составляет 99,9%.
В соответствии с Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» при выявлении несоответствия требований к качеству в рамках выборочного контроля качества лекарственных средств и федерального государственного контроля (надзора) в сфере обращения лекарственных средств, осуществляемых Росздравнадзором и территориальными органами, производится блокировка принятия системой мониторинга сведений о вводе в оборот лекарственных препаратов, об обороте или о выводе из оборота лекарственных препаратов в автоматическом режиме.
Введение маркировки уже на первом этапе реализации проекта позволило эффективно противодействовать такому явлению, как незаконная перепродажа лекарственных препаратов, поставленных по государственным и муниципальным контрактам.
Система маркировки также вносит существенный вклад в решение задач, связанных с мониторингом лекарственного обеспечения населения. В рамках федеральных инцидентов по вопросам обеспечения противоопухолевыми лекарственными препаратами, препаратами для лечения сердечно-сосудистых заболеваний и вакцинами для профилактики коронавирусной инфекции система позволяет проводить постоянный мониторинг наличия данных лекарственных препаратов в субъектах Российской Федерации, получать информацию о движении препаратов по товаропроводящей цепи, об имеющихся остатках в целях принятия оперативных решений по поставкам лекарственных препаратов в регионы.
Вопросы повышения эффективности выявления и профилактики нежелательных реакций лекарственных средств являются одним из приоритетных направлений деятельности Федеральной службы по надзору в сфере здравоохранения.
Постановлением Правительства Российской Федерации от 20.08.2010 № 650 «О внесении изменений в некоторые акты Правительства Российской Федерации в связи с принятием Федерального закона “Об обращении лекарственных средств”» государственная функция по проведению мониторинга безопасности лекарственных препаратов, находящихся в обращении на территории Российской Федерации, возложена на Росздравнадзор.
Организация проведения Фармаконадзора в Российской Федерации
Основным методом мониторинга безопасности и эффективности лекарственных препаратов во всех странах, включая Российскую Федерацию, является метод спонтанных сообщений. Данный метод основывается на получении от работников здравоохранения сообщений о нежелательных реакциях или отсутствии терапевтического эффекта лекарственных препаратов. Для этих целей создана, функционирует и в настоящее время активно развивается подсистема «Фармаконадзор 2.0» Автоматизированной информационной системы Росздравнадзора.
В 2019 году в данную подсистему внедрен международный формат ICH E2B (R3), который позволяет автоматически принимать сообщения из программных ресурсов по фармаконадзору отечественных и зарубежных разработок, поддерживать информационный обмен анонимизированными данными со Всемирной организацией здравоохранения в рамках программы международного мониторинга безопасности лекарственных средств.
В 2020 году в обновленную базу данных «Фармаконадзор 2.0» автоматизированной информационной системы Росздравнадзора поступило и рассмотрено 58 495 сообщений субъектов обращения лекарственных средств о нежелательных реакциях и терапевтической неэффективности при применении лекарственных препаратов, зарегистрированных на территории Российской Федерации.
Российская система регулирования обращения вакцин с высокими показателями прошла оценку Всемирной организации здравоохранения и признана функциональной с 2017 года. В частности, порядок выпуска серий в гражданский оборот и система расследования побочных проявлений после иммунизации получили высокую оценку в ходе оценки ВОЗ.
Мониторинг безопасности вакцин в Российской Федерации организован в соответствии с Методическими рекомендациями по выявлению, расследованию и профилактике побочных проявлений после иммунизации, утвержденными Минздравом России 12.04.2019.
Практически в каждом субъекте Российской Федерации созданы и активно ведут работу региональные иммунологические комиссии по расследованию побочных проявлений после иммунизации.
Региональные иммунологические комиссии подключаются к расследованию побочных проявлений после иммунизации, описанных в указанных Методических рекомендациях, и направляют результаты проведенного расследования в Роспотребнадзор и Росздравнадзор.
В целях оперативного наблюдения за состоянием здоровья граждан, получающих вакцины против новой коронавирусной инфекции, а также контроля нежелательных реакций Минздравом России во взаимодействии с Минкомсвязи России создан «цифровой контур», позволяющий отслеживать безопасность и качество вакцин против новой коронавирусной инфекции на всех этапах жизненного цикла. Он включает в себя регистр всех вакцинированных в составе Единой государственной информационной системы в сфере здравоохранения, систему мониторинга движения лекарственных препаратов, а также сервис «Дневник самонаблюдения», доступный для заполнения гражданами, прошедшими вакцинацию, посредством Единого портала государственных услуг или через мобильное приложение «Госуслуги».
Росздравнадзором проводится постоянный мониторинг безопасности иммунопрофилактики COVID-19. В случае необходимости запрашивается дополнительная информация, анализируются Акты расследования случаев побочных проявлений после иммунизации, анализируется сводная информация Дневников пациентов Единой государственной информационной системы в сфере здравоохранения.
В 2020 году по результатам фармаконадзора в Минздрав России направлено 29 писем о новых данных по безопасности и эффективности лекарственных препаратов для рассмотрения вопроса о необходимости внесения изменений в регистрационное досье лекарственного препарата.
В целях профилактики нарушений обязательных требований в области организации и проведения фармаконадзора Росздравнадзором 2020 году было направлено 109 предостережений держателям регистрационных удостоверений.
В Российской Федерации создана и эффективно функционирует система фармаконадзора, в том числе для препаратов, зарегистрированных в соответствии с Постановлением Правительства Российской Федерации № 441 «Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для организации оказания медицинской помощи лицам, пострадавшим в результате чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов», позволяющая оперативно реагировать на возможные проблемы безопасности лекарственных препаратов и своевременно нивелировать возникающие риски фармакотерапии.
Заключение
Подводя итоги, можно констатировать, что по всем направлениям контроля качества эффективности и безопасности лекарственных средств достигнуты значительные положительные результаты в совершенствовании контрольно-надзорной деятельности, реализованы значимые законодательные инициативы, проведена информатизация и цифровизация направлений деятельности, обеспечена открытость и доступность информации для субъектов обращения лекарственных средств и населения. Росздравнадзор продолжает развитие и совершенствование системы государственного контроля качества и эффективности лекарственных средств, что позволяет гарантировать безопасность их применения для пациентов.
_______________________________________________________________________
1 Распоряжение Правительства РФ от 18.09.2020 № 2390-р «Об утверждении Стратегии развития иммунопрофилактики инфекционных болезней на период до 2035 года». URL: https://www.garant.ru/products/ipo/prime/doc/74591684/
2 Постановление Правительства Российской Федерации от 02.11.2020 № 1779 «О внесении изменений в Положение о системе мониторинга движения лекарственных препаратов для медицинского применения».
