ЛЕКАРСТВЕННОЕ ОБЕСПЕЧЕНИЕ
Риск-ориентированный подход к прослеживаемости лекарственных препаратов в медицинских организациях
1 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Минздрава России, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
sova293@yandex.ru
ORCID: https://orcid.org/0000-0001-9110-446X
2 — Государственное бюджетное учреждение здравоохранения Ярославской области «Клиническая больница № 2», 150030, Российская Федерация, г. Ярославль, Суздальское ш., д. 39.
isaeva.ilona1988@mail.ru
ORCID: https://orcid.org/0000-0002-1053-7317
3 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Минздрава России, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.; Территориальный фонд обязательного медицинского страхования Ярославской области, 150000, Российская Федерация, г. Ярославль, ул. Советская, д. 11/9.
zamiralova@yartfoms.ru
4 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Минздрава России, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
sokolovaks89@mail.ru
ORCID: https://orcid.org/0009-0008-9110-6180
Внедрение системы цифровой маркировки и прослеживаемости лекарственных препаратов позволяет осуществлять полный контроль за их движением, что способствует предотвращению незаконного оборота, оптимизации финансовых расходов и повышению безопасности пациентов. Анализ международного опыта показал, что подходы к маркировке различаются в зависимости от особенностей национальных рынков, однако в России и ЕАЭС реализуются схожие технологии, обеспечивающие свободное перемещение качественных и безопасных лекарственных препаратов. Экспертами выделены риски: внешние (качество ЛП, поставщики) и внутренние (цифровая грамотность, синхронизация систем, ошибки документации). Предложены организационные и технологические решения: развитие цифровых компетенций специалистов, интеграция информационных систем.
Ключевые слова: оборот лекарственных препаратов в медицинской организации, маркировка лекарственных препаратов, Евразийский экономический союз (ЕАЭС), системы цифровой маркировки и прослеживаемости товаров, технологии прослеживаемости, учет оборота лекарственных средств, аптека медицинской организации, электронный документооборот, риск-ориентированный подход, персонализация лекарственной помощи
Введение
В современном российском обществе возможность сохранения и восстановления здоровья с помощью лекарственного обеспечения является важным параметром качества жизни индивидов, социальных групп, социума [1].
На выявление возможных проблемных ситуаций, оказывающих влияние на безопасность и качество лекарственной помощи, направлен риск-ориентированный подход, своевременно предотвращающий либо устраняющий возникающие риски.
Формирование цифрового поля здравоохранения путем интеграции государственных информационных систем с региональными и локальными информационными сегментами здравоохранения позволит прослеживать весь процесс лекарственного обеспечения в медицинской организации: от проверки адекватности назначения ЛП в соответствии с клиническими рекомендациями до оценки остатков ЛП как в аптеке, так и других структурных подразделениях медицинской организации (МО) [2].
Одним из инструментов обеспечения безопасности и качества ЛП, а значит предотвращения рисков при обороте ЛП, является система мониторинга ЛП. Основными элементами мониторинга является проверка достоверности средств идентификации и прослеживаемость движения ЛП. Так, каждая упаковка ЛП имеет уникальный идентификационный номер, который позволяет отслеживать его происхождение и подлинность [3]. Также система обеспечивает возможность отслеживания пути каждого ЛП от производителя лекарственных средств до конечного потребителя, включая регистрацию всех этапов обращения ЛП – производство, хранение, транспортировку и реализацию. Данная система поддерживается на законодательном уровне, устанавливая требования маркировке, а также определяя ответственность производителей, дистрибьюторов и аптечных организаций за соблюдение правил оборота ЛП [4].
Цель исследования
Совершенствование процесса прослеживаемости лекарственных препаратов при оказании лекарственной помощи пациентам в медицинских организациях для снижения рисков. Задачами исследования явилось изучение вопросов, связанных с развитием прослеживаемости и маркировки товаров за рубежом и в Российской Федерации (РФ). Обоснование положительных характеристик прослеживаемости упаковок ЛП, способствующих удовлетворению потребителей ЛП, структурирование преимуществ прослеживаемости ЛП. Выявление перечня рисков при обороте лекарственных препаратов в медицинской организации на основе экспертных мнений.
Материалы и методы
Материалами послужили нормативная документация, отражающая прослеживаемость и маркировку ЛП, данные государственной системы маркировки и прослеживаемости товаров «Честный знак», товарно-учетные системы медицинских организаций (ТУС МО), анкеты экспертов.
Использовались методы систематизации, типологизации, логического и структурного анализа, экспертных оценок, контент-анализа нормативно-правовых актов и научных публикаций.
Для выявления рисков при обороте ЛП в МО проведена экспертная оценка. Экспертами выступили заведующие аптек медицинских организаций Ярославской области (11 человек с высшим фармацевтическим образованием, средний возраст 50±8,5 лет, из них 90,0% – женщины), непосредственно отвечающие за организацию и контроль всех этапов движения ЛП в МО – от поступления и хранения до отпуска и списания.
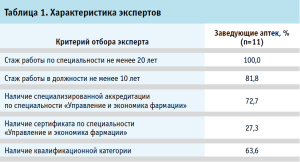
В таблице 1 представлены критерии отбора экспертов.
Для оценки степени согласованности между экспертами использовали коэффициент конкордации Кендалла (W) (1):
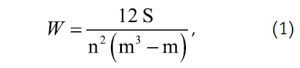
где:
S – сумма квадратов отклонений суммы рангов каждого объекта экспертизы от среднего арифметического рангов;
n – число экспертов;
m – число объектов экспертизы.
Величина коэффициента конкордации лежит в пределах от 0 до 1. Установлено, что эксперты согласованы во мнениях (W=0,74).
Результаты и обсуждение
Установлено, что потребность в контроле и отслеживании ЛС значима для всех участников оборота ЛП.
Проведен анализ литературных источников, посвященных маркировке ЛП средствами идентификации. Выявлены перспективы развития этого направления в России, а также рассмотрены системы отслеживания товаров в различных странах мира. Также в научных публикациях приводятся основные отличительные особенности маркировки ЛП на территории РФ по сравнению с системами маркировки других стран [5].
Обзор научной литературы выявил, что международный опыт маркировки ЛП в странах Евросоюза, Азии и Америки воспринят с большой осторожностью – от введения в действие до полного отказа. Так, в Китае отсутствуют жесткие правила для участников маркировки товаров. Маркировка просто практикуется в бизнесе, а производители лекарственных средств (ЛС) делают добровольные взносы на поддержание этого проекта. В США действуют несколько систем маркировки ЛП одновременно, конкурирующие между собой. В каждой стране есть свои особенности внутреннего рынка, что обусловлено разными подходами к формированию кодов маркировки и объема информации, заложенного в нем. По данным ВОЗ, имеется положительное значение маркировки ЛП, поскольку позволяет проследить все стадии жизненного цикла ЛП [6].
Также нами рассмотрен процесс маркировки ЛП в государствах – членах Евразийского экономического союза (ЕАЭС). Установлено, что государства – члены ЕАЭС технически готовы к внедрению маркировки лекарств и уже начали ее применять. Однако не все из них определили конкретные сроки для полного перехода на эту практику.
В России маркировка лекарств начала внедряться в 2017 году и уже показала свою эффективность. Этот опыт успешно применяют в рамках межгосударственного взаимодействия стран ЕАЭС. Совершенствование системы цифровой маркировки и прослеживаемости товаров проводится на основе сравнительного анализа обязательных атрибутов ЛП [9], выделяются проблемы использования маркировки, предлагаются направления ее улучшения и развития в целях повышения экономической безопасности посредством развития системы прослеживаемости в ЕАЭС [7, 8, 9, 10].
На основе взаимосвязи участников товаропроводящей цепочки обеспечивается прослеживаемость всех товарных групп. Формирование бизнес-процессов и технологий цифровой маркировки и прослеживаемости отрабатывается производителями, дистрибьюторами, фармацевтическими и медицинскими организациями, включая оператора системы ЦРПТ (Честный знак). Особое внимание уделяется общественному контролю через мобильные приложения на всех этапах движения лекарственных препаратов. Цифровой код маркировки обеспечивает единое решение для всех товарных групп. Его сложно подделать, а информацию о товаре невозможно удалить из системы. [11].
Сегодня в России и странах ЕАЭС используются одинаковые процессы и технологии цифровой маркировки. Это позволяет без проблем перемещать качественные и безопасные товары через границы государств.
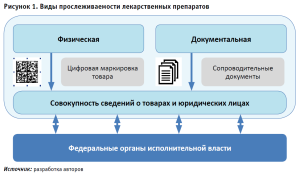
На современном этапе законодательство РФ активно поддерживает внедрение технологий прослеживаемости как комплекса мероприятий, обеспечивающих регистрацию движения товаров по товаропроводящей сети с момента нанесения средства идентификации или контрольного (идентификационного) знака, а также автоматизированное предоставление юридически значимых сведений о совершенных операциях с единицей товара и их обработку в ГИС [12]. На рисунке 1 представлены виды прослеживаемости ЛП. Введенные в гражданский оборот ЛП имеют прослеживаемость, физически выраженную в коде DataMatrix на упаковке и документально подтвержденную сопроводительными документами в электронном виде или на бумажном носителе.
На основе анализа нормативно-правовых актов выявлены и охарактеризованы ряд преимуществ прослеживаемости ЛП, способствующие повышению уровня здравоохранения и защите прав потребителей. Анализ нормативно-правовых актов [4, 13, 14] позволил классифицировать преимущества прослеживаемости ЛП по признаку социальной структуры общества – индивида и совокупности людей, объединенной едиными признаками (табл. 2).
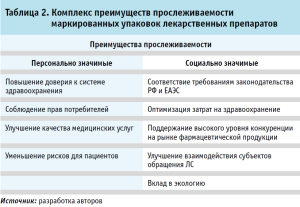
Нами были выделены две группы – персонально значимые и социально значимые, структурированные в зависимости от персональной безопасности пациента и улучшения общественного здоровья. Следовательно, прослеживаемость ЛП позволяет вести учет оборота лекарственных средств не только для целей и задач государства, но и персонализации лекарственной помощи пациентов.
Важно учитывать аспекты, которые минимизируют риски, при сохранении преимуществ системы прослеживаемости. Эксперты выделяют риски при обороте лекарств в медицинских организациях, разделяя их на внешние и внутренние, в зависимости от этапа оборота. Внешние риски связаны с поставщиком лекарств и их качеством, которое определяется производителем, Росздравнадзором и другими органами. Внутренние риски включают бизнес-процессы аптеки и структурных подразделений медицинской организации, а также компетенции специалистов.
В таблице 3 представлен анализ рисков.

Представленный перечень рисков, как внешних, так и внутренних, указывает, что нарушения условий хранения и транспортирования ЛП приводят к потере качества, сохранности ЛП; ошибки в сопроводительной документации и/ или невыполнение обязательств поставки – к срывам поставок, искажениям сроков годности. Учет движения ЛП осуществляется на базе цифровых платформ с соответствующим программным обеспечением на соответствующих технологических устройствах. Все бизнес-процессы сопровождаются фармацевтическими и медицинскими специалистами с определенными цифровыми знаниями. Низкая цифровая грамотность специалистов и отсутствие синхронизации между программами для целей мониторинга ЛП по различным параметрам приводит к появлению дельты между внешними данными цифровой маркировки и внутренними данными ТУС. Своевременный мониторинг рисков обеспечивает качество услуг.
Совершенствование прослеживаемости ЛП в медицинской организации возможно на основе выявленных рисков путем разработки комплекса организационных и технологических решений.
В настоящее время выбытие ЛП определено для МО на этапе оказания медицинской помощи законодательно. Однако в практической деятельности это выполняется частично, поскольку для МО с одним местом деятельности аптеки и структурного подразделения паспорт бизнес-процесса выбытия ЛП не сформирован [15]. Схема прослеживаемости ЛП в МО представлена на рисунке 2.
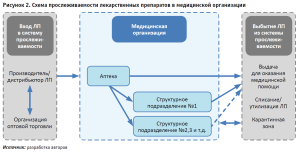
Функционал ТУС МО позволяет оперативно получать полные статистические данные о движении упаковок ЛП. В связи с этим, нами предложена база данных (БД) для ТУС МО «Рекомендации по управлению движением упаковок лекарственных препаратов в медицинской организации с одним местом деятельности» для целей прослеживаемости каждой упаковки ЛП в структурных подразделениях [16].
В результате внедрения БД возможен контроль за всеми бизнес-процессами, включая выдачу ЛП для оказания медицинской помощи, регулирование объема товарных запасов, хранение ЛП, отслеживание сроков годности ЛП как в аптеке МО, так и в структурных подразделениях.
Выводы
Риск-ориентированный подход к прослеживаемости лекарственных препаратов в медицинских организациях непосредственно влияет на безопасность лечения и поддержание общественного здоровья в целом. Выявленные риски при обороте лекарственных препаратов в медицинской организации позволяют разработать предложения по совершенствованию прослеживаемости ЛП в медицинских организациях, сформировать базу локальных нормативно-правовых документов (положения, приказы, стандартные операционные процедуры), организовать образовательные мероприятия для специалистов здравоохранения.
Принятие организационных решений позволяет повысить ответственность фармацевтических и медицинских работников, осуществляющих внесение информации в систему мониторинга движения ЛП, а также повысить удовлетворенность пациентов лекарственной помощью. Реализация технологических решений актуализирует оснащенность рабочих мест фармацевтических и медицинских работников, предотвращает незаконный оборот ЛП, оптимизирует финансовые расходы на лекарственное обеспечение.
Следовательно, комплексный подход к прослеживаемости ЛП снижает риски неблагоприятных последствий применения ЛП у пациентов во время лечения.
- Мельникова О.А., Смирнов А.В., Марченко С.Д., Мельников М.Ю. Модель риск-ориентированного подхода при осуществлении фармацевтической деятельности // Фармация. – 2022. – № 2. С. 41–48.
- Кузнецов П.П. О системе медицинских информационно-аналитических центров. // Врач и информационные технологии. – 2004. –№ 6. – С. 14–19.
- Котиков В.Н., Петросянц В.А. Внедрение системы прослеживания образцов лекарственных средств // Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. – 2015. – № 3. – С. 28–31.
- Постановление Правительства РФ от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения». URL: https://base.garant.ru/72136156/
- Погодина И.В., Гоглова Е.Г. Маркировка товара в странах мира // Вестник Владимирского государственного университета имени Александра Григорьевича и Николая Григорьевича Столетовых. Серия: Юридические науки. – 2022. – № 3(33). – С. 35–38.
- Денисова А.С., Кузнецова А.А. Маркировка лекарственных препаратов: опыт и проблемы внедрения, направления цифровизации // Российский экономический интернет-журнал. – 2023. – № 1.
- Васильева М. В., Васильева М.А. Роль технологий прослеживаемости товаропотоков в обеспечении безопасности государства // Образование и право. – 2021. – № 8. – С. 124–130.
- Иваницкая А.Е. Цифровая маркировка товаров как мера обеспечения экономической безопасности: перспективы и риски // Проблемы региональной и глобальной безопасности в современном мире: материалы V Всероссийской научно-практической конференции с международным участием преподавателей и студентов, Владимир, 25 апреля 2023 года. – Владимир: КопиА-Сервис, 2023. – С. 35–41.
- Коварда В.В., Лаптев Р.А., Тимофеева О.Г. Перспективы повышения уровня экономической безопасности в контексте цифровизации экономических процессов посредством развития системы прослеживаемости в ЕАЭС // Вестник евразийской науки. – 2020. – Т. 12, № 5. – С. 5.
- Лаптев Р. А., Коварда В. В., Рогов Р. А. Основные направления развития системы прослеживаемости товаров в качестве фактора обеспечения безопасности России в условиях расширения процесса глобализации // Вестник евразийской науки. – 2020. – Т. 12, № 1. – С. 54.
- Формируется Российская система маркировки и прослеживаемости лекарственных средств // Менеджмент качества в медицине. – 2019. – № 2. – С. 26–29.
- Самойлова А.В., Кудрявцева Е.М. Федеральная государственная информационная система мониторинга движения лекарственных препаратов для медицинского применения – цифровой инструмент в сфере контроля за обращением лекарственных средств // Вестник Росздравнадзора. – 2022. – № 3. – С. 6–15.
- Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». URL: https://base.garant.ru/12174909/
- Распоряжение Правительства РФ от 28.12.2018 № 2963-р «Об утверждении Концепции создания и функционирования в Российской Федерации системы маркировки товаров средствами идентификации и прослеживаемости движения товаров».
- Соколова О.В., Исаева И.Ю., Лаврентьева Л.И., Куликова О.А. Актуальные вопросы внедрения маркировки лекарственных средств в информационные системы медицинской организации // Кардиоваскулярная терапия и профилактика. – 2023. – Т. 22, № S6. – С. 117.
- Свидетельство о государственной регистрации базы данных № 2023623905 Российская Федерация. Рекомендации по управлению движением упаковок лекарственных препаратов в медицинской организации с одним местом деятельности: № 2023623693: заявл. 02.11.2023: опубл. 13.11.2023 / О.В. Соколова, И.Ю. Исаев; заявитель федеральное государственное бюджетное образовательное учреждение высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
