ЗАРУБЕЖНЫЙ ОПЫТ
Разработка и внедрение национальной системы надлежащих практик (GxP) в фармацевтическую отрасль Республики Узбекистан
1 — ГУП «Центр надлежащей практики» Агентства по развитию фармацевтической отрасли при Министерстве здравоохранении Республики Узбекистан, 100084, г. Ташкент, ул. Чингиза Айтматова, дом 1-А.
2 — Ташкентский фармацевтический институт (ToshFarmI), 100015, Республика Узбекистан, г. Ташкент, ул. Ойбека, д. 45.
В статье представлена аналитическая работа по комплексу организационных мер, направленных на создание условий для повышения качества и эффективности фармацевтической продукции в целях сохранения жизни и здоровья населения, а также для создания свободных экономических фармацевтических зон, развития государственно-частного партнерства и привлечения инвестиций в здравоохранение.
Ключевые слова: национальный стандарт «Надлежащая аптечная практика» Республики Узбекистан, реформы в фармацевтической отрасли, фармацевтические предприятия, контроль качества лекарственных средств, требования к производству лекарственных средств, требования к организации контроля качества лекарственных средств, система надлежащих практик GxP, развитие фармацевтической промышленности, качество и эффективность фармацевтической продукции
Правила GxP – нормативный документ, определяющий общие требования к производству лекарственных средств и требования к организации контроля качества, а также специальные требования к организации производства отдельных видов лекарственных средств. Внедрение правил GxP на фармацевтических предприятиях свидетельствует о том, что в обращении лекарственных средств существует принятая парадигма обеспечения безопасности препаратов от контроля качества производственного процесса до завершения доставки потребителю.
Фармацевтическая отрасль Республики Узбекистан имеет специфику производственного труда, а также некоторые особенности социально-экономической ситуации, которые следует учитывать при разработке и внедрении стандартов в различных сферах деятельности.
Лекарственными препаратами является продукция, дозированные, упакованные лекарственные средства, готовые к применению и зарегистрированные уполномоченным органом с целью медицинского применения для населения. Учитывая, что производители несут ответственность за безопасность, эффективность и качество зарегистрированных государством лекарственных средств, соблюдение всех установленных стандартов практики GxP всеми участниками жизненного цикла лекарственных средств является необходимой гарантией обеспечения безопасности этих лекарственных средств.
В международной практике в рамках схемы сотрудничества ВОЗ и Европейского сообщества (ЕС) по фармацевтической инспекции (PIC/S) разработан комплексный набор рекомендаций по организации проверяющего органа и процедурам проверки. Сборник объединяет органы здравоохранения 48 стран мира – накопленный опыт организации проверок национальными органами здравоохранения США, Великобритании, Канады, Австралии и Японии.
В рамках подготовки документов, направленных на обеспечение функционирования общего рынка лекарственных средств Евразийского экономического союза, Евразийская экономическая комиссия преимущественно осуществляет фармацевтические инспекции на основе европейского опыта и документов PIC/S «Правила проведения фармацевтических инспекций», «Порядок обеспечения совместных фармацевтических инспекций» и «Общие требования к системе качества фармацевтических инспекций».
Данная процедура предусматривает выявление слабых мест в системе качества производителей и определение приоритетов для ее соответствующего усиления. Основываясь на руководстве ВОЗ по проверке производителей лекарств, госинспектор должен пояснять нормы, которые призваны обеспечить соблюдение производителями уровня производства, всех условий лицензирования и, прежде всего, положений GMP и существующих стандартов1.
На сегодняшний день на основании постановления президента Республики Узбекистан от 22.01.2022 № УП-55 «О дополнительных мерах, связанных с опережающим развитием фармацевтической промышленности республики в 20222026 годах», с 1 апреля 2022 года вновь создающиеся и организованные производственные организации, оптовые и розничные организации, реализующие лекарственные средства и изделия медицинского назначения, должны соответствовать требованиям «Надлежащей производственной практики (GMP)», «Надлежащей практики дистрибуции (GDP)» и «Надлежащей фармацевтической (аптечной) практики (GPP)».
В целях дальнейшего улучшения обеспечения населения лекарственными средствами, изделиями медицинского назначения и медицинской техникой с гарантированными качеством, безопасностью и эффективностью, а также совершенствования процессов упорядочения оборота фармацевтической продукции подписан Указ президента Республики Узбекистан от 23.01.2024 № УП-20 «О дополнительных мерах по регулированию фармацевтической отрасли»2.
За последние пять лет в республике отечественный фармацевтический рынок продемонстрировал рост внедрения новых видов продукции и увеличение объемов производства.
Например, если в 2018 году произведено фармацевтической продукции на сумму более чем 1,5 трлн UZS, а в 2023 году (по состоянию на 1 августа), – на сумму более чем 5,2 трлн UZS, таким образом зафиксирован средний рост в 4,5 раза. Произведено промышленной продукции на сумму 2,48 трлн UZS в январе–июле текущего года (по плану 92% или 112% по сравнению с аналогичным периодом прошлого года).
За этот период объем произведенной продукции увеличился в среднем в 4,5 раза, произведено медикаментов на сумму 1,5 трлн UZS, товаров медицинского назначения и медицинской техники на сумму 642,2 млрд UZS, другой фармацевтической продукции на сумму 339,7 млрд UZS (рис. 1).
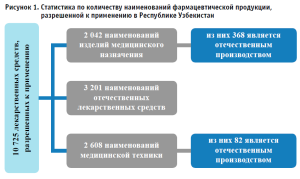
Особое место в обращении лекарственных средств и изделий медицинского назначения занимает розничная реализация. Необходимо отметить, что реализация иных продуктов аптечного ассортимента должна также осуществляться с соблюдением требований национального стандарта Республики Узбекистан O‘z MSt 140:2024 «Надлежащая аптечная практика (GPP)».
Для совершенствования стандарта с целью гармонизации с международными стандартами, а также в целях обеспечения реализации программы мер по реализации концепции развития аптечной сети Республики Узбекистан на 2020–2024 годы, утвержденной постановлением президента Республики Узбекистан от 30.12.2019 № ПП-4554 «О дополнительных мерах по углублению реформ в фармацевтической отрасли Республики Узбекистан», разработан и утвержден национальный стандарт надлежащей аптечной практики (GPP).
Стоит отметить, что национальный стандарт «Надлежащая аптечная практика» (GPP) включает правила организации фармацевтической деятельности в направлении розничной реализации и изготовления лекарственных средств и изделий медицинского назначения для специалистов с фармацевтическим образованием в целях обеспечения качества фармацевтических услуг.
Стандарт состоит из следующих частей: область применения, основные принципы, система управления качеством, деятельность фармацевтического персонала по внедрению системы качества в аптеке, помещение и оборудование, документы, процедуры, самоинспекция, фармацевтическая консультация, пропаганда здорового образа жизни и рационального использования лекарственных средств.
Стандарт разработан в целях обеспечения качества фармацевтических услуг, оказываемых фармацевтическими работниками аптек населению Республики Узбекистан. Нормы стандарта определяют требования в системе управления качеством, гармонизированные с требованиями передовой аптечной практики развитых стран, позволяющими обеспечить население качественными, безопасными лекарственными средствами и изделиями медицинского назначения, предоставление достоверной информации о лекарственных средствах, пропагандирование здорового образа жизни и профилактики заболеваний. Кроме этого, внедрение стандарта предполагает соблюдение правил, регулирующих рациональное использование рецептурных лекарственных препаратов, а также предоставление информации о возникших побочных эффектах лекарств, а также оказании помощи в самолечении.
Стандарт регламентирует изготовление лекарственных средств в аптеке, контроль их качества, упаковку и маркировку, хранение, контроль срока годности изготовленных препаратов, требования к розничной реализации (распределению) лекарственных средств и изделий медицинского назначения в аптеках, предусмотренных законодательством Республики Узбекистан.
GPP – это практика в аптеке, отвечающая потребностям пациентов и включающая оказание оптимальной, доказательной помощи (ухода), основным принципом которой является забота о пациенте, индивидуальный подход к каждому. Согласно GPP, пациент имеет право перед покупкой препарата узнать всю информацию о препарате, включая его основные компоненты, преимущества и противопоказания. То есть государственный стандарт обязывает всех фармацевтических работников нести такую же ответственность, как и врач, выписывающий рецепт.
В частности, формирование и совершенствование системы качества в аптеке, получение новых знаний и профессиональных навыков сотрудниками по проблемам контроля фармацевтической деятельности осуществляется на основе применения требований национального стандарта «Надлежащая аптечная практика» (GPP)3.
При реализации GPP в аптечной практике регламентируются основные принципы фармации, комплекс норм, действий, процессов и механизмов работы аптеки.
Внедрение системы управления качеством в аптечную практику обеспечит:
- анализ движения финансовых потоков и потребности в лекарственной продукции аптеки, соблюдение правил приема и хранения лекарственных средств, а также получение информации о самых дешевых лекарствах, прежде всего, выявит процессы, влияющие на качество фармацевтических услуг;
- взаимодействие процессов, необходимых для обеспечения системы качества;
- обеспечение населения качественной, безопасной, эффективной аптечной продукцией;
- организацию необходимых мер по постоянному улучшению качества обслуживания клиентов и повышению личной ответственности сотрудников;
- обеспечение обслуживания информационных систем в соответствии с требованиями нормативно-правовых документов;
- рациональное использование лекарственных средств, изделий медицинского назначения (в том числе сведение к минимуму случаев злоупотребления и их неправильного применения);
- пропаганду здорового образа жизни и профилактику заболеваний, организацию мероприятий по улучшению здоровья населения.
Ключевое требование GPP заключается в том, что основной профессиональной заботой фармацевтических работников является благополучие пациента. Хотя экономическая составляющая дела также важна, главным принципом должно быть благополучие обратившегося за помощью.
Основными нормативными документами, определяющими стандарты GxP и порядок сертификации на территории Республики Узбекистан, являются постановления Кабинета министров Республики Узбекистан от 18.09.2019 № 788 «О дополнительных мерах по внедрению требований необходимых практик (GxP) в фармацевтическую отрасль» и от 03.08.2021 № 486 «О дополнительных мерах по реализации требований надлежащей практики (GxP) в фармацевтической промышленности». Эти документы определяют порядок проведения проверок на соответствие требованиям национальных стандартов Good Practices (GxP).
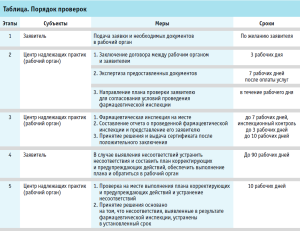
Заявитель на проведение фармацевтической инспекции представляет в рабочий орган Республики Узбекистан (ГУП «Центр надлежащих практик» Агентства по развитию фармацевтической отрасли при Министерстве здравоохранения Республики Узбекистан) следующие документы: в соответствии с утвержденным Положением принимаются заявления, документы по перечню документированных типовых операционных процедур и процессов системы менеджмента качества, документы производственной зоны (для производителей) и проводятся проверки по порядку, указанному в таблице.
Согласно законодательству Республики Узбекистан сертификат о соответствии стандартам выдается сроком на три года4.
Изучен опыт ряда зарубежных стран, в частности, нормативные документы Российской Федерации по методике определения размера оплаты за оказание услуг по проведению фармацевтических инспекций производства лекарственных средств для медицинского применения, расположенного на территории Российской Федерации, на соответствие требованиям правил надлежащей производственной практики Евразийского Экономического Союза и проведению фармацевтических инспекций производства лекарственных средств для медицинского применения, расположенного за пределами Российской Федерации, на соответствие требованиям правил надлежащей производственной практики Евразийского Экономического Союза, в том числе совместно с фармацевтическими инспекторатами иного государства – члена Евразийского Экономического Союза, в целях выдачи сертификата (сертификатов) соответствия производителя (производителей) лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики Евразийского Экономического Союза, и предельного размера платы за оказание указанных услуг5.
Для организации процесса инспектирования заявителей на соответствие требованиям соответствующих стандартов в Республике Узбекистан разработана «Методика определения размеров оплаты услуг, оказываемых при фармацевтической инспекции».
Приказом ГУП «Центр надлежащих практик» Агентства по развитию фармацевтической отрасли при Министерстве здравоохранения Республики Узбекистан от 26.08.2022 № 28 утверждена методика определения оплаты услуг, оказываемых во время проверки фармацевтических производств, лабораторий и баз, проводящих клинические исследования, и иностранных фармацевтических производств на соответствие требованиям надлежащих практик (GxP). Целью разработанной методики является определение размера экономически обоснованной оплаты оказанных услуг.
В целях совершенствования процедуры выдачи сертификата (сертификатов) соответствия требованиям Надлежащей практики (GxP) на лекарственные средства, применяемые в медицинских целях, разработанная методика устанавливает порядок определения размера оплаты оказанных услуг в соответствии с национальными требованиями и с учетом особенностей отдельных процессов по каждому из государственных стандартов:
- производителей лекарственных средств в соответствии с национальными требованиями Надлежащей производственной практики (GMP);
- клинических баз Министерства здравоохранения Республики Узбекистан, проводящих клинические исследования в соответствии с национальными требованиями Надлежащей клинической практики (GCP);
- лабораторий, проводящих доклинические исследования фармацевтической продукции, в соответствии с национальными требованиями Надлежащей лабораторной практики (GLP);
- отечественных предприятий, занимающихся оптовой реализацией лекарственных средств и изделий медицинского назначения в соответствии с национальными требованиями Надлежащей практики дистрибуции (GDP);
- аптек, занимающихся розничной реализацией лекарственных средств и изделий медицинского назначения в соответствии с национальными требованиями Надлежащей аптечной практики (GPP).
Кроме этого, методикой регламентируется порядок определения размера оплаты оказанных услуг в соответствии с национальными требованиями и порядок проведения фармацевтической проверки соблюдения Основных производственных практик (GМP) предприятий по производству лекарственных средств, расположенных за пределами территории Республики Узбекистан.
Размер оплаты оказания услуги определяется отдельно по заявке, в соответствии с наименованиями работ, выполняемых при оказании услуги, с указанием фактических трудозатрат, а также с учетом экономически обоснованного материала и затраты на рабочую силу.
Размер оплаты за оказание услуги (далее – цена) определяется по следующей формуле:
К = Т Ци (1 + (Kih + Kbx) / 100) + П + НДС,
где:
Т – трудозатраты (человеко-часы) по каждой конкретной работе, выполняемой Центром надлежащих практик Агентства по развитию фармацевтической отрасли при Министерстве здравоохранения Республики Узбекистан, определяемые общей продолжительностью работы;
Ци – стоимостная оценка одного часа работы одного фармацевтического инспектора, уполномоченного на проведение фармацевтической инспекции (в соответствии с трудовым законодательством Республики Узбекистан с учетом всех отчислений и поощрительных выплат);
Kih – коэффициент (процент), рассчитываемый к ежемесячному окладу фармацевтического инспектора в соответствии с налоговым законодательством Республики Узбекистан;
Kbx – коэффициент косвенных расходов уполномоченного учреждения, который не может быть включен непосредственно в расходы, связанные с оказанием услуги (в процентах);
П – прибыль;
НДС – налог на добавленную стоимость, исчисляемый по ставкам, установленным Налоговым кодексом Республики Узбекистан на дату выставления счета-фактуры.
При необходимости выезда в командировку для проведения фармацевтической инспекции расходы, связанные с командировкой, оплачиваются на основании соответствующего договора, заключенного с заявителем, помимо суммы оплаты оказанной услуги.
К прочим расходам служебной командировки, непосредственно связанным с оказанием услуги, относятся следующие расходы, подтвержденные документально:
- заказ авиаи ж/д билетов;
- бронирование отелей;
- обязательные консульские и аэропортовые сборы;
- сборы за право подъезда или транзита автотранспортных средств;
- другие обязательные сборы и сборы, понесенные в связи с фармацевтической инспекцией6.
На сегодняшний день во всех фармацевтических организациях, действующих на территории Республики Узбекистан, введены требования надлежащих практик (GxP). Выдано 389 сертификатов на соответствие GхP (рис. 2), из них:
104 – «Надлежащая производственная практика (GMP)»;
210 – «Надлежащая практика дистрибуции (GDP)»;
1 – «Надлежащая лабораторная практика (GLP)»;
1 – «Надлежащая практика хранения (GSP)»;
73 – «Надлежащая аптечная практика (GРP)».

Требования к системам обеспечения качества продукции и услуг, производимых в рамках процессов жизненного цикла лекарственных средств в Республике Узбекистан, возрастают, одним из показателей является внедрение требований надлежащих практик (GxP).
Требования надлежащих практик (GxP) являются основными составляющими фармацевтической системы качества, обеспечивающими качество всех процедур производства, хранения, реализации лекарственных средств и наличие постоянного контроля качества.
В целях достижения эффективности реализации требований надлежащих практик (GxP) необходимо усилить переход к соответствующим стандартам качества во всех сферах, которые непосредственно влияют на качество препарата – от производителя до конечного потребителя. При этом меры по дальнейшему развитию фармацевтической промышленности Республики Узбекистан должны планироваться на основе научно обоснованного анализа фармацевтического рынка и системы здравоохранения в целом, с определением реализации качественных, безопасных препаратов.
__________________________________________________________________________
1 Надлежащая аптечная практика (НАП) в общественных и больничных аптеках (ВОЗ).
2 Указ президента Республики Узбекистан от 23.01.2024 № УП-20 «О дополнительных мерах по регулированию фармацевтической отрасли». (Национальная база данных законодательства, 24.01.2024 № 06/24/20/0063).
3 Приказ Государственного учреждения «Научно-исследовательский институт стандартизации, сертификации и технического регулирования» (Институт стандартов Узбекистана) Агентства технического регулирования Узбекистана при Министерстве инвестиций и внешней торговли Республики Узбекистан №10/МСт от 26.04.2024 «Национальный стандарт O‘z MSt 140: 2024 «Надлежащая аптечная практика (GPP)».
4 Постановление Кабинета министров Республики Узбекистан от 18.09.2021 №-788 «О дополнительных мерах по внедрению требований надлежащей практики (GXP) в фармацевтическую отрасль». (Национальная база данных законодательства 27.10.2022 г. №07/22/411/0961).
5 Приказ Министерства промышленности и торговли Российской Федерации от 20.01.2020 № 90.
6 Приказ ГУП «Центр надлежащих практик» Агентства по развитию фармацевтической отрасли при Министерстве здравоохранения Республики Узбекистан 26.08.2022 № 28 «Методика определения оплаты услуг, оказываемых во время проверки фармацевтических производств, лабораторий и баз, проводящих клинические исследования, и иностранных фармацевтических производств на соответствие требованиям надлежащих практик (GxP)».
1. Чукреева Н.В., Максимкина Е.А. Построение модели развития систем качества в фармацевтической отрасли // Фармация. – 2006. – № 2. – С. 13–16.
