КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Разработка и валидация методики аутентификации капсулированного лекарственного препарата неразрушающим экспресс-методом БИК-спектрометрии и хемометрическими методами анализа
1 — Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр.1.
ORCID: https://orcid.org/0000-0002-2829-8801
2 — Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр.1.
3 — Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр.1.; Федеральное государственное бюджетное учреждение науки «Федеральный исследовательский центр химической физики им. Н.Н. Семенова» Российской академии наук, 119334, Российская Федерация, г. Москва, ул. Косыгина, д. 4.
ORCID: https://orcid.org/0000-0002-0146-8284
4 — Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр.1.; Федеральное государственное автономное образовательное учреждение высшего образования «Первый Московский государственный медицинский университет имени И.М. Сеченова Минздрава России (Сеченовский Университет)», 119048, Российская Федерация, г. Москва, ул.Трубецкая, д. 8, стр. 2.
ORCID: https://orcid.org/0000-0002-0636-3254
Одним из способов защиты рынка от некачественных и фальсифицированных лекарственных препаратов является аутентификация лекарственных средств. Сочетание спектрометрии в ближней инфракрасной области (БИК-спектрометрия) с хемометрическим анализом (БИК-анализ) является одним из приоритетных методов для этой цели, поскольку позволяет быстро проводить измерения препарата без нарушения целостности первичной упаковки и не требует пробоподготовки образца. В качестве объекта исследования был изучен препарат «Рибавирин», капсулы 200 мг. Цель работы – разработка БИК-спектральной модели для аутентификации указанного препарата. Для моделирования был использован метод одноклассовой классификации. Изучены различные способы предобработки спектров и методы вычисления модели. C помощью валидации были найдены оптимальные условия построения модели: метод вычисления коэффициента корреляции Пирсона без предобработки спектров в рабочем диапазоне 12 000–6000 и 5500–4400 см-1. Общая чувствительность модели – 100,0 %, специфичность – 99,9 %. Анализ результатов показал, что все факторы (рабочий диапазон, способ предобработки спектров, метод построения модели и спектральная характеристика образца) являются значимыми в процессе построения модели и в разных сочетаниях могут проявляться с разной силой. Поэтому поиск оптимальных условий построения аутентичной модели может быть осуществлен путем исследования всех возможных вариантов, как это описано в статье.
Ключевые слова: аутентификация лекарственных средств, БИК-спектрометрия, хемометрический анализ, метод одноклассовой классификации, предобработка спектров, валидация модели
Введение
Одним из способов защиты рынка от некачественных и фальсифицированных лекарственных препаратов является их аутентификация. В литературе описаны разные способы ее реализации [1–7], среди них наиболее часто используется спектрометрия в ближней инфракрасной области (БИК-спектрометрия) в сочетании с хемометрическими методами анализа (БИК-анализ).
Очевидными достоинствами БИК-спектрометрии являются возможность выполнения испытания препарата без разрушения первичной упаковки и самого препарата, быстрота измерения, отсутствие деструктивного воздействия на анализируемый образец, что позволяет после завершения испытания вернуть его в гражданский оборот для дальнейшей реализации.
В отличие от идентификации, целью которой является подтверждение подлинности действующего вещества в препарате, аутентификация методом БИК-спектрометрии нацелена на создание спектрального образа препарата (БИК-спектральная модель), в котором участвуют как действующие, так и вспомогательные вещества. Поэтому важным этапом аутентификации лекарственных средств БИК-анализом является построение БИК-спектральной модели препарата, которая бы позволила отличить его от «чужих образцов», а также выявить изменения, произошедшие с ними либо в процессе производства, либо хранения.
Цель работы
Целью настоящей работы является разработка математической модели для аутентификации капсулированного лекарственного препарата неразрушающим экспресс-методом БИК-спектрометрии и хемометрическими методами анализа для своевременного выявления на рынке некачественных и фальсифицированных образцов препарата.
Объекты и методы исследования
В качестве объекта исследования были выбраны капсулы препарата «Рибавирин» дозировкой 200 мг производителя Пс. Предоставленные производителем образцы были упакованы в контурную ячейковую упаковку из поливинилхлорида (ПВХ) и алюминиевой фольги (первичная упаковка) и картонную пачку (вторичная упаковка).
Препарат «Рибавирин» широко используется в качестве противовирусного средства в основном для лечения гепатита С и вирусных геморрагических лихорадок, часто назначается для лечения орфанных заболеваний.
Спектры в ближней ИК области (БИК-спектры) были получены на ИК Фурье спектрометре MPA фирмы «Брукер» (Германия) с помощью оптоволоконного датчика методом диффузного отражения. Разрешение – 8 см-1, количество сканов – 16, область измерения – от 12 000 см-1 до 4000 см-1, фазовое разрешение – 32, интерполяция – 2, базовая линия – по эталону из тефлона.
Построение и валидацию модели осуществляли с помощью подпрограммы «Ident» из программы «Opus 8.5» фирмы «Брукер» (Германия).
Учитывая, что работа была выполнена на разных единицах указанного прибора, для исключения различия в шкале волновых чисел используемых приборов все БИК-спектры были совмещены с условно стандартным спектром.
В качестве математического метода построения модели был выбран метод одноклассовой классификации, основной задачей которого является формирование целевого класса в соответствии со свойствами исследуемой группы объектов [1–2].
В соответствии с требованиями ОФС.1.2.1.1.0001.15 «Спектрометрия в ближней инфракрасной области»1 модель, построенную методом одноклассовой классификации, валидировали на чувствительность (степень принятия образцов целевого класса) и специфичность (степень отклонения «чужих образцов», т.е. не принадлежащих к целевому классу).
Чувствительность модели оценивали в два этапа: с помощью спектров, используемых для построения модели (внутренняя чувствительность), и спектров, полученных с дополнительных образцов того же препарата, но неиспользованных в построении модели (внешняя чувствительность).
Оценку модели на специфичность провели на спектрах поверочных образцов, в качестве которых были использованы выпущенные в гражданский оборот образцы капсул «Рибавирин» с той же дозировкой и в такой же упаковке, как исследуемый образец, но других производителей (табл. 1, рис. 1). В работе также были использованы спектры образцов препарата производителя Пк нового состава (Пк-н) и предыдущего (Пк-с).
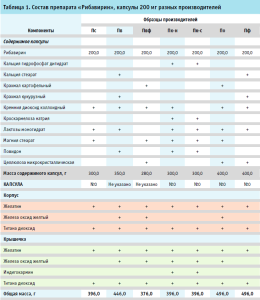
Из каждой серии предоставленных производителями образцов исследуемого препарата методом случайной выборки были отобраны по 12 капсул: 10 – для построения модели и валидации на внутреннюю чувствительность, 2 – для ее валидации на внешнюю чувствительность. Для каждой капсулы были получены по 3 БИК-спектра с плотным прижатием датчика к капсуле на уровне ее корпуса через прозрачную часть первичной упаковки.
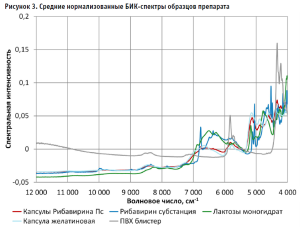
Дополнительно были получены спектры капсул с содержимым без упаковки, самой капсулы и упаковки (рис. 3). Для этого из набора для построения модели из каждой серии были выбраны по 2 капсулы, удалены из упаковки и получены по 3 спектра на уровне корпуса капсулы.
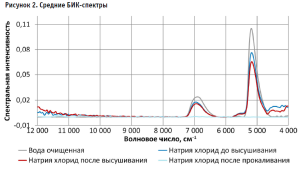
БИК-спектры пустых капсул (заполненных воздухом) получались нестабильными. Для устранения этого эффекта был подобран спектрально инертный наполнитель – субстанция натрия хлорид с массовой долей действующего вещества не менее 99,9 %. Однако в БИК-спектре указанной субстанции были обнаружены две широкие полосы, совпадающие с полосами воды (рис. 1). Для удаления абсорбционной воды образец натрия хлорида высушили при 105 °С в течение 1 часа: полосы в спектре не исчезли (рис. 1). Только прокаливанием субстанции при 650 °С в течение 1 часа удалось избавиться от указанных полос в спектре (рис. 1). Это свидетельствует о том, что в субстанции натрия хлорида присутствовала кристаллизационная вода.
Спектры пленки из поливинилхлорида (ПВХ), входящей в состав блистера, были получены в трех повторах для каждой упаковки из каждой серии препарата путем плотного прижатия датчика к поверхности полимерной части упаковки между ячейками.
Необходимые для анализа спектра испытуемого препарата БИК-спектры входящих в него действующего и вспомогательных веществ (рибавирин производства ЗАО «Активный компонент»; лактозы моногидрат производства компании «DFE Pharma», Нидерланды; магния стеарата фирмы «Tablube Nitica», Индия; кремния диоксида коллоидальный компании «Evonik Industries AG», Германия) были также получены в трех повторах путем прямого измерения субстанций во флаконах.
Ключевой позицией в моделировании является построение и валидация математической модели, максимально адекватной составу образцов лекарственного препарата, учитывающей особенности технологии производства и отличающей «чужие образцы». Для решения поставленной цели, с учетом имеющегося оборудования и программного обеспечения, оптимальными являются классификационные методы математического моделирования и одноклассовые по способу их построения [1–2].
Для построения одноклассовой модели в программе OPUS предложены два метода вычисления: расстояние Евклида (стандартный метод) и коэффициент корреляции Пирсона. В качестве предобработки спектров предусмотрены векторная нормализация, первая или вторая производные с шириной окна от 5 до 25 точек или сочетание производных с векторной нормализацией.
В том и другом случае пороговое значение модели (DT) представляет собой сумму максимального расстояния (Dmax) между средним спектром и спектрами образцов, используемых для построения модели (ядро модели), и произведение стандартного отклонения (S0) и коэффициента (Кх):
DT = Dmax + КхS0.
По умолчанию коэффициент Кх имеет значение 0,25, но его можно изменить от 0 до 1, передвигая таким образом границу модели с целью ее оптимизации.
Специфика коэффициента корреляции Пирсона, в отличие от расстояния Евклида, состоит в том, что в процессе вычисления параметров модели одновременно выполняется нормализация спектров, поэтому при его использовании в качестве метода вычисления модели дополнительная предобработка спектров в виде векторной нормализации не проводится.
Существенным фактором для построения модели является выбор рабочего диапазона, который на первом этапе проводится визуально путем анализа и выявления тех областей спектра, в которых проявляются полосы действующего и вспомогательных веществ.
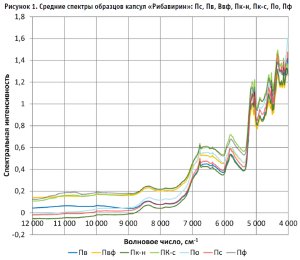
Визуальный анализ среднего БИК-спектра образца препарата показал, что в нем превалируют полосы желатина (рис. 1), поскольку его содержание в препарате составляет около 30 % и он локализован в верхнем слое препарата.
Действующее вещество (рибавирин) проявляется малоинтенсивными полосами при волновых числах 6766, 6369, 5052, 4731, 4612, 4528 и 4482 см-1. Лактоза, которая является основным наполнителем в содержимом капсулы (32 %), проявляется в виде широкой полосы в области волновых чисел 6600–6488 см-1, плеча в области 5183–5142 см-1 и в виде полосы при волновом числе 4015 см-1 (рис. 1). Кремния диоксид не имеет характерных полос в БИК-спектре, а полос магния стеарата при содержании его в препарате в количестве менее 1% практически не видно. ПВХ блистера проявляется в виде трех интенсивных полос при волновых числах 5828, 4330, 4215 см-1, малоинтенсивной полосы 5732 см-1 и плеча 5702 см-1.
С точки зрения расположения полос компонентов препарата область от 12 000 см-1 до 9000 см-1 является малоинформативной, в ней часто проявляются спектральные шумы, поэтому она могла бы быть удалена из исследования. Но известно, что математические методы могут извлекать из спектра невидимую глазом информацию.
В области 4150–4000 см-1 проявляются искажения спектров за счет нестабильной работы оптоволоконного датчика [1], а в областях от 5500–6000 см-1 и от 4400– 4050 см-1 оказывает влияние материал упаковки.
Присутствующая в образцах вода часто приводит к ухудшению разделяющих способностей моделей за счет увеличения максимального расстояния между спектрами и стандартного отклонения, поэтому область основного пика воды (5300– 4950 см-1) желательно было бы удалить. Однако в данном случае это является нецелесообразным, так как в этой области присутствуют полосы действующего и вспомогательных веществ препарата.
Таким образом, для построения моделей были выбраны четыре рабочих спектральных диапазона:
1) 12 000–4400 см-1;
2) 9000–4400 см-1;
3) 12 000–6000+5500–4400 см-1;
4) 9000–6000+5500–4400 см-1.
Перед построением моделей необходимо было убедиться в том, что испытуемые образцы принадлежат к одной выборке и в них отсутствуют грубые выбросы. Для этой цели была использована перекрестная валидация, суть которой состоит в исключении спектров образцов одной серии из модели, построении новой модели на спектрах образцов оставшихся серий и в оценке степени приятия этой моделью исключенных образцов. Исследование однородности выборки проводили в наиболее широком рабочем диапазоне (12 000–4400 см-1), в качестве предобработки спектров использовали векторную нормализацию, для построения модели – стандартный метод вычисления расстояния Евклида: все спектры были приняты моделями, что свидетельствует об однородности выборки.
Для выбора оптимальных условий построения БИК-спектральной модели были проанализированы следующие сочетания способов вычисления модели и предобработки спектров:
1) расстояние Евклида, без предобработки (РЕ бп);
2) расстояние Евклида, векторная нормализация (РЕ вн);
3) расстояние Евклида, первая производная со скользящим окном длиной 5 точек сглаживания (РЕ 1пр5);
4) расстояние Евклида, первая производная со скользящим окном длиной 25 точек сглаживания (РЕ 1пр25);
5) расстояние Евклида, вторая производная со скользящим окном длиной 5 точек сглаживания (РЕ 1пр5);
6) расстояние Евклида, вторая производная со скользящим окном длиной 25 точек сглаживания (РЕ 1пр25);
7) расстояние Евклида, первая производная со скользящим окном длиной 5 точек сглаживания плюс векторная нормализация (РЕ 1пр5+вн);
8) расстояние Евклида, первая производная со скользящим окном длиной 25 точек сглаживания плюс векторная нормализация (РЕ 1пр25+вн);
9) расстояние Евклида, вторая производная со скользящим окном длиной 5 точек сглаживания плюс векторная нормализация (РЕ 1пр5+вн);
10) расстояние Евклида, вторая производная со скользящим окном длиной 25 точек сглаживания плюс векторная нормализация (РЕ 1пр25+вн);
11) коэффициент корреляции Пирсона, без предобработки (КК бп);
12) коэффициент корреляции Пирсона, первая производная со скользящим окном длиной 5 точек сглаживания (КК 1пр5);
13) коэффициент корреляции Пирсона, первая производная со скользящим окном длиной 25 точек сглаживания (КК 1пр25);
14) коэффициент корреляции Пирсона, вторая производная со скользящим окном длиной 5 точек сглаживания (КК 2пр5);
15) коэффициент корреляции Пирсона, вторая производная со скользящим окном длиной 25 точек сглаживания (КК 2пр25).
В основе сравнения испытуемого образца и модели лежит стандартный метод вычисления спектрального расстояния (D) между полученным спектром со средним спектром модели путем вычисления евклидового расстояния по всем точкам спектрального диапазона модели [1].
В случае аутентичности исследуемого образца его спектральное расстояние (D) не должно превышать порогового значения модели (DT).
Валидация построенных моделей на внутреннюю и внешнюю чувствительность показала, что модели полностью принимают спектры своих образцов (табл. 2).
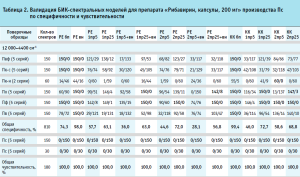
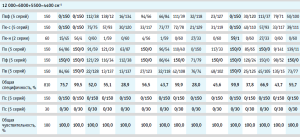
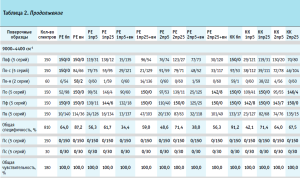
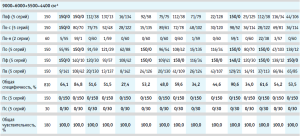
Результаты валидации модели на специфичность представлены в таблице 2, где для каждого производителя указано количество спектров, отвергнутых моделью и принятых ею.
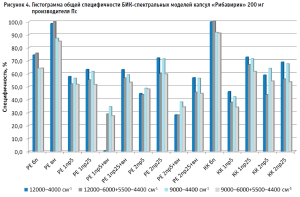
Вычисление общей специфичности модели проводили путем суммирования отвергнутых моделью спектров по всем проверочным образцам, делением полученной суммы на общее количество спектров и умножением на 100 для перевода полученного результата в процентное соотношение (табл. 2, рис. 4). Аналогичным образом была вычислена общая чувствительность модели по принятию своих образцов, которая во всех случаях была равна 100,0 % (табл. 2).
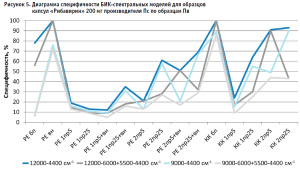
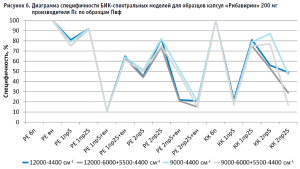
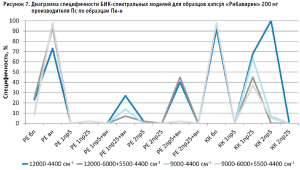
Для определения степени влияния образцов препарата каждого производителя на общую специфичность были построены диаграммы специфичности модели по производителям (рис. 5–10). С целью исключения влияния количества используемых в анализе спектров на специфичность (табл. 2) было вычислено процентное отношение выбросов к количеству используемых по каждому производителю спектров.
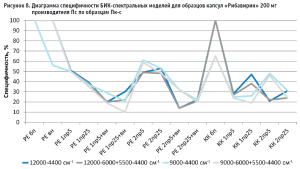
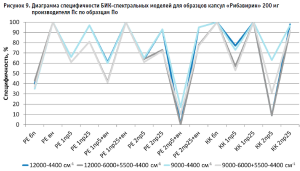
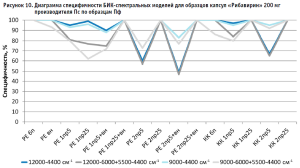
Из гистограммы общей специфичности (рис. 4) видно, что наилучшие результаты достигнуты при использовании рабочего диапазона измерения 12 000–6000+5500–4400 см-1, вычисление модели с помощью коэффициента корреляции Пирсона без предобработки: общая специфичность модели составила 99,9%.
Немного хуже был получен результат при вычислении модели с помощью расстояния Евклида с предварительной предобработкой спектров методом векторной нормализации: 99,5%.
Аналогичные результаты по оптимальным условиям видны на диаграммах специфичности моделей по производителям (рис. 5–10).
Увеличение специфичности модели за счет уменьшения ее порогового значения DT с помощью коэффициента Кх оказалось нецелесообразным, так как величина их качества совпадений была меньше максимального расстояния между спектрами Dmax, т.е., по сути, выбросы расположились в ядре модели.
Анализ гистрограммы общей специфичности моделей выявил следующие закономерности:
- модели, построенные методом расстояния Евклида и с использованием векторной нормализации в качестве предобработки спектров, имеют более высокую специфичность, чем модели без предобработки;
- используемые в качестве предобработки производные нивелируют различия между спектрами и, как следствие, уменьшают специфичность модели при обоих способах ее построения;
- увеличение в производных длины скользящего окна с 5 точек сглаживания до 25 увеличивает специфичность;
- сочетание производных и векторной нормализации уменьшает специфичность модели при обоих способах ее построения;
- широкий рабочий диапазон показывает лучшие результаты по специфичности модели, чем тот диапазон, в котором сосредоточены все полосы компонентов препарата, за исключением использования при предобработке спектров второй производной с длиной скользящего окна 5 точек;
- удаление области расположения полосы ПВХ блистера из рабочего диапазона измерения приводит к увеличению специфичности модели только в случае ее построения без предобработки спектров или с использованием векторной нормализации; при использовании предобработки спектров с помощью производных специфичность модели снижается.
Диаграммы специфичности моделей по производителям (рис. 5–10) показали, что наиболее близким по спектру к анализируемому образцу препарата является образец препарата Пк-н, спектры которого часто полностью принимаются моделью (рис. 7). Образцы препарата По и Пф в большинстве случаев не принимаются моделями, т.е. имеют значительные спектральные отличия от образцов препарата Пс, на которых были построены модели (рис. 9 и 10).
Анализ диаграмм специфичности моделей по производителям показал следующее:
- применение векторной нормализации в качестве предобработки спектров чаще приводит к увеличению специфичности модели, но может не повлиять или даже уменьшить ее, как это видно на рисунках 6, 8 и 9;
- сочетание производных и векторной нормализации в большинстве случаев уменьшает специфичность модели или оставляет ее без изменения; в некоторых случаях видна зависимость этого сочетания от рабочего диапазона измерения (рис. 8–10);
- использование производных для предобработки спектров приводит как к увеличению специфичности модели (рис. 5), так и к ее уменьшению (рис. 7 и 9);
- для образца Пк-с изменение специфичности моделей при использовании производных зависит еще от диапазона измерения (рис. 8);
- увеличение длины скользящего окна с 5 до 25 точек сглаживания при использовании производных в качестве предобработки спектров в большинстве случаев увеличивает специфичность, особенно эта закономерность четко прослеживается при вычислении модели коэффициентом корреляции Пирсона; изменение специфичности в ряде случаев зависит от рабочего диапазона измерения (рис.8);
- замена метода вычисления модели с расстояния Евклида на коэффициент корреляции Пирсона приводит как к увеличению специфичности модели, так и к ее снижению, в большинстве случаев это зависит от диапазона измерения и состава поверочного образца (рис. 5–10);
- наиболее индифферентным к диапазону измерения является образец препарата Пвф, на его диаграмме специфичности расхождения между диапазонами измерения наблюдаются только при применении второй производной в качестве предобработки спектров (рис. 6). В случае использования других образцов выбор оптимального диапазона измерения неоднозначен. Например, модель, построенная вычислением коэффициента корреляции Пирсона без предобработки в широких диапазонах измерения, отвергает спектры образцов препарата Пк-с, а в узких – принимает их. И наоборот, модель, построенная вычислением расстояния Евклида с использованием второй производной с длиной скользящего окна с пятью точками сглаживания в качестве предобработки, отвергает те же образцы в узком диапазоне измерения и принимает в широком (рис. 8). Такая же противоречивая картина наблюдается с использованием диапазонов измерения с удалением области полосы ПВХ упаковки и без нее (рис. 8–10).
В результате проведенного исследования общих для всех случаев закономерностей, однозначно увеличивающих специфичность модели, не выявлено. Это свидетельствует о том, что все факторы, а именно: рабочий диапазон, способ предобработки спектров, метод построения модели и спектральная характеристика образца, являются значимыми в этом процессе, и в разных сочетаниях могут проявляться с разной силой.
Заключение
На примере капсул «Рибавирин» показана процедура построения и валидации модели для аутентификации лекарственных препаратов в капсулированной форме методом БИК-спектрометрии в сочетании с хемометрическими методами анализа. Валидация моделей позволила определить оптимальные условия построения для образцов препарата «Рибавирин», капсулы, 200 мг производства Пс: рабочий диапазон измерения 12 000–6000+5500–4400 см-1, вычисление модели с помощью коэффициента корреляции Пирсона без предобработки. Чувствительность модели – 100,0%, общая специфичность –99,9%. Анализ гистрограммы общей специфичности моделей и диаграмм специфичностей моделей по производителям показал, что все факторы (рабочий диапазон, способ предобработки спектров, метод построения модели и спектральная характеристика образца) являются значимыми в этом процессе, и в разных сочетаниях могут проявляться с разной силой. Это является причиной возникновения разнообразных, часто противоположных результатов. В этих условиях поиск оптимальных условий построения аутентичной модели может быть осуществлен путем исследования всех возможных вариантов, как это описано в статье.
___________________________________________________________________
1 Статья Государственной фармакопеи Российской Федерации XIV издания.
- Титова А.В. Разработка и валидация методики аутентификации таблеток дезлоратадина методом ИК-спектрометрии в ближней области / А.В. Титова, О.Е. Родионова, Ф.Ю. Годин, К.С. Балыклова // Вестник Росздравнадзора. – 2022. – №4. – С.74–80.
- Rodionova, O.Ye. Qualitative and quantitative analysis of counterfeit fluconazole capsules: A non-invasive approach using NIR spectroscopy and chemometrics [Electronic Resource] / O.Y. Rodionova, A.V. Titova, N.A. Demkin, K.S. Balyklova, A.L. Pomerantsev // Talanta. – 2019; 195: 662–667. DOI: 10.1016/j.talanta.2018.11.088. – Access mode: https://pubmed.ncbi.nlm.nih.gov/30625598/ (date of request: 10.08.2023).
- Naughton B. Effectiveness of medicines authentication technology to detect counterfeit, recalled and expired medicines: a two-stage quantitative secondary care study [Electronic Resource] / B. Naughton, L. Roberts, S. Dopson, S. Chapman, D. Brindley // BMJ Open. – 2016; 6(12): e013837. DOI: 10.1136/bmjopen-2016-013837. – Access mode: https://pubmed.ncbi.nlm.nih.gov/27940634/ (date of request: 10.08.2023).
- Assi S. Authentication of Antibiotics Using Portable Near- Infrared Spectroscopy and Multivariate Data Analysis [Electronic Resource] / S. Assi, B. Arafat, Kathryn Lawson-Wood, I. Robertson // Applied Spectroscopy. – 2021; 75(4): 434– 444. DOI: 10.1177/0003702820958081. – Access mode: https://www.researchgate.net/publication/343845424_EXPRESS_Authentication_of_Antibiotics_Using_ Portable_Near-Infrared_Spectroscopy_and_Multivariate_Data_Analysis (date of request: 10.08.2023).
- Chen H., Lin Z., Tan C. Application of near-infrared spectroscopy and class-modeling to antibiotic authentication / H. Chen, Z. Lin, C. Tan // Analytical Biochemistry. – 2020; 590:113514. DOI: 10.1016/j.ab.2019.113514. (date of request: 10.08.2023).
- Chen H. Express detection of expired drugs based on nearinfrared spectroscopy and chemometrics: A feasibility study [Electronic Resource] / H. Chen, C. Tan, Z. Lin // Spectrochimica acta. Part A: Molecular and biomolecular spectroscopy. – 2019; 220: 117153. DOI: 10.1016/j.saa.2019.117153. – Access mode: https://pubmed.ncbi.nlm.nih.gov/31141774/ (date of request: 10.08.2023).
- Hattori Y. Rapid identification of oral solid dosage forms of counterfeit pharmaceuticals by discrimination using nearinfrared spectroscopy [Electronic Resource] / Y. Hattori, Y. Seko, J. Peerapattana, K. Otsuka, T. Sakamoto, M. Otsuka // Bio-Medical Materials and Engineering. – 2018; 29(1): 1–14. DOI: 10.3233/ BME-171708. – Access mode: https://pubmed.ncbi.nlm.nih. gov/29254069/ (date of request: 10.08.2023).
