РЕГИСТРАЦИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Промежуточные результаты регистрации серии (партии) медицинских изделий для диагностики in vitro в 2020–2021 году
1 — ФГБУ «Национальный институт качества» Росздравнадзора, Российская Федерация, 109074, г. Москва, Славянская пл., 4, стр. 1.
ORCID: https://orcid.org/0000-0003-4656-1025
2 — ФГБУ «Национальный институт качества» Росздравнадзора, Российская Федерация, 109074, г. Москва, Славянская пл., 4, стр. 1.
ORCID: https://orcid.org/0000-0003-0971-853X
В связи с пандемией новой коронавирусной инфекции COVID-19 разработано и утверждено Постановление Правительства РФ от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинского изделия», которое регламентирует обращение медицинских изделий, предназначенных также для применения в условиях профилактики и лечения заболеваний, представляющих опасность для окружающих. В данной статье представлен анализ медицинских изделий для in vitro-диагностики для обнаружения коронавируса SARS-CoV-2 в период пандемии заболевания COVID-19, зарегистрированных в соответствии с Постановлением Правительства РФ от 03.04.2020 № 430, а также рассмотрены подходы к оптимизации скрининга клинических образцов.
Ключевые слова: COVID-19, SARS-CoV-2, диагностическое тестирование, ОТ-ПЦР, антигены, иммуноанализ
Впервые о новой коронавирусной инфекции было сообщено, когда 31 декабря 2019 в г. Ухане (Китайская Народная Республика), произошла вспышка неизвестного респираторного заболевания, которое быстро распространилось по Юго-Восточной Азии, Европе и Северной Америке [1]. Впоследствии заболевание, вызванное коронавирусом SARS-CoV-2, получило название COVID-19, а 11 марта 2020 г. Всемирная организация здравоохранения (ВОЗ) официально объявила его пандемией [2]. По состоянию на 16 июня 2021 г. во всем мире зарегистрировано более 177 млн подтвержденных случаев COVID-19, в т.ч. более 5,4 млн случаев – в России1.
Одной из основных проблем при оценке и мониторинге пандемии является наличие достаточного количества медицинских изделий (МИ) для диагностики COVID-19 [3].
По мере увеличения числа пациентов с симптомами COVID-19 возникает потребность в таких изделиях, как средства для взятия мазков, среды для транспортировки, наборы для выделения РНК, наборы реагентов для полимеразной цепной реакции (ПЦР). Недавнее исследование показало, что по меньшей мере 35% инфицированных людей не имеют симптомов заболевания [4], что свидетельствует о высоком риске быстрого распространения инфекции и о необходимости широкого тестирования.
В связи с быстрым распространением COVID-19 Правительство РФ утвердило Постановление об особенностях обращения медицинских изделий для диагностики коронавирусной инфекции2 (далее – Постановление Правительства РФ № 430). Оно регламентирует обращение медицинских изделий, которые предназначены в том числе для применения в условиях профилактики и лечения заболеваний, представляющих опасность для окружающих, по Перечню согласно приложению к Постановлению Правительства РФ № 430, в том числе государственной регистрации серии (партии) медицинского изделия. Важно отметить, что тесты, зарегистрированные в соответствии с новыми требованиями, действуют только в период пандемии.
В данном Постановлении указано, что для государственной регистрации медицинских изделий представляется техническая документация производителя (изготовителя) на медицинское изделие (при наличии), а также документы, подтверждающие результаты технических испытаний медицинского изделия, токсикологических исследований медицинского изделия, использование которого предполагает наличие контакта с организмом человека, клинических испытаний медицинского изделия, проведенных в соответствии с типовой программой испытаний в зависимости от вида медицинского изделия, разработанной экспертным учреждением (далее – типовая программа). Причем требования, установленные Министерством здравоохранения Российской Федерации, о проведении оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий не являются обязательными для испытаний (исследований) медицинских изделий, включенных в Перечень медицинских изделий, приведенный в приложении к Постановлению Правительства РФ № 430.
Особенностью регистрации медицинских изделий для диагностики in vitro в рамках Постановления Правительства РФ № 430 является то, что результаты технических испытаний изделий не предоставляются, а клинико-лабораторные испытания проходят по типовым программам.
К медицинским изделиям для диагностики in vitro, которые в основном регистрируются в рамках данного Постановления, относятся:
диагностические тесты: тесты, которые обнаруживают компоненты вируса SARS-CoV-2 и могут использоваться для диагностики заражения вирусом SARS-CoV-2. К ним относятся молекулярные тесты и тесты на антигены.
серологические тесты, которые выявляют антитела (например, IgM, IgG) к вирусу SARS-CoV-2. Эти типы тестов не могут использоваться для диагностики текущей инфекции.
Цель работы
Цель данной статьи – оценить, насколько Постановление Правительства РФ № 430 ускорило государственную регистрацию медицинских изделий для in vitro-диагностики для обнаружения SARS-CoV-2 в период пандемии заболевания COVID-19, а также целесообразность оптимизации скрининга образцов.
Динамика государственной регистрации МИ для диагностики COVID-19 в рамках государственной регистрации серии (партии) медицинского изделия
Для оценки динамики регистрации МИ для диагностики COVID-19 нами были проанализированы регистрационные удостоверения, выданные в рамках процедуры, установленной Постановлением Правительства РФ № 430 с использованием Государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий3. По состоянию на 16 июня 2021 в рамках Постановления было выдано 433 регистрационных удостоверения (РУ) на изделия, которые предназначены для лабораторной диагностики COVID-19. После исключения регистрационных удостоверений, выданных на контрольные материалы и калибраторы, количество регистрационных удостоверений составило 288. Результаты оценки динамики регистрации медицинских изделий для диагностики COVID-19 в соответствии с Постановлением Правительства РФ № 430 представлены на рисунке 1.
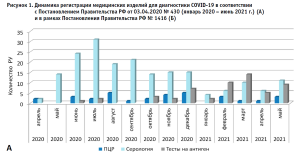
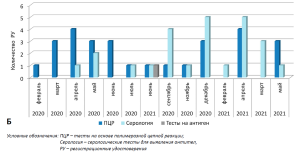
Для сравнения представлена динамика регистрации изделий для диагностики COVID-19 в рамках Постановления Правительства РФ от 27.12. 2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий»4 (далее – Постановление Правительства РФ № 1416).
Как видно из представленных данных, количество изделий, зарегистрированных в рамках Постановления Правительства РФ № 430, превышает количество изделий, зарегистрированных по процедуре, установленной Постановлением Правительства РФ № 1416, в несколько раз. Следует отметить, что в рамках Постановления Правительства РФ № 430 государственной регистрации подлежат серии (партии) медицинского изделия, и таким образом столь значительная разница может быть обусловлена тем, что одно и тоже изделие, но разные партии, регистрируется несколько раз. Однако, после исключения повторных регистраций разных серий одного и того же изделия, было выявлено 213 изделий, которые регистрировались хотя бы один раз. Полученное количество РУ уникальных медицинских изделий существенно превышает количество РУ, выданных по Постановлению Правительства РФ № 1416 (213 против 54). С этой точки зрения можно заключить, что Постановление Правительства РФ № 430 существенно ускорило государственную регистрацию медицинских изделий для in vitro-диагностики для обнаружения SARS-CoV-2 в период пандемии заболевания COVID-19.
Анализ изделий, зарегистрированных в соответствии с Постановлением Правительства РФ № 430
Среди изделий, зарегистрированных по Постановлению Правительства РФ № 430, основную часть составляют изделия для выявления иммунного ответа человека на SARS-CoV-2 – 69%, доля ПЦР тестов составляет 11%, доля тестов для выявления антигенов – 20%. Для изделий, зарегистрированных по Постановлению Правительства РФ № 1416, доля серологических тестов составляет 46%, доля ПЦР тестов – 52%, а доля тестов для выявления антигенов – менее 2%.
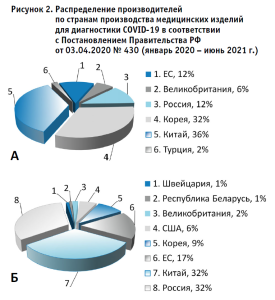
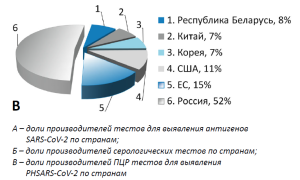
На рисунке 2 представлено распределение производителей по странам производства изделий. Как видно из представленных данных, основную долю производителей тестов для выявления антигенов, зарегистрированных в соответствии с Постановлением Правительства РФ № 430, составляет Китай (36%) и Корея (32%); среди производителей серологических тестов лидирующее положение занимает Россия (32%) и Китай (32%); среди производителей ПЦР-тестов основная доля принадлежит российским производителям (52%).
Интересно отметить, что Постановление Правительства РФ № 430 дало возможность внедрить свои научные разработки в лабораторную практику научным институтам России, таким как:
- ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН5;
- ФГБУН Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора6;
- Центр стратегического планирования и управления ФМБА России7.
В рамках Постановления Правительства РФ № 430 был зарегистрирован ряд уникальных изделий, предназначенных, например, для иммуноферментного выявления антител класса А (IgA) к вирусу SARS-CoV-2 (например, РУ № РЗН 2020/10722 от 04.06.2020, РУ № РЗН 2020/10307 от 12.05.2020), для количественного определения специфических антител к вирусу SARS-CoV-2 иммунохемилюминесцентным методом в сыворотке крови человека или плазме (например, РУ № РЗН 2020/11708 от 13.08.2020), которые могут быть использованы для оценки напряженности иммунитета в динамике и позволяют проводить отбор потенциальных доноров иммунокомпетентной плазмы. В рамках Постановления Правительства РФ № 430 зарегистрировано несколько ПЦРтест-систем, одной из которых является автоматизированный тест Cepheid Xpert Xpress SARS-CoV-2, который позволяет проводить анализ образца от выделения РНК из биообразца до получения результата в автоматическом режиме. Тест может обеспечить быстрое обнаружение текущего коронавируса SARS-CoV-2 уже через 30 минут, при этом для подготовки образца требуется менее одной минуты.
Кроме того, в соответствии с Постановлением Правительства РФ № 430 зарегистрированы изделия для выявления РНК коронавируса различных штаммов SARS-CoV-2, таких как В.1.1.7 и В.1.351/Р.1 путем выявления характерных для данных линий мутаций в образцах РНК, экстрагированной из биологического материала (мазки со слизистой носои ротоглотки), в которых обнаружена РНК SARS-CoV-2 методом анализа нуклеиновых кислот (РЗН 2021/14054 от 14.04.2021, РЗН 2021/13603 от 20.02.2021).
Изделия для оценки напряженности иммунитета
Серологические исследования для определения антител к SARS-CoV-2 могут помочь в выявлении ранее инфицированных лиц и в оценке количества лиц, контактировавших с возбудителем в популяции. Иммунный ответ организма на инфицирование SARS-CoV-2 включает выработку антител, специфичных к антигенам вируса. Понимание динамики образования антител к вирусу является ключевым для определения временного окна для серологических тестов. Уже через 5 дней после появления первых симптомов в крови могут определяться как иммуноглобулины М (IgM), так и иммуноглобулины G (IgG). Максимальные уровни IgM наблюдаются через 2–3 недели, IgG – через 3–6 недель. Обычно основным классом антител, которые появляются в крови на ранних стадиях первичного гуморального ответа, являются IgМ, однако при инфицировании SARS-CoV-2 уровни и хронологическая последовательность появления антител IgM и IgG, вероятно, значительно варьируется.
Хотя корреляцию между иммунным ответом и степенью защиты от SARS-CoV-2 еще предстоит определить, предполагается, что одной из важнейших функций антител является нейтрализация вируса. При инфицировании SARS-CoV-2 антитела к шиповидному и нуклеокапсидному белкам вируса образуются, начиная с 9-го дня, и оказывают сильное нейтрализующее действие, что свидетельствует о том, что сероконверсия может обеспечивать защиту по меньшей мере в течение ограниченного времени. Тем не менее, для определения способности нейтрализующих антител обеспечивать длительный иммунитет к SARS-CoV-2 необходимы дополнительные исследования.
Количественные тесты позволяют определять количество специфических антител, а не только их наличие. Данный подход позволяет оценить напряженность иммунитета против COVID-19, который сформировался после перенесенного заболевания или после вакцинации. К количественным тестам относятся изделия компаний «Эбботт Ирландия Диагностическое подразделение» (МИ «SARS-CoV-2 IgG II Quant Reagent Kit»), «ДиаСорин С.п.А.» (МИ «LIAISON SARS-CoV-2 S1/S2 IgG»,), «Рош Диагностикс ГмбХ» (МИ «Elecsys Anti-SARS-CoV-2 cobas e analyzers/ACOV2S»), ФБУН НИИ эпидемиологии и микробиологии имени Пастера (МИ «N-CoV-2-IgG PS»), АО «Вектор-Бест» (МИ «SARS-CoV-2-IgG количественный-ИФА-БЕСТ»), «ЕВРОИММУН Медицинише Лабордиагностика АГ» (МИ «Anti-SARS-CoV-2 QuantiVac ELISA (IgG)), «Шэньчжэнь Майндрэй Био-Медикал Электроникс Ко., Лтд.» (РУ № РЗН 2020/12887). Следует отметить, что все зарегистрированные количественные тесты, за исключением теста компании «Рош Диагностикс ГмбХ» (РЗН 2021/14302 от 13.05.2021), предназначены для определения антител класса IgG к коронавирусу SARS-CoV-2.
Большинство количественных тестов измеряют аналит в условных единицах. Набор реагентов «SARS-CoV-2-IgG количественный-ИФА-БЕСТ» компании АО «Вектор-Бест» измеряет количество антител в BAU – «binding antibody units» («единицы связывающих антител»), а контроли и калибраторы прослеживаются до международного стандарта WHO International Standard First WHO International Standard for anti-SARS-CoV-2 immunoglobulin (human), NIBSC code: 20/136.
Отмечаем, что подход с использованием международных стандартов является на сегодняшний день предпочтительным, что позволяет сравнить иммунные ответы после естественной инфекции и индуцированные различными вакцинами-кандидатами при использовании различных наборов реагентов. В настоящее время для наборов реагентов «LIAISON® SARS-CoV-2 TrimericS IgG» компании DiaSorin, «Elecsys® Anti-SARS-CoV-2 S» компании Roche Diagnostics Rus LLC, «SARS-CoV-2 IgG II Quant» компании Abbott, набора реагентов для выявления антител IgG к коронавирусу нового типа (SARS-CoV-2) S-RBD (методом иммунохемилюминесцентного анализа) компании Mindray и «Anti-SARS-CoV-2 QuantiVac ELISA (IgG))», компании ЕВРОИММУН Медицинише Лабордиагностика АГ, доступны коэффициенты пересчета условных единиц в международно-признанные – BAU/мл.
Для части зарегистрированных изделий показана их эффективность при оценке поствакцинального иммунитета, например, для изделия «SARS-CoV-2 IgG II Количественный Реагенты для ARCHITECT (SARS-CoV-2 II Quant Reagent Kit)» компании «Эбботт Ирландия, Диагностическое подразделение», изделия «ГAM-COVID-aнти-RBD» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, «SARS-CoV-2-IgG количественный-ИФА-БЕСТ» АО «Вектор-Бест» при тестировании образцов пациентов, вакцинированных «Гам-Ковид-Вак». Для последнего изделия также показана эффективность при оценке поствакцинального иммунитета пациентов, получивших вакцину «КовиВак».
Оптимизация тестирования образцов с помощью изделий, зарегистрированных по Постановлению Правительства РФ № 430
Пандемия COVID-19 выявила важность надежных диагностических тестов для глобального общественного здравоохранения. В настоящее время актуальной является разработка тестов для скрининга бессимптомных лиц и для тестирования объединенных образцов. Объединение образцов (пулирование) включает смешивание нескольких образцов вместе, а затем тестирование объединенной выборки с помощью диагностического теста.
Существуют следующие подходы:
- объединение образцов/сред: объединение аликвот транспортных сред, каждая из которых содержит образец одного пациента;
- объединение мазков: добавление мазков от нескольких пациентов в единый объем транспортной среды. Такой подход увеличивает количество людей, которых можно протестировать с использованием того же количества ресурсов, но требует обоснованного протокола исследования для его реализации.
Например, в работе Mulu A. и соавт. [5] была проведена оценка метода объединения как на прямых клинических образцах, так и на образцах мазков. Использовали стандартный тест полимеразной цепной реакции с обратной транскриптазой (RT-PCR) SARS CoV-2, нацеленный на нуклеокапсид (N) и открытую рамку считывания (ORF1ab) геномной области вируса. Экспериментальные пулы были созданы с использованием клинических образцов, положительных по SARS CoV-2, и экстрагированной РНК с добавлением до 9 отрицательных образцов. Для прямых клинических образцов вирусная РНК экстрагировалась из каждого пула до конечного объема экстракции 200 мкл, а затем оба образца тестировались с использованием анализа ОТ-ПЦР. В ходе проведения работы было обнаружено, что один положительный образец может быть амплифицирован и обнаружен в пулах до 7 образцов в зависимости от значения порога цикла (Ct) исходного образца, соответствующего высоким и низким вирусным копиям SARS CoV-2 на реакцию. Однако, чтобы свести к минимуму ложноотрицательность анализа со стратегиями объединения и с неизвестной степенью ложноотрицательности теста при валидации, авторами было рекомендовано объединять 4–5 образцов в один с использованием стандартных протоколов анализа, реагентов и оборудования. Алгоритм прогнозирования показал, что соотношение объединения 5 к 1, как ожидалось, сохранит точность теста независимо от выбранных образцов значения Ct и приведет к увеличению эффективности тестирования на 137%. На основании полученных результатов, авторы рекомендуют объединение 4 или 5 клинических образцов в один. Однако не рекомендуется объединять клинические образцы, когда распространенность заболевания превышает 7%, особенно при большом размере выборки.
В другой работе Barak N. и соавт. [6] были представлены результаты анализа 133 816 образцов, собранных в период с апреля по сентябрь 2020 г. и протестированных Dorfman pooling на наличие SARS-CoV-2. Отмечается, что исследователи сэкономили 76% тестов на экстракцию РНК и ОТ-ПЦР, несмотря на часто меняющуюся распространенность коронавируса SARS-CoV-2 (от 0,5 до 6%).
В работе вьетнамских авторов [7] были исследованы образцы мазков из носоглотки и глотки у 96 123 бессимптомных лиц, подверженных риску заражения SARS-CoV-2, при сборе сгенерировали 22 290 пулов, каждый из которых содержал образцы от двух до семи человек. SARS-CoV-2 был обнаружен в 24 пулах, и инфекция была подтверждена у 32 человек после повторной выборки и тестирования 104 образцов из положительных пулов. Исследователем потребовалось 64 дня для завершения скрининга для того же количества людей, если бы стратегия тестирования основывалась на индивидуальном тестировании. Отмечается, что настоящая стратегия может быть применима в условиях нехватки реагентов и низкой распространенности болезни, но при этом высока потребность в тестировании.
Таким образом, объединение образцов требует взвешенного подхода и испытаний на большом количестве клинических образцов. Следует отметить, что при объединении происходит разбавление образцов, что может привести к меньшему количеству вирусного генетического материала, доступного для обнаружения, и таким образом, существует большая вероятность получения ложноотрицательных результатов, особенно если они не подтверждены должным образом. Таким образом, важно знать диапазоны концентраций коронавирусных частиц, которые рутинно выявляются в клинической лабораторной практике. С этой точки зрения представляется важным, что в рамках Постановления Правительства РФ № 430 была зарегистрирована единственная в мире ПЦР-тест-система (РЗН 2020/12597 от 31.12.2020) для количественного определения РНК SARS-CoV-2 в биологическом материале (мазки со слизистой оболочки носо- и ротоглотки, мокрота/ аспират из зева, бронхоальвеолярный лаваж / промывные воды бронхов, плазма крови, фекальный / ректальный мазок, аутопсийный материал) методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации. Материалом для проведения ОТ-ПЦР служат пробы РНК, экстрагированные из исследуемого материала. Диапазон измерения данной системы составляет 5 102 – 3 108 геномных эквивалентов (геномов) коронавируса в миллилитре.
Поскольку объединение выборок значительно увеличит количество людей, которых можно протестировать с использованием существующих ресурсов, небольшое снижение чувствительности может быть приемлемым в зависимости от эффективности объединения и других имеющихся мер. Например, FDA обычно рекомендует, чтобы после объединения результаты теста включали 85% процентного положительного согласия (PPA) по сравнению с тем же тестом, проведенным на отдельных образцах. Дополнительные ограничения, такие как рассмотрение отрицательных результатов объединенных образцов как предполагаемых отрицательных, могут быть рекомендованы на основе популяции пациентов, включенных в клиническую оценку спонсора, и данных о производительности. Отмечаем, что объединение образцов может быть разрешено для использования только для тестов, если были представлены результаты валидации (клинико-лабораторных испытаний) тестов, предназначенных для использования с объединенными образцами. Для реализации данного подхода необходимо разработать протоколы типовых испытаний по аналогии с протоколами Центра по контролю и профилактике заболеваний8 или Управления по санитарному надзору за качеством пищевых продуктов и медикаментов9.
В заключение следует отметить, что реализация Постановления Правительства РФ № 430 существенно ускорила государственную регистрацию медицинских изделий для in vitro-диагностики для обнаружения SARS-CoV-2 в период пандемии заболевания COVID-19, что позволило обеспечить наличие достаточного количества медицинских изделий для диагностики COVID-19 в стране.
_______________________________________________________________________
1 URL: https://стопкоронавирус.рф.
2 Постановление Правительства РФ от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинского изделия». URL: https://www.garant.ru/products/ipo/prime/doc/73749698/
3 URL: https://roszdravnadzor.gov.ru/services/misearch.
4 URL: https://base.garant.ru/70291692.
5 РЗН 2020/11010 от 23.06.2020, РЗН 2020/1153 от 31.07.2020, РЗН 2020/11529 от 31.07.2020.
6 РЗН 2020/12943 от 09.12.2020, РЗН 2021/13393 от 02.02.2021, РЗН 2020/10268 от 08.05.2020.
7 РЗН 2021/14054 от 14.04.2021.
8 URL: https://www.cdc.gov/coronavirus/2019-ncov/lab/pooling-procedures.html/
9 URL: https://www.fda.gov/medical-devices/coronavirus-covid-19-and-medical-devices/pooled-sample-testing-and-screening-testing-covid-19.
- Nelson P., Rath B., Fragkou P., Antalis E., Tsiodras S., Skevaki C. Current and future point-of-care tests for emerging and new respiratory Viruses and future perspectives. Front. Cell. and Infection Microbiol. 2020; 10.
- Bhalla N., Jolly P., Formisano N., Estrela P. Introduction to biosensors. Essays Biochem. 2016; 60 (1): 1–8.
- Wu K., Klein T., Krishna V., Su D., Perez A., Wang J. Portable GMR handheld platform for the detection of influenza A virus. ACS Sens. 2017; 2 (11): 1594–1601.
- Seo G., Lee G., Kim M., Baek S., Choi M., Ku K., Lee C., Jun S., Park D., Kim H., Kim S., Lee J., Kim B., Park E., Kim S. Rapid detection of COVID-19 causative virus (SARS-CoV-2) in human nasopharyngeal swab specimens using field-effect transistor-based biosensor. ACS Nano. 2020; 14 (4): 5135–5142.
- Mulu A., Alemayehu D.H., Alemu F., Tefera D.A., Wolde S., Aseffa G., Seyoum T., Habtamu M., Abdissa A., Bayih A.G., Beyene G.T. Evaluation of sample pooling for screening of SARS CoV-2. PLoS One. 2021 Feb 26; 16 (2): e0247767. doi: 10.1371/journal.pone.0247767.
- Barak N., Ben-Ami R., Sido T., Perri A., Shtoyer A., Rivkin M., Licht T., Peretz A., Magenheim J., Fogel I., Livneh A., Daitch Y., Oiknine-Djian E., Benedek G., Dor Y., Wolf D.G., Yassour M.; Hebrew University-Hadassah COVID-19 Diagnosis Team. Lessons from applied large-scale pooling of 133,816 SARS-CoV-2 RT-PCR tests. Sci Transl Med. 2021 Apr 14;13(589):eabf2823. doi: 10.1126/ scitranslmed.abf2823. Epub 2021 Feb 22.
- Thanh T.T., Nhan N.T.T., Mai H.K., Trieu N.B., Huy L.X., Thuy H.T.T., Chung L.T., Anh N.N., Hong N.T.T., Thang B.T., Thu N.T.H., Chi L.T.K., Hanh N.T., Hoang N.H., Chau N.V.V., Thwaites G., Hung D.T., Tan L.V., Yen N.T.K. The Application of Sample Pooling for Mass Screening of SARS-CoV-2 in an Outbreak of COVID-19 in Vietnam. Am J Trop Med Hyg. 2021 Jan 22;104(4):1531–4. doi: 10.4269/ajtmh.20-1583.
