КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Применение новой интраоперационной классификации при врастании плаценты
1 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
ORCID: https://orcid.org/0000-0002-8159-6373
2 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
ORCID: https://orcid.org/0000-0002-2206-1002
3 — ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России, 119049, Российская Федерация, Москва, Ленинский проспект, д. 8, корп. 7.
ORCID: https://orcid.org/0000-0001-6140-1930
4 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
5 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
6 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
ORCID: https://orcid.org/0000-0003-0025-3182
7 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
ORCID: https://orcid.org/0000-0001-8382-9671
8 — ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, 117997, Российская Федерация, Москва, ул. Академика Опарина, д. 4.
ORCID: https://orcid.org/0000-0002-4332-430X
Врастание плаценты – грозное осложнение беременности, провоцирующее массивные кровотечения, ранние и отсроченные осложнения, увеличивающее риски материнской смертности. Несмотря на это, успехи, достигнутые в решении данной проблемы, все больше позволяют уделять внимание органосохраняющим методикам, способствующим сохранению репродуктивной функции. Авторами статьи представлено исследование по выявлению корреляции инвазии плаценты с объемом кровопотери на основании новой интраоперационной классификации.
Ключевые слова: беременность, врастание плаценты, метропластика, органосохраняющие операции
Введение
Врастание плаценты – осложнение беременности, связанное с аномальным ее прикреплением, проявляется в неспособности отделения плаценты от стенки матки, что приводит к массивной кровопотере, перинатальным осложнениям, повышает риск материнской смертности. Увеличение распространенности данной акушерской патологии напрямую связано с увеличением частоты операций кесарева сечения [1, 2]. Так, в США в 50-е годы регистрировался один случай врастания на 10 тыс. родов, в 80-е годы – уже четыре случая, а во втором десятилетии 2000-х годов – 18,7 случаев [3]. Наряду с этим, частота случаев врастания плаценты варьирует от 1,7 до 900 на 100 тыс. родов (в среднем 189 на 100 тыс.), что связано с вариабельностью формулировки диагноза и его клинического подтверждения [4].
Для оценки глубины врастания плаценты наиболее часто используют классификацию FIGO (включающую клинические и морфологические критерии). Выделяют несколько степеней врастания плаценты:
I степень (placenta acсreta) – поверхностное прикрепление плаценты к мышечному слою матки;
II степень (placenta increta) – ворсины прорастают мышечный слой, без признаков распространения за пределы серозного слоя матки;
III степень (placenta percreta) – плацента прорастает все слои матки [5, 6].
Все патологические варианты прикрепления плаценты объединены в один термин – placenta accreta spectrum disorders (PAS) [7].
Основными методами, позволяющими диагностировать и планировать хирургическую тактику, являются методы визуальной диагностики – УЗИ и МРТ. Они помогают акушеру-гинекологу избежать массивной кровопотери за счет планирования этапов оперативного вмешательства с учетом всех рисков и подготовки к операции [8, 9].
С 2014 года в ФГБУ «НМИЦАГП им. В.И. Кулакова Минздрава России» прооперировано 520 пациенток с врастанием плаценты в рамках клинических апробаций и оказания высокотехнологичной медицинской помощи.
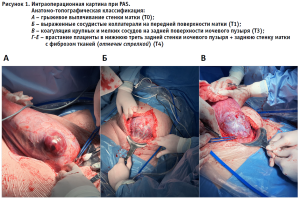
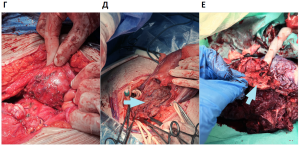
С 2020 года внедрена в практику и активно используется интраоперационная анатомо-топографическая классификация, предложенная Х. Палациусом:
тип 1 – плацента достигает серозной оболочки или выходит за ее пределы с наличием новообразованных сосудов между маткой, плацентой и мочевым пузырем (верхняя задняя часть мочевого пузыря);
тип 2 – плацента достигает серозной оболочки или выходит за ее пределы с инвазией плаценты в параметрий;
тип 3 – плацента прорастает в задненижнюю область мочевого пузыря;
тип 4 – плацента прорастает в задненижнюю область мочевого пузыря с добавлением интенсивного фиброза между мочевым пузырем и маткой [10].
Цель исследования
Выявление корреляции инвазии плаценты с объемом кровопотери на основании новой интраоперационной классификации.
Материалы и методы
Авторами проведен проспективный анализ данных 231 беременной в возрасте от 20 до 40 лет (35,1 ± 4,5) с диагнозом «врастание плаценты». Пациентки находились на обследовании и лечении в ФГБУ «НМИЦАГП им. В.И. Кулакова Минздрава России» в период с 1 января 2020 года по 1 октября 2022 года.
В ходе исследования анализировались следующие показатели:
- возраст матери;
- предшествующие операции на матке;
- особенности течения предыдущих беременностей;
- предшествующие операции кесарева сечения;
- объем кровопотери;
- экстирпация матки;
- перевязка внутренних подвздошных сосудов.
Пациентки были разделены на группы по объему кровопотери и на группы по анатомо-топографической классификации. Были определены типы инвазии плаценты: первая группа (Т1), n = 75; вторая группа (Т2), n = 13; третья группа (Т3), n = 22; четвертая группа (Т4), n = 34. Также была выделена дополнительная группа (Т0), n = 87, к которой отнесено врастание плаценты, не выходящее за пределы матки, без распространения на мочевой пузырь. Общий объем кровопотери в группе Т0 и Т1 был наименьшим и статистически значимым, составил 800 мл (700–1000 мл, р < 0,001), во 2 группе – 1500 мл (750–1500 мл, р < 0,001) и достоверно больше оказался в 3 и 4 группе: 2100 мл (1425–3375мл, р < 0,001) и 1750 мл (1200–3950, р < 0,001) соответственно. Типы инвазии коррелировали со специфическим кровоснабжением каждого из них.
Этап диагностики аномального прикрепления плаценты проводили при помощи УЗИ и МРТ. Всем пациенткам с подозрением на врастание плаценты проводилось оперативное лечение в объеме срединной лапаротомии/поперечно-надлобкового чревосечения, ультразвуковой навигации, донного кесарева сечения/корпорального кесарева сечения в нижнем маточном сегменте, комплексного компрессионного гемостаза, баллонной тампонады матки, метропластики. Во всех случаях было осуществлено патоморфологическое исследование для подтверждения диагноза. Операции проводились в условиях интраоперационной реинфузии аутоэритроцитов на аппарате «Cell-Saver 5».
Статистический анализ проводился с использованием программы StatTech v. 2.8.81. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова-Смирнова. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1 – Q3). Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела-Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Различия считались статистически значимыми при p < 0,05.
Результаты и обсуждение
Для описания клинико-анамнестических данных все пациентки были разделены на две группы:
- первая группа – с объемом кровопотери до 1500 мл;
- вторая группа – с объемом кровопотери более 1500 мл.
Средний возраст пациенток с подтвержденным диагнозом врастания плаценты составил 35,1 ± 4,5 года в первой группе и 36,5 ± 3,0 года – во второй. Анализ антропометрических показателей не показал различий в группах. Средний рост в первой группе составил 162,3 ± 5,7 см, во второй группе – 164,2 ± 5,3 см (р = 0,1033). ИМТ не имел значимых различий между группами и составил 27,5 ± 4,3 кг/м2 и 26,9 ± 4,6 кг/м2 соответственно (р = 0,458) (таблица).
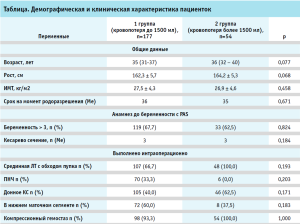
Исследуемые пациентки были классифицированы по анатомо-топографической классификации: 75 были идентифицированы как тип 1 (Т1), 13 – как тип 2 (Т2), 22 отнесены к третьему типу (Т3) и 34 – к четвертому типу (Т4). Также была выделена дополнительная группа (Т0), n = 87, к которой отнесено врастание плаценты, не выходящее за пределы матки, без распространения на мочевой пузырь (рис.1).
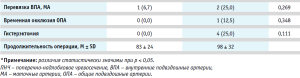
В общей сложности, 76 женщин были прооперированы с использованием модифицированного разреза по Пфанненштилю и 155 – с использованием лапаротомного разреза по средней линии живота с обходом пупка слева. Девять процентов женщин были прооперированы в экстренном порядке (7 % из них – в связи с начавшимся кровотечением и 2% – из-за начала родовой деятельности/излития околоплодных вод). Гистерэктомия была выполнена в четырех случаях (один из них – из-за врастания плаценты в шейку матки и нижнюю треть задней стенки мочевого пузыря, а остальные три – в связи прогрессирующим интраоперационным кровотечением. Органосохраняющие операции были применимы у первого и второго типа инвазии в 100 % случаев, у третьего типа – 21/22 (95,4%) случаев и у четвертого типа – 31/34 (91,1%). В 100 % случаев был применен комплексный компрессионный гемостаз. Родоразрешение пациенток проводили между 35 и 36 неделями беременности при отсутствии показаний и экстренных ситуаций как у матери, так и у плода.
При анализе объема кровопотери со степенью анатомо-топографической инвазии была выявлена статистически значимая разница между средним объемом кровопотери. В группах Т0 и Т1 объем составил 800 мл, в группе Т2 – 900 мл, Т3 – 2100 мл и в группе Т4 – 1750 мл (рис. 2).

Анатомо-топографическая классификация позволила спрогнозировать вероятность кровотечения, послеоперационных осложнений и возможность метропластики и сохранение органа. Знание анатомии малого таза, расположения сосудистых пучков позволяет использовать технику комплексного компрессионного гемостаза. Новая классификация может быть применена даже при недиагностированном врастании плаценты, выявленном интраоперационно, с использованием простых методик во время операции, таких как низведение мочевого пузыря с прицельной коагуляцией сосудов и/или их перевязкой. Применение комплексного компрессионного гемостаза за счет наложения турникетных жгутов максимально близко на основные пути кровоснабжения матки способствует механической окклюзии ее сосудов, что позволяет значительно снизить интраоперационную кровопотерю. В условиях работы турникетных жгутов и снижения кровопотери возможно проведение органосохраняющей операции.
Заключение
Беременные с врастанием плаценты представляют группу высокого риска по развитию массивного кровотечения и послеоперационных осложнений. В исследовании была определена взаимосвязь объема кровопотери и типа инвазии плаценты, выявленного интраоперационно. Внедрение новой интраоперационной классификации позволяет вовремя принять оптимальные решения: вызвать хирургов при сложных типах инвазии, определить хирургическую тактику, снизить объем кровопотери, сократить частоту трансфузионной терапии, уменьшить случаи тяжелой послеоперационной анемии и, самое главное, – сохранить репродуктивную функцию женщины.
_______________________________________________________________________
1 Разработчик – ООО «Статтех», Россия.
- Jauniaux E., Alfirevic Z., Bhide A. [et al.] Placenta Praevia and Placenta Accreta: Diagnosis and Management: Green-top Guideline No. 27a. BJOG. 2018: 126(1), e1-e48.
- Jauniaux E., Ayres-de-Campos D. [et al.] FIGO consensus guidelines on placenta accreta spectrum disorders: introduction. International Journal of Gynaecology and Obstetrics. 2018; 40(3):261–264. DOI:10.1002/ijgo.12406.
- Jauniaux E., Collins S., Burton G. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. American journal of obstetrics and gynecology. 2018; 218(1): 75–87.
- Balayla J., Bondarenko H. Placenta accreta and the risk of adverse maternal and neonatal outcomes. Journal of perinatal medicine. 2013; 41(2): 141–149.
- Jauniaux E., Ayres-de-Campos D., Langhoff-Roos J. [et al.] FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders. Int J Gynaecol Obstet. 2019; 146(1): 20–24.
- Pegu B., Thiagaraju C., Nayak D. [et al.] Placenta accreta spectrum-a catastrophic situation in obstetrics. Obstetrics & Gynecology Science. 2021; 64(3): 239–247.
- Donovan, B., Shainker S. Placenta Accreta Spectrum. NeoReviews. 2021; 22(11): e722-e733.
- Учеваткина П.В., Быченко В.Г., Кулабухова Е.А., Лужина И.А., Шмаков Р.Г. Система унифицированного подхода к интерпретации магнитно-резонансной томографии при диагностике патологического прикрепления плаценты «mapi-rads» (morbidly adherent placenta imaging reporting and data system) // Российский электронный журнал лучевой диагностики. – 2021. – Т. 11. – № 1. – С. 174–190. DOI: 10.21569/2222-7415-2021-11-1-174-190.
- Bhatia A., Palacio M., Wright A. [et al.] Lower uterine segment scar assessment at 11–14 weeks’ gestation to screen for placenta accreta spectrum in women with prior Cesarean delivery. Ultrasound in Obstetrics & Gynecology. 2022; 59(1): 40–48.
- Palacios-Jaraquemada J.M. Placenta adhesive disorders. 1st ed. Berlin: De Gruyter Editors; 2012. 171 p.
