ЛАБОРАТОРНАЯ ДЕЯТЕЛЬНОСТЬ
Правила принятия решения о соответствии. Требования, возможности
1 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, филиал в г. Курск, 305040, Российская Федерация, Курская область, г. Курск, ул. 50 лет Октября, д. 122 (литер Б).
ORCID: https://orcid.org/0000-0002-9667-1014
2 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, филиал в г. Курск, 305040, Российская Федерация, Курская область, г. Курск, ул. 50 лет Октября, д. 122 (литер Б).
ORCID: https://orcid.org/0000-0002-7212-338X
В статье представлен современный подход к выбору правил принятия решений в испытательных лабораториях ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора в соответствии с требованиями Межгосударственного стандарта ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий».
Ключевые слова: риск-ориентированный подход, оценка соответствия, поле допуска, защитная полоса, приемочная граница, правила принятия решений
Согласно определению ГОСТ ИСО/МЭК 17000-2012, оценка соответствия – это доказательство того, что заданные требования к продукции, процессу, системе, лицу или органу выполнены [7]. Испытания лекарственных средств – основной вид деятельности лабораторных комплексов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора. Он относится к отдельному виду оценки соответствия, иногда называемому контролем, и устанавливает, что продукция удовлетворяет заданным требованиям, основывается на измерении, как основном источнике информации.
Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» трактует определение «качество лекарственного средства» как соответствие лекарственного средства требованиям фармакопейной статьи либо, в случае ее отсутствия, нормативной документации или нормативного документа.
Таким образом, заключение о качестве конкретного образца лекарственного средства выносится на основании ряда испытаний по отдельным показателям качества и является комплексным решением, требующим отдельного заключения по каждому из показателей, оцениваемых исключительно как альтернативные признаки, то есть требующих принятия строго либо положительного, либо отрицательного решения.
При этом значительная часть показателей в анализе лекарственных средств оценивается количественно, что требует установления четких критериев оценки таких количественных значений при вынесении альтернативного решения, особенно в областях пограничных значений.
Результаты исследований или испытаний – это не события. В результатах испытаний бывают ошибки. С помощью испытаний мы получаем вероятности определенного исхода. Полученные результаты испытания должны учитывать ошибки метода. Если наши испытания совершенны и точны, тогда вероятности испытаний и вероятности событий совпадут. Все положительные результаты будут действительно положительными, а отрицательные — отрицательными. Но мы живем в реальном мире. И в нашем мире испытания могут давать и неверные результаты. Согласно теореме Байеса, если нам известна вероятность события и вероятность ложноположительных и ложноотрицательных результатов, мы можем исправить ошибки измерений. Исходя из сказанного, система менеджмента качества испытательных лабораторий должна предусматривать инструменты решений возможных несоответствий, в том числе и документированных процедур, которые становятся правилами испытательной лаборатории.
В первую очередь необходимо определиться с понятием «риск» как следствием влияния неопределенности на достижение целей. Под следствием влияния неопределенности понимается отклонение фактического результата от ожидаемого. Неопределенность является состоянием, связанным с недостатком, даже частичным, информации, понимания или знания о событии, его последствиях или вероятности. Из-за неопределенности измерения всегда существует риск ошибочного принятия решения в отношении соответствия или несоответствия объекта установленным требованиям на основании измеренного значения свойства объекта.
Такие ошибочные решения бывают двух типов: объект, признанный соответствующим, может на самом деле оказаться несоответствующим, и объект, забракованный как несоответствующий, может на самом деле оказаться соответствующим.
В части понимания ответственности испытательной лаборатории (потребителя) и заказчика (производителя) можно выделить следующие риски:
а) частный риск потребителя (specific consumer’s risk) – вероятность того, что конкретный принятый объект окажется несоответствующим;
б) частный риск производителя (specific producer’s risk) – вероятность того, что конкретный забракованный объект окажется соответствующим;
в) глобальный риск потребителя, риск потребителя (global consumer’s risk, consumer’s risk) – вероятность того, что на основании выполненного в будущем результата измерения несоответствующий объект будет принят как годный;
г) глобальный риск производителя, риск производителя (global producer’s risk, producer’s risk) – вероятность того, что на основании выполненного в будущем результата измерения соответствующий объект будет забракован.
И, как следствие, риск-ориентированный подход – это комплекс взаимосвязанных методов и инструментов осуществления деятельности испытательных лабораторий ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения», предусматривающих планирование, проведение контрольных и экспертно-аналитических мероприятий с использованием результатов оценки рисков.
Применение риск-ориентированного подхода при осуществлении экспертной деятельности основывается на следующих принципах:
- применение риск-ориентированного подхода как части процесса принятия решений при планировании работы испытательных лабораторий;
- рациональное использование специальных знаний, опыта, квалификации сотрудников испытательной лаборатории;
- информированность о рисках.
ISO/IEC 17025 в пункте 3.7 ввел новый термин – правило принятия решения (decision rule) – это задокументированное правило, которое описывает для заданного требования и результата измерения способ учета неопределенности измерения при приемке или браковке объекта исследования. Однако данный стандарт констатирует, что единого правила принятия решения, которое можно применить во всех областях аккредитации, для всех заявлений о соответствии, не существует.
Испытательная лаборатория не обязана делать заключения о соответствии, но необходимость принятия данного решения может являться требованием заказчика (в пункте 7.1.3 стандарта ISO/IEC 17025:2017 указано, что запрос на представление заключения о соответствии должен исходить от заказчика). В случае испытаний лекарственных средств в рамках федерального контроля (надзора), заказчиком работ выступает Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор), и ее требованием является представление однозначного заключения о качестве конкретного образца отобранной серии лекарственных средств, представленных на анализ. Таким образом, лабораторные центры ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» в ходе своей основной деятельности рутинно сталкиваются с необходимостью принятия решений на основании установленных правил.
Кроме того, в пункте 7.8.3.1 b [1] установлено, что «испытательные лаборатории должны представлять заключения о соответствии, если это необходимо для интерпретации результатов». В любом случае, правила принятия решения согласовываются на этапе разработки и заключения контракта. При этом существует два решения: заказчик предлагает использовать для заключения о соответствии собственные правила принятия решения или лаборатория должна (в соответствии с контрактом) предложить свой вариант правила принятия решения.
Заявление о соответствии или заключение о соответствии – это четкое описание состояния соответствия или несоответствия спецификации, стандарту или требованию. Для рассмотрения возможных вариантов правил принятия решения приведем ряд необходимых терминов и их определений:
- контроль – оценка соответствия путем наблюдения и принятия решения, сопровождаемая, в случае необходимости, измерением, испытанием или калибровкой;
- поле допуска – интервал допустимых значений свойства;
- приемочная граница – заданные верхнее или нижнее предельное значение для допустимых измеренных значений величины;
- защитная полоса – интервал между границей поля допуска и соответствующей приемочной границей1.
Интервалы допустимых значений, называемые полями допусков, бывают двух видов:
1) одностороннее поле допуска либо с верхней, либо с нижней границей поля допуска;
2) двустороннее поле допуска и с верхней и с нижней границами поля допуска.
В любом случае объект соответствует заданному требованию, если истинное значение измеряемой величины лежит внутри поля допуска, и не соответствует – в обратном случае.
Ниже приведены примеры границ полей допусков.
Заданные в явном виде верхняя и нижняя границы поля допуска:
- Номинальное содержание левофлоксацина (Х) в 1 мл препарата Левофлоксацин-Нова, раствор для инфузий 5 мг/мл 100 мл, составляет 5 мг. Указаны требования, что содержание левофлоксацина в 1 мл препарата должно быть от 4,5 до 5,5 мг/мл. Содержание левофлоксацина (X) в 1 мл препарата, в мг лежит в интервале 4,5мг/мл < Х < 5,5мг/мл.
- Номинальное содержание кеторолака трометамина (Х) в 1 г препарата Кеторол®, гель для наружного применения 2% 30 г, составляет 20 мг. Указаны требования, что содержание кеторолака трометамина (Х) в 1 г геля должно быть от 90% до 110% от заявленного количества кеторолака трометамина. Содержание кеторолака трометамина (Х) в 1 г препарата, в % лежит в интервале 90% < Х < 110%.
- Номинальное содержание аморолфина (Х) в 1 мл препарата Аморолфин, лак для ногтей лекарственный 5% 5 мл, составляет 50 мг. Указаны требования, что содержание аморолфина в 1 мл препарата должно быть от 90% до 110%. Содержание аморолфина (X) в 1 мл препарата, в мг лежит в интервале 90% < Х < 110%.
Заданная в явном виде нижняя граница поля допуска и неявная верхняя граница поля допуска:
- Стандартный образец левофлоксацина (USP RS) имеет чистоту Р 97,3%, что является заданной в явном виде нижней границей поля допуска. Чистота не может быть больше 100%, что является неявной верхней границей поля допуска. Соответствующий заданным требованиям стандартный образец левофлоксацина – это такой образец, чистота которого лежит в интервале 97,3% < Х < 100%. Варианты принятия решений могут быть следующими:
- Бинарное (двоичное) заявление.
1.1. Бинарное заявление для правила простого принятия без защитной полосы (w = 0, AL = TL). Одним из главных и широко используемых правил принятия решений является правило, известное как простая приемка или совместный риск. Совместный риск – это риск, основанный на соглашении между сторонами, заинтересованными в результате испытания, о том, что ни одна из сторон не получит преимущество или не будет нести убытки из-за учета неопределенности измерений. Результат предполагается соответствующим требованиям, если измеренное значение лежит в области соответствия, и несоответствующим требованиям, если измеренное значение лежит в области несоответствия (рис. 1).
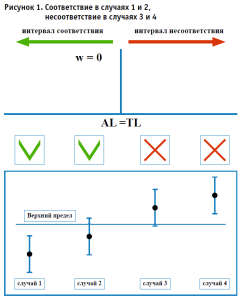
В данном случае неопределенность не учитывается, т.к. речь идет об измеренном значении, а не о результате измерения. Но в таком случае возникает риск ложной приемки и/или риск ложной браковки. Вероятность оказаться вне поля допуска может достигать 50% в том случае, если измеренное значение находится строго на пределе поля допуска (подразумевается симметричное нормальное распределение результатов).
1.2. Бинарное (двоичное) заявление с защитной полосой (w = U, AL = TL + w), где U – расширенная неопределенность измерения. При верхнем пределе приемки w = U, AL = TL – w.
Приемка или браковка объекта в случае, когда измеренное значение его исследуемого свойства находится рядом с границей поля допуска, может привести к неправильному решению и оказаться причиной нежелательных последствий. В случае одностороннего поля допуска, имеющего одиночную верхнюю границу, такие неправильные решения обычно бывают двух типов (рис. 2). Результат предполагается соответствующим требованиям, если измеренное значение лежит в области соответствия, и несоответствующим требованиям, если измеренное значение лежит в области несоответствия.
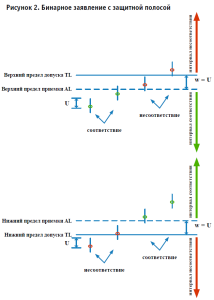
Защитная полоса – интервал между границей поля допуска и соответствующей приемочной границей, где w = |TL – AL|.
Следует учитывать, что измерение может привести к принятию решения о соответствии с использованием одной защитной полосы и отклонению, если используется большая защитная полоса. Исходя из этого, соответствие неразрывно связано с применяемым правилом принятия решения. Поэтому соответствие какомулибо требованию неразрывно связано с применяемым правилом принятия решения:
w = kα × u,
где k – коэффициент охвата, значение которого зависит от заданной вероятности ошибочного решения и распределения измеряемой величины.
Данные о коэффициенте охвата, используемом для вычисления расширенной неопределенности, выбираются в зависимости от количества измерений.
Приведем пример. При анализе качества лекарственного препарата «Кеторол®, гель для наружного применения 2% 30 г, тубы (1), пачки картонные» проводят количественное определение диметилсульфоксида. Норма содержания диметилсульфоксида составляет от 90% до 110%. Измеряемая величина – содержание диметилсульфоксида в геле в процентах. Результат измерения (97,35 ± 1,792)%, k = 2,26, Р = 95%; u = U/k = 1,79/2,26 = 0,79%
Правила принятия решений: предел принятия решения соответствует содержанию диметилсульфоксида, при котором с вероятностью приблизительно 95 % можно сделать заключение, что содержание диметилсульфоксида в лекарственном препарате «Кеторол®, гель для наружного применения 2% 30 г, тубы (1), пачки картонные» не превысит верхний и не будет ниже заданного предела. (рис. 3).
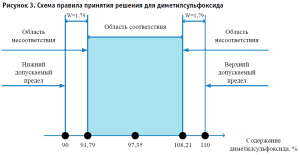
Рассчитываем защитную полосу:
w = 2,26 × 0,79 = 1,79%.
Верхний предел принятия решений:
110 – 1,79 = 108,21%.
Нижний предел принятия решений:
90 + 1,79 = 91,79%.
- Небинарное заявление с защитной полосой (соответствует / условно соответствует / условно не соответствует / не соответствует).
Результат предполагается соответствующим требованиям, если результат измерения ниже приемочной границы (AL) (см. рис. 4).

Результат предполагается несоответствующим требованиям, если результат измерения выше приемочной границы (AL) и верхнего предела (TL).
Результат предполагается условно соответствующим требованиям, если результат измерения внутри защитной полосы и ниже верхнего предела (TL).
Результат предполагается условно несоответствующим требованиям, если результат измерения внутри защитной полосы и выше верхнего предела (TL).
И для заказчика (производителя), и для исполнителя (испытательной лаборатории) при заключении контрактных обязательств должно быть определено, что пределы допуска соответствуют требованиям (спецификации, НД, стандартов качества и т.д.). Все расчеты, в том числе и неопределенности измерения, выполняются в соответствии с требованиями ISO/IEC 17025:2017. Уменьшение неопределенности, связанной с результатом, полученным при выполнении измерения с целью оценки соответствия, также снизит вероятность принятия неверного решения о приемке/браковке.
Согласованное правило принятия решений, примененное при представлении заключений о соответствии, должно быть четко документировано и отражено в отчетах (протоколах). Документированные процедуры (СОП), определяющие правило принятия решения, должны соответствовать сложности правила. Необходимая документация должна включать:
а) документирование статистических предположений, включая тип риска (специфический или глобальный), расчет неопределенности измерения (пункт 7.8.6.1 [1]);
б) документацию по типу оценки соответствия и заключений о соответствии (пункт 7.8.6.2 [1]);
в) совместимость документации по правилам принятия решений с записями по испытаниям (пункт 7.8.6.2 [1]).
_______________________________________________________________________
1 Защитная полоса включает границы.
2 Неопределенность измерений включает неопределенность прибора и методики анализа.
- ISO/IEC 17025:2017 Общие требования к компетентности испытательных и калибровочных лабораторий.
- JCGM 106:2012 Оценивание данных измерений – Роль неопределенности измерений в оценке соответствия.
- ASME, B89.7.3.1-2001 Руководство по правилам принятия решений: учет неопределенности измерений при определении соответствия спецификациям.
- JCGM 200:2012 (VIM) Международный словарь основных и общих терминов в метрологии, 3-е издание.
- ILAC-08:09/2019 Руководство по правилам принятия решения и заключениям о соответствии требованиям.
- ГОСТ ISO/IEC 17025-2019 Общие требования к компетентности испытательных и калибровочных лабораторий.
- ГОСТ ISO/IEC 17000-2012 Межгосударственный стандарт Оценка соответствия. Словарь и общие принципы.
